马铃薯根际与非根际土壤微生物群落结构及多样性特征
2020-02-21葛应兰孙廷
葛应兰,孙廷
南阳农业职业学院农业科学系,河南 南阳 473007
土壤微生物是土壤中元素循环、有机质分解、土壤矿化等地球化学循环过程中的重要参与者,也是土壤物质循环的主要驱动者,参与并维持农业土壤的健康和生产力(Leff et al.,2015;Carini et al.,2017;Lange et al.,2015)。土壤微生物的多样性对土壤生态系统的功能、可持续性和完整性至关重要,近年来越来越多的研究表明,较高的微生物多样性可以增强生态系统和微生物功能的稳定性(Lu et al.,2015;Deng et al.,2016)。根际土壤是直接受植物根系和分泌物影响的土壤区域,是土壤微生物与植物相互作用的重要场所(Lu et al.,2015)。根际土壤微生物与根系之间存在适应性协同进化关系,并形成植物-微生物之间的互惠关系(Wang et al.,2016;Bakker et al.,2015;Walters et al.,2018)。植物通过根系活动改变根际土壤的养分含量及其他土壤理化性质,改变根际微生物群落的组成,使得根际与非根际土微生物群落组成和多样性上具有明显的差异(Wang et al.,2016;Bakker et al.,2015)。根际微生物对植物生长具有重要的作用,促植物生长细菌(PGPR)通过自身代谢活动将土壤营养物质分解、转化为植物可吸收利用的形态,促进植物生长,部分细菌分泌的激素等物质可提高植物的适应性(Walters et al.,2018)。根际土壤微生物的群落结构受植物影响,如植物种类、生长阶段、健康状况,另外,土壤理化性质对微生物群落也具有重要的影响,如土壤营养状况、水分和pH、温度(Lladó et al.,2018;Lu et al.,2015)。
马铃薯是中国农业生产中主栽作物之一,近年来,随着栽培面积持续扩大,马铃薯种植的土壤问题日渐突出,缓解或消除马铃薯土壤贫瘠等问题障碍迫在眉睫(张立超等,2017;王丽红等,2016)。已有研究表明,多年种植马铃薯后会对土壤微生物产生抑制作用,使土壤微生物总数、细菌数量减少,真菌数量增加(Uroz et al.,2016;Hou et al.,2015)。随着种植年限的增加,细菌种类及数量不断减少,特别是芽孢杆菌和放线菌等种类的改变,致使土壤微生物群落多样性水平呈下降趋势(孙梦媛等,2017)。因此,加深对土壤微生物群落结构、功能的了解,能够阐明马铃薯种植后土壤微生物的影响机制。本研究利用Illumina-MiSeq高通量测序技术对马铃薯根际与非根际土壤中细菌的16S rDNA基因V3-V4区片段和真菌18S rDNA基因V4区片段进行了测序,研究马铃薯根际与非根际土壤微生物群落多样性及其与土壤养分之间的关系,为研究马铃薯健康种植提供理论数据。
1 材料与方法
1.1 样品采集
供试马铃薯为庄薯3号,种植面积为50 m ×50 m。于2018年马铃薯盛花期(4月中)采集根际土壤样本,选择3块50 m ×50 m的重复样地,每个样地选5株长势一致的马铃薯植株,采用抖根法(Lu et al.,2015)收集根际土壤,在根系周围2—5 cm的位置采集非根际土,同一样方内的土样混合均匀作为一个混合样,所有土壤样品立即带回实验室,4 ℃冰箱保存。共采集15个根际样品和15个非根际样品。混匀的土样一部分风干保存,测定土壤理化性质,另一部分新鲜土壤用于提取微生物总DNA进行高通量测序。
1.2 土壤理化性质
对于pH值、有机碳SOC、全氮TN的测定,分别借助于pH测量计、容重法及硝化法进行;通过电导仪测定电导率 EC,并通过其估算含盐量;对于总磷和速效磷采用钼锑抗比色法,速效氮采用光度计法(Zhalnina et al.,2018)。
1.3 土壤总DNA提取
利用 Fast DNA spin kit for soil试剂盒(MP BIO,Inc.,Irvine,CA,USA)进行 DNA提取,根据制造商提供的说明进行操作。洗脱后总 DNA体积为50 μL。利用1%的琼脂糖凝胶泳提取总DNA(电泳条带的单一性),同时用NanoDrop ND-1000微光分光光度计测定其浓度。
1.4 土壤微生物基因组DNA的提取
吸取1 mL根际土壤溶液至2 mL无菌离心管中,于4 ℃、10000 g离心30 s,弃上清,所得沉淀用于根际土壤微生物基因组DNA提取;对非根际土,用无菌药匙取大约0.2 g土壤(湿重),加入2 mL无菌离心管中,用于提取基因组DNA。利用OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒(OMEGA)提取基因组DNA,利用1%琼脂糖凝胶检测 DNA的长度和完整性,利用NanoDrop检测DNA的浓度和纯度。
1.5 DNA扩增及测序
采用两轮法对细菌16S rDNA V3-V4区进行扩增,第一轮扩增利用融合了barcode序列的通用引物进行,上游引物 341F:ccctacacgacgctcttccgatctg(barcode)cctacgggnggcwgcag,下游引物 805R:gactggagttcctt ggcacccgagaattccagactachvgggtatctaatcc;真菌 18S rDNA扩增,第一轮扩增利用融合了barcode 序列的通用引物进行,上下游引物序列:NS1:cctacacgacgctctt ccgatctn(barcode)gtagtcatatgcttgtctc,Fung:gactggagtt ccttggcacccgagaattccaattccccgttacccgt tg。反应体系30 μL,包含15 μL 2×Taq master Mix(Thermo),引物(10 μmol·L-1)各 1 μL,模板 DNA 20 ng。扩增条件:94 ℃3 min,94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,扩增 5个循环;94 ℃ 20 s,55℃ 20 s,72 ℃ 30 s,扩增20循环,72 ℃延伸5 min。第二轮扩增使用Illumina桥式PCR兼容引物,以第一轮的PCR产物为模板。反应体系同上。扩增条件:95 ℃ 30 s,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s,扩增5个循环,72 ℃延伸5 min。PCR产物经磁珠法回收并定量。将每个重复个体的 PCR产物等量混合,每份混合样品包含相应的全部重复个体,将混合样品送至生工(上海)生物工程有限公司,利用Illumina-MiSeq平台进行高通量测序(Uroz et al.,2016;Hou et al.,2015)。
1.6 数据分析
测序原始数据去除引物接头序列、去除各低质量碱基(Phred Quality Score=20)后进行拼接,舍弃长度短于200 bp的序列,去除非特异性扩增序列及嵌合体后,得到每个样本的有效序列数据。以97%为划定阈值,对16S和18S序列划分操作分类单元(operational taxonomic unit,OTU)。根据样本OTUs组成之间的weighted unifrac 距离矩阵,采用主成分分析(PCA)分析微生物群落之间的相似性;Pearson相关系数检验微生物多样性与土壤养分之间的相关性;利用Canoco 4.5软件对土壤养分和微生物群落多样性指数进行冗余分析(Reundancy analysis,RDA)(Shi et al.,2016)。
2 结果分析
2.1 土壤养分
由表 1可知,马铃薯根际土壤 pH平均值为5.69,显著低于非根际(P<0.05);差异性检验表明,根际土壤电导率、有机碳、全氮速效氮和速效磷均显著高于非根际(P<0.05),而根际土壤全磷与非根际差异不显著(P>0.05)。

表1 马铃薯根际与非根际土壤养分Table 1 Soil nutrients of potato in rhizosphere and non-rhizosphere soil
2.2 土壤微生物群落多样性
由表2可知,马铃薯根际土壤细菌丰富度指数、Shannon-Wiener 指数、ACE、Chao 1指数均显著高于非根际(P<0.05);而根际土壤细菌覆盖度、均匀度和 Simpson指数与非根际差异不显著(P>0.05)。由表3可知,马铃薯根际土壤真菌丰富度指数、Shannon-Wiener指数、ACE、Chao 1指数均显著高于非根际(P<0.05);而根际土壤真菌覆盖度、均匀度和Simpson指数与非根际差异不显著(P>0.05)。
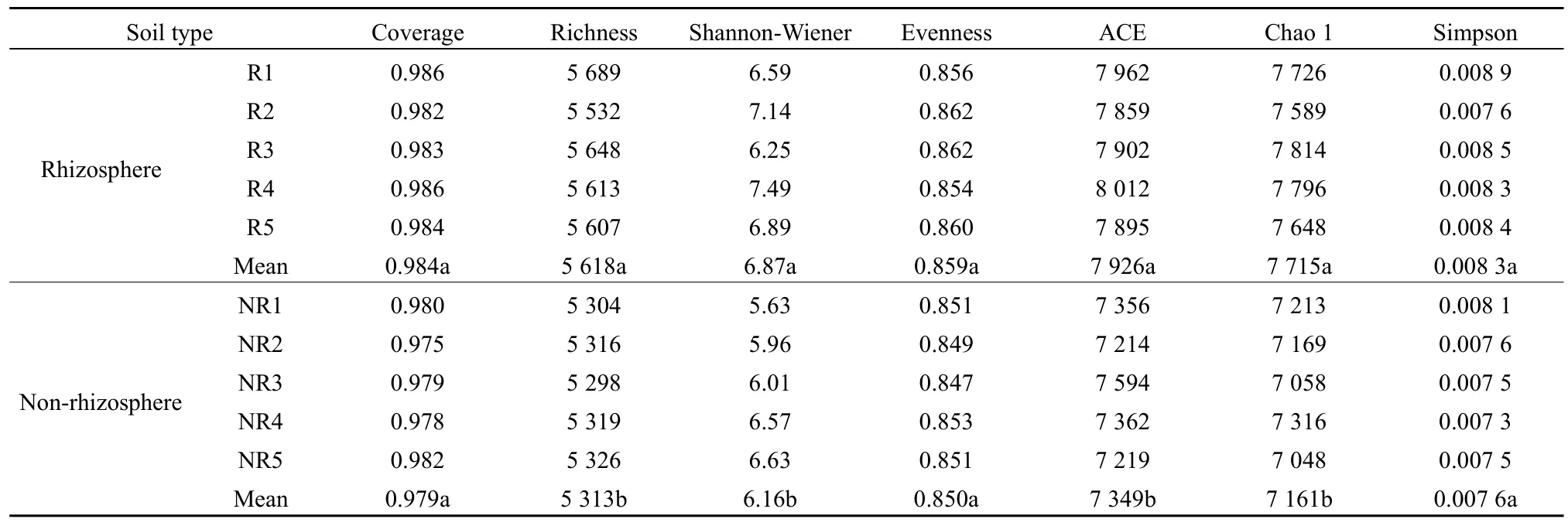
表2 马铃薯根际与非根际土壤细菌多样性Table 2 Bacterial diversity in rhizosphere and non-rhizosphere soil
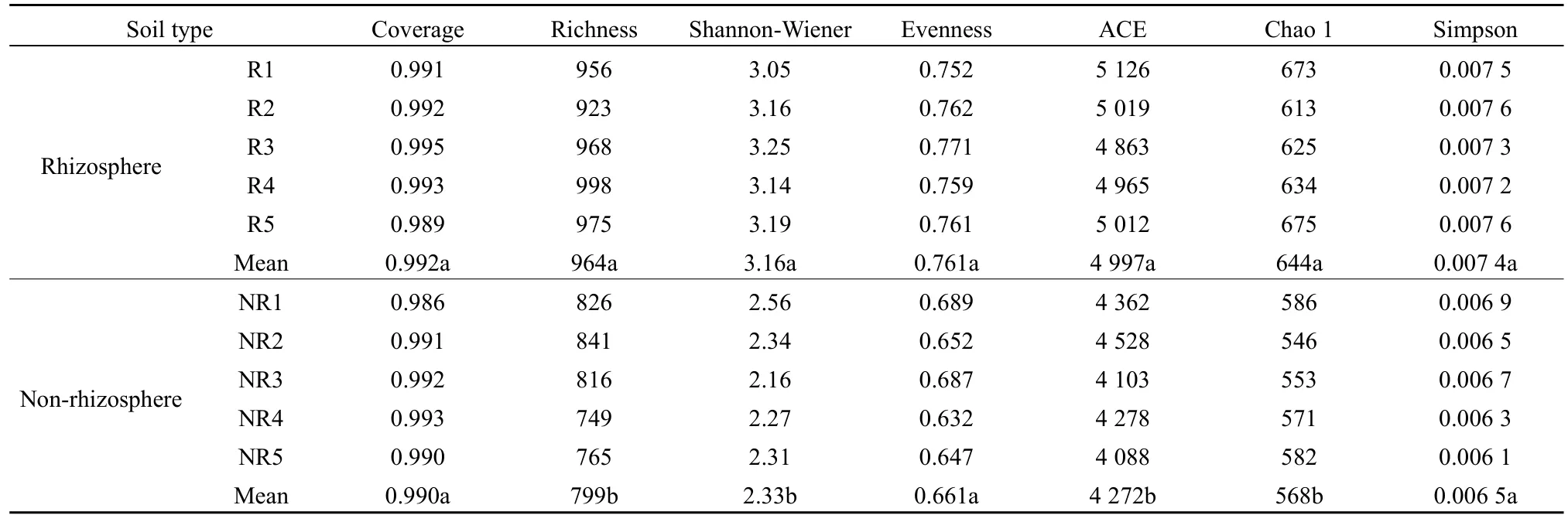
表3 马铃薯根际与非根际土壤真菌多样性Table 3 Fungal diversity in rhizosphere and non-rhizosphere soil
2.3 土壤微生物群落组成
由图1可知,马铃薯根际土壤细菌群落中,优势类群主要是变形菌门Proteobacteria(35.98%)、酸杆菌门 Acidobacteria(27.03%)和芽单胞菌门Gemmatimonadetes(9.14%),还有浮霉菌门Planctomycetaceae(4.03%)、放线菌门Actinobacteria(3.02%)、拟杆菌门Bacteroidetes(1.56%)、后壁菌门 Firmicutes(3.89%)、绿弯菌门 Chloroflexi(6.18%)、疣微菌门 Verrucomicrobia(3.01%)。非根际土壤细菌群落中,优势类群主要是变形菌门(46.02%)、酸杆菌门(23.17%)和芽单胞菌门(12.06%)。其中根际土壤细菌酸杆菌门相对丰度高于非根际,变形菌门相对丰度低于非根际。
马铃薯根际土壤真菌群落中,优势类群主要是子囊菌门 Ascomycota(53.03%)和担子菌门Basidiomycota(26.17%),还包括结合菌门Zygomycota(3.26%)、壶菌门 Chytridiomycota(0.58%)、新丽鞭毛菌门 Neocallimastigomycota(7.23%)、球囊菌门Glomeromycota(3.42%)、芽枝菌门 Blastocladiomycota(2.19%)。非根际土壤真菌群落中,优势类群主要是子囊菌门(50.16%)和担子菌门(30.18%)。主成分分析(PCA,图2)表明:马铃薯根际土壤和非根际土壤比较,细菌群落、真菌群落都具有很好的相似性,并且根际和非根际的细菌群落、真菌群落都产生明显的分离效应。

图1 土壤细菌(A)和真菌(B)群落组成Fig. 1 Bacterial (A) and fungal (B) community composition in rhizosphere and non-rhizosphere soil
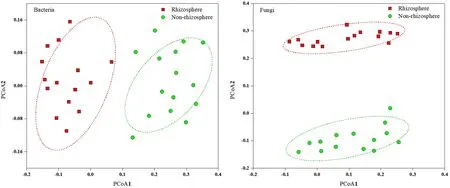
图2 基于Weighted unifrac距离的土壤微生物群落的主坐标分析(PCoA)Fig. 2 Principal coordinate analysis (PCoA) of soil microbial communities based on Weighted unifrac distance
2.4 土壤养分与细菌群落结构的相关性
相关性分析表明(表 4),马铃薯土壤细菌和真菌Coverage、ACE与土壤养分均没有显著相关性(P>0.05);土壤pH与土壤细菌和真菌多样性呈负相关,土壤电导率和全磷与土壤细菌和真菌多样性均没有显著相关性(P>0.05)。
土壤有机碳与细菌 Richness、Shannon呈极显著正相关(P<0.01),与细菌Chao 1和Simpson呈显著正相关(P<0.05);土壤有机碳与真菌Shannon呈极显著正相关(P<0.01),与真菌Richness、Chao 1和Simpson呈显著正相关(P<0.05)。土壤全氮与细菌 Richness、Shannon呈极显著正相关(P<0.01),与细菌Chao 1和Simpson呈显著正相关(P<0.05);土壤全氮与真菌Shannon呈极显正相关(P<0.01),与真菌 Richness、Chao 1 和 Simpson呈显著的正相关(P<0.05)。土壤速效氮与Richness、Shannon、Evenness、Chao 1和Simpson呈显著正相关(P<0.05),与真菌Shannon、Evenness、Chao 1和Simpson呈显著正相关(P<0.05)。土壤速效磷与细菌Shannon、Chao 1和Simpson呈极显著正相关(P<0.01),与 Evenness呈显著正相关(P<0.05);土壤速效磷与真菌Shannon、Evenness、Chao 1和Simpson呈显著正相关(P<0.05)。
2.5 土壤微生物群落与土壤养分的关系
马铃薯根际土壤细菌和真菌群落与土壤环境因子的冗余分析结果见表 5。蒙特卡罗置换检验结果显示,第一典范轴P值为0.469(F=32.16),所有典范轴的P值为0.902,表明该排序模型的解释变量(即土壤环境因子)与响应变量(即土壤细菌和真菌群落结构)的变化关系较为显著。
由图3可知,对于土壤细菌群落,RDA前两个排序轴的特征值分别为0.6498和0.2147,分别解释了64.98%和21.47%的细菌多样性变化。所选的7个土壤环境因子共解释了86%的总特征值,对马铃薯根际土壤细菌多样性有显著影响。其中对土壤细菌多样性影响较大的有SOC和TN,而pH对土壤细菌多样性影响为负。
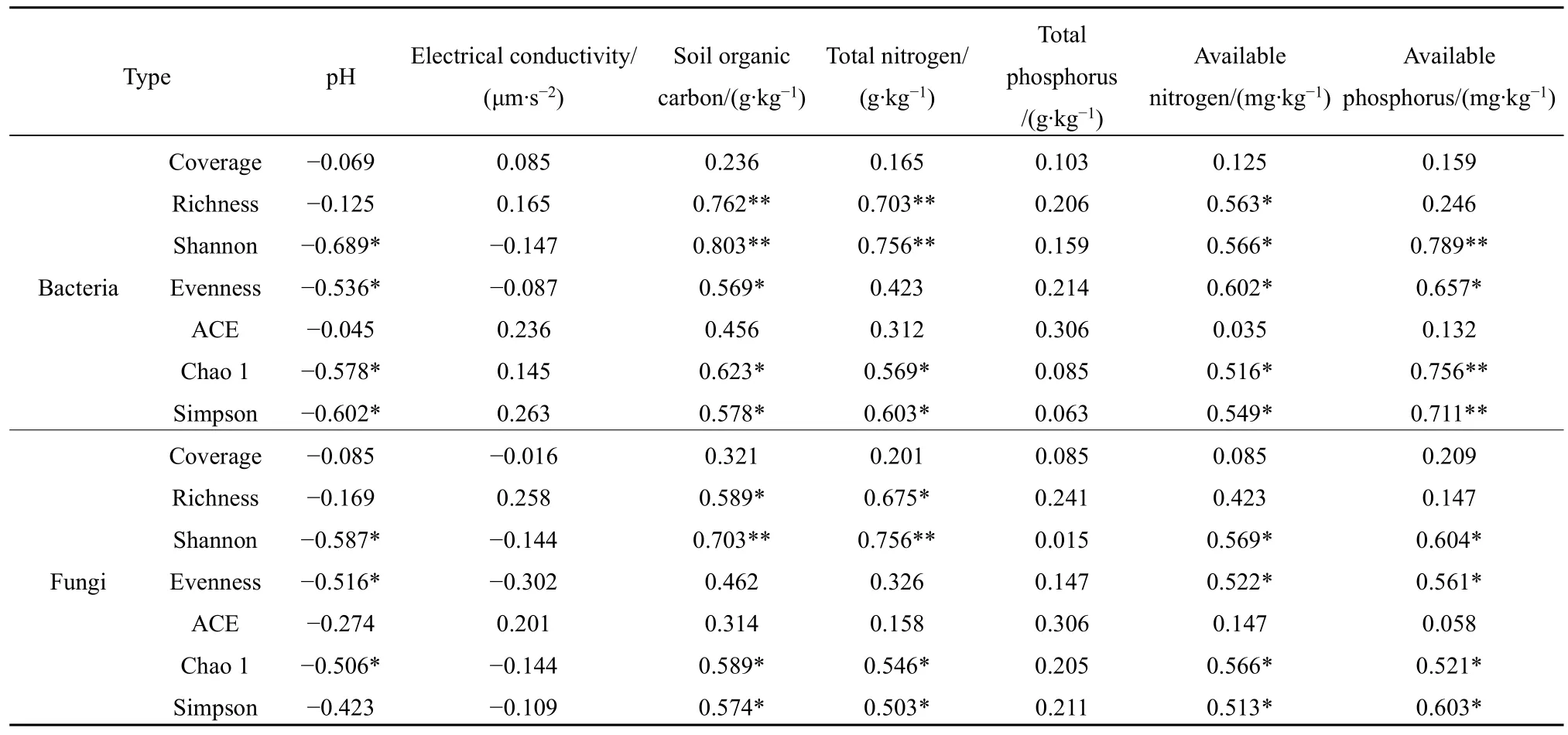
表4 土壤养分与土壤细菌和真菌多样性相关性Table 4 Soil nutrients related to the diversity of soil bacteria and fungi
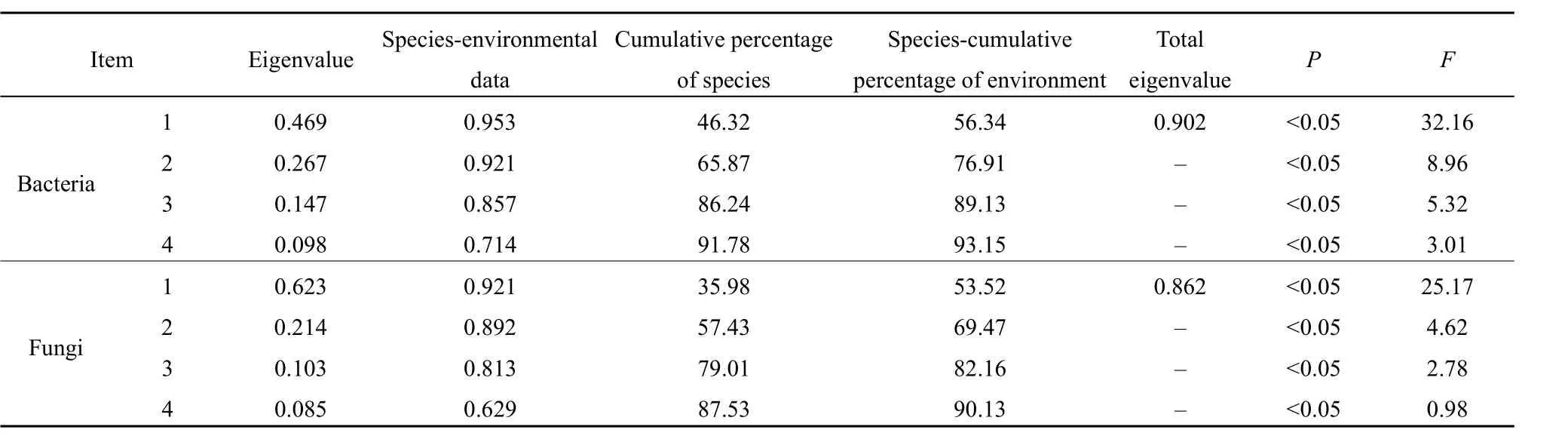
表5 冗余分析结果Table 5 Redundant analysis results
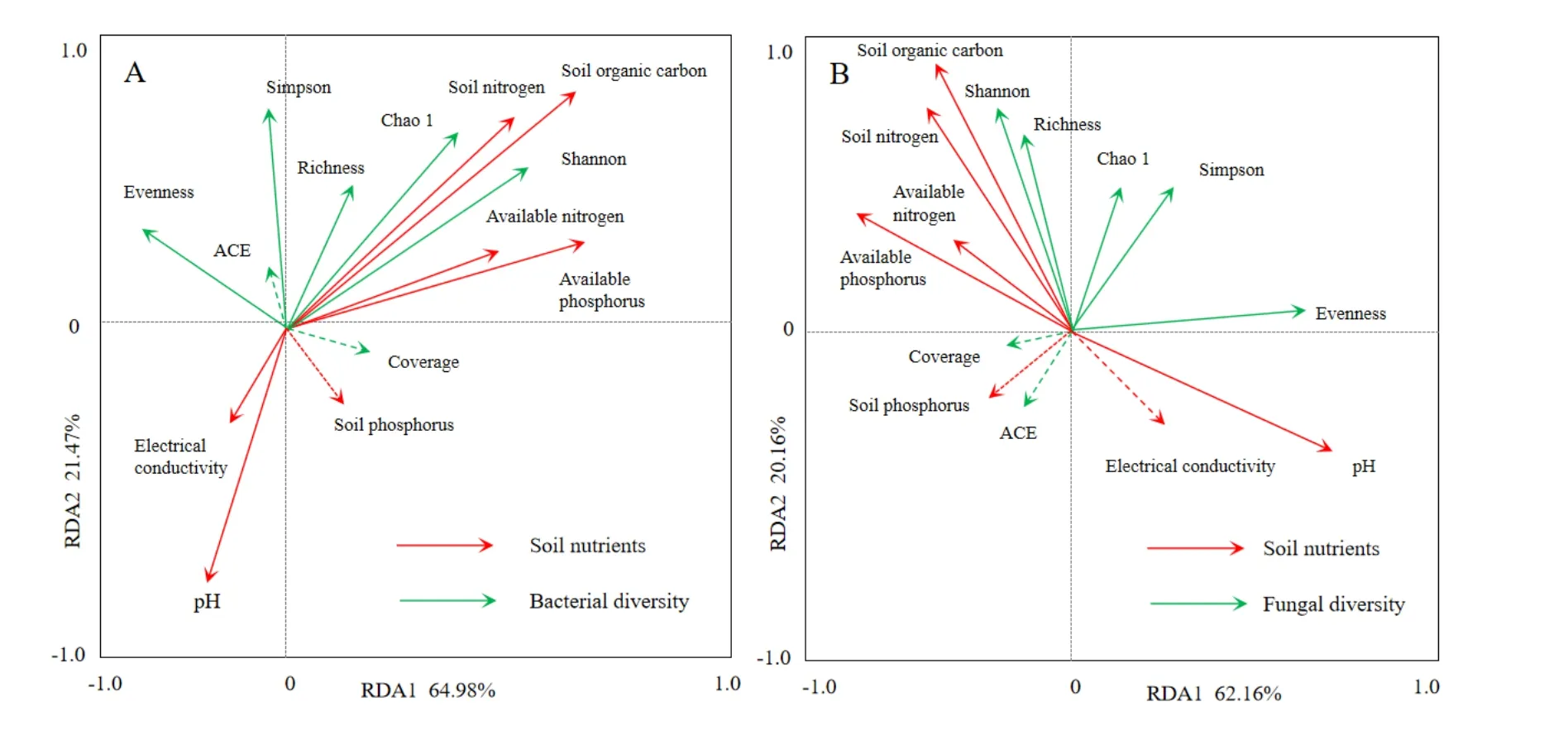
图3 土壤细菌(A)和真菌(B)多样性指数与环境因子的关系Fig. 3 Soil bacterial diversity index(A) and fungal diversity index (B) related to environmental factors
对于土壤真菌群落,RDA前两个排序轴的特征值分别为0.6216和0.2016,分别解释了62.16%和20.16%的真菌多样性变化。所选的7个土壤环境因子共解释了82%的总特征值,对马铃薯根际土壤真菌多样性有显著影响。其中对土壤真菌多样性影响较大的有SOC和TN,而pH对土壤真菌多样性影响为负。
3 讨论
本研究中马铃薯非根际和根际土壤中细菌丰富度高,而真菌数量相对较少,这与土壤中微生物以细菌为主一致(Maarastawi et al.,2018;Whitman et al.,2017)。根际细菌多样性高于非根际细菌,而根际真菌多样性却低于非根际土壤。根际土壤中营养物质高于非根际土壤,有利于细菌的繁殖故丰富度和多样性较高。相关性分析也表明细菌多样性和组成与SOC、TN呈正相关,与以往研究相一致(Liang et al.,2016;Deng et al.,2015);而土壤真菌多为病原菌,不利于植物生长,可能被植物根系主动过滤,导致根际真菌多样性与非根际差异不显著(Taschen et al.,2017)。根际细菌、真菌群落组成与非根际土壤存在明显的差异,PCoA结果也表明非根际土壤与根际微生物群落分离明显,非根际土壤群落之间,以及根际土壤群落之间各具有较高的相似性。
门水平上,马铃薯根际和非根际土壤细菌群落中,优势类群主要是变形菌门、酸杆菌门和芽单胞菌门,还包括浮霉菌门、放线菌门、拟杆菌门、后壁菌门、绿弯菌门、疣微菌门,其中根际土壤细菌酸杆菌门相对丰度高于非根际,变形菌门相对丰度低于非根际。根际和非根际土壤真菌群落中,优势类群主要是子囊菌门和担子菌门,还包括结合菌门、壶菌门、新丽鞭毛菌门、球囊菌门、芽枝菌门。根际与非根际菌群的差异,一方面是因为根际土壤养分的含量高于非根际土,pH值低于非根际土,利于某些特定类群的增殖和丰度的提高(Taschen et al.,2017)。RDA结果表明,细菌和真菌群落结构与土壤SOC和TN呈正相关关系,而细菌和真菌群落结构与土壤pH呈负相关关系。总体上,根际土壤细菌群落多样性高于非根际,主要是由于根际土壤pH的酸化导致土壤养分含量较高,土壤微生物多样性较高(Li et al.,2016;Stewart et al.,2017;Zhang et al.,2015)。另一方面,是植物从自身代谢和健康出发,由根系主动选择形成的,gamma变形菌包含许多促植物生长细菌(PGPR),如具有固氮作用的芽孢杆菌属、固氮菌属,在生产和释放植物激素和土壤源植物病原菌(如真菌)的生物防治中有重要作用。alpha变形菌包含许多植物共生固氮菌,如Rhizobium、Rickettsia;delta变形菌的一些物种,如Desulfovibrio、Geobacter、Bdellovibrio等,对土壤硫循环具有重要作用,对植物生长有重要作用,因此在根际土壤中的丰富度明显高于非根际土壤;alpha和delta变形菌的丰度升高是在根际土壤中变形菌门的丰度显著高于非根际土的主要原因(Shen et al.,2015;Mellado-Vázquez et al.,2016)。
4 结论
马铃薯根际土壤pH显著低于非根际,根际土壤养分、土壤细菌和真菌群落多样性(丰富度指数、Shannon-Wiener指数、ACE、Chao 1指数)均显著高于非根际(P<0.05),而根际土壤全磷与非根际差异不显著(P>0.05),且根际优势群落相对丰度较高。土壤微生物群落多样性和组成在不同生境之间的差异与土壤理化性质密切相关,生境不同,根际微生物群落不同。研究发现马铃薯土壤根际和非根际细菌和真菌群落具有很好的相似性,并且根际和非根际细菌群落产生明显的分离效应。土壤环境因子对马铃薯土壤细菌和真菌多样性有显著影响,其中对土壤细菌和真菌多样性影响较大的有 SOC和TN,而pH对土壤细菌和真菌多样性影响为负。由此可知,在马铃薯的种植过程中,土壤pH值对根际微生物群落多样性起着重要的调节作用。
