基于氧化镍沉积硅胶固相萃取与液相色谱-质谱联用技术的2型糖尿病血清中咪唑丙酸的检测
2020-02-19王天琦余琼卫冯钰锜
王天琦, 余琼卫, 冯钰锜
(生物医学分析化学教育部重点实验室, 武汉大学化学与分子科学学院, 武汉 430072)
根据病因可将糖尿病分为4类, 其中2型糖尿病(T2D)是由胰岛素抵抗导致的胰岛素相对分泌不足引起的一类糖尿病[1,2]. 研究[3]表明, 咪唑丙酸是尿刊酸经尿刊酸还原酶(UrdA)作用后的代谢产物[4], 其通过激活哺乳动物雷帕霉素靶蛋白复合物1(Mammalian target of rapamycin, mTORC1), 促进胰岛素受体蛋白底物分子(IRS)分解, 引起人的胰岛素抵抗, 从而导致2型糖尿病的发生. 在2型糖尿病患者的肠道中, 可观察到通过尿刊酸代谢产生咪唑丙酸的菌群的丰度明显提高.
哺乳动物雷帕霉素靶蛋白(mTOR)是一类在分裂素、 营养物质(氨基酸、 葡萄糖和脂肪酸)、 激素作用下调节细胞生长和新陈代谢的细胞质激酶. mTOR在幼年期对有机体的生长发育至关重要, 但在生命后期将会驱动有机体走向衰老. 而mTOR的超活化, 则会加速细胞老化、 凋亡, 引起内分泌疾病、 胰岛素抵抗等生理疾病[5]; 同时也会导致糖尿病并发症, 如肾脏衰竭、 视网膜病及神经病等. 由于咪唑丙酸通过激活mTORC1阻断胰岛素信号传导[3], 因此, 与mTOR超活化相关的疾病均有可能受到咪唑丙酸的影响. 而部分人在尚未确诊糖尿病之前, 就已经受到并发症的困扰, 此时, 可以通过检测血清中咪唑丙酸的含量来区别潜在的糖尿病患者和正常人. 据统计, 全世界有4.15亿人患有糖尿病, 其中2型糖尿病患者占90%以上, 且预计有1.93亿人是潜在的糖尿病患者[6]. 如此庞大的统计学数据表明, 咪唑丙酸的准确定量对于医学诊断具有重要意义.
迄今, 关于咪唑丙酸含量的测定尤其是复杂生物样品中咪唑丙酸的准确定量分析方法鲜见报道. Koh等[3]为了证明人血清中的咪唑丙酸水平与葡萄糖耐受量相关, 通过乙腈提取咪唑丙酸后, 再采用正丁醇进行衍生, 然后采用HPLC-MS检测, 将其应用于649个不同葡萄糖耐受量的个体. Glinton等[7]对1对UROC1基因突变但是发育良好的姐弟进行了非目标性代谢组学分析, 以80%甲醇溶液从血清中提取小分子化合物, 发现血清和尿液中的尿刊酸、 咪唑丙酸的特征性代谢紊乱, 说明尿刊酸酶缺乏症与智力发育迟缓之间并无直接关系. 但是, 由于血清中成分复杂[8], 基质干扰严重, 且潜在糖尿病患者的咪唑丙酸含量较低, 仅通过简单的沉淀蛋白难以提高咪唑丙酸检测的灵敏度和准确度, 因此需要一定的样品前处理. 上述报道均着重于分析咪唑丙酸及其相关代谢物的生物学意义, 并未提及相关的方法学精密度与准确度, 亟需补充.
由于Ni(Ⅱ)材料与咪唑环中的氮原子可产生特殊的配位作用, 故已有多种Ni(Ⅱ)材料被用于组氨酸标记的蛋白质的分离与纯化[9~11]. 前文[12~14]通过液相沉积法在SiO2基质上沉积NiO纳米颗粒, 并将其用于多种苯并咪唑类农兽药的选择性富集与纯化. 基于此, 本文将NiO@SiO2用于血清中咪唑丙酸的萃取, 结合液相色谱-质谱联用(HPLC-MS)技术对咪唑丙酸进行了定量分析.
1 实验部分
1.1 试剂与仪器
四水合氟化镍(NiF2·4H2O)、 硼酸(H3BO3)、 氨水溶液(NH3·H2O, 质量分数为25%)、 磷酸(H3PO4)、 磷酸二氢钠(NaH2PO4)、 磷酸氢二钠(Na2HPO4)、 磷酸钠(Na3PO4)、 甲酸(FA)和甲酸铵(HCOONH4)均为分析纯, 购于国药集团化学试剂有限公司; 色谱纯乙腈购于德国默克公司; 去离子水由实验室购买的Milli-Q超纯水仪制备. 制备NiO@SiO2所用硅胶粒径为37~54 μm(300~400目), 购于上海阿拉丁圣湖科技股份有限公司; 咪唑丙酸购于药明康德新药开发有限公司, 用去离子水配制成1 mg/mL储备液, 避光储存于-20 ℃冰箱中; 4-硝基咪唑(内标)购于上海阿拉丁生化科技股份有限公司, 用去离子水配制成1 mg/mL储备液, 避光储存于-20 ℃冰箱中; 2型糖尿病人和正常人血清样本由武汉中南医院提供, 避光保存于-80 ℃冰箱中.
Shimadzu LCMS-8040型高效液相色谱-质谱(日本Shimadzu公司)由20AD泵、 SIL-20A自动进样器、 CTO-20A柱温箱、 DGU-20A5R脱气机和配有ESI电离源的三重四级杆质谱仪组成; 数据的采集和处理均通过LabSolution 5.80软件完成.
1.2 样品的前处理
1.2.1 NiO@SiO2的制备 参照文献[12]采用液相沉积法制备NiO@SiO2. 先将1.05 g NiF2·4H2O溶于30 mL去离子水中, 搅拌3 h以上过滤得到NiF2饱和溶液. 将1.89 g H3BO3溶于50 mL去离子水中得到0.6 mol/L硼酸溶液. 将15 mL NiF2饱和溶液与25 mL 0.6 mol/L硼酸溶液均匀混合于50 mL离心管中, 得到沉积前驱液. 将1 g 活化后的层析硅胶加入该前驱液中, 于40 ℃连续振荡72 h, 所得材料经去离子水清洗, 然后于75 ℃烘干, 置于马弗炉中煅烧1 h. 马弗炉升温条件: 以1 ℃/min速率升温至200 ℃, 加热1 h. 将200 mg制备的NiO@SiO2材料装入 3 mL 聚丙烯注射器中作为固相萃取柱, 备用.
1.2.2 样品的固相萃取(SPE) 取50 μL血清, 加入950 μL 20 mmol/L磷酸盐缓冲溶液稀释后混合均匀, 作为上样液备用. 将NiO@SiO2SPE柱先用2 mL 20 mmol/L磷酸盐缓冲溶液(pH=7.0)活化后, 取1 mL上样溶液上样; 然后以1 mL去离子水清洗SPE柱, 待清洗液全部通过萃取柱后, 用真空泵抽干萃取柱; 最后加入1 mL 1%氨水溶液解吸, 待解吸液全部通过萃取柱后用真空泵抽干萃取柱, 将解吸液收集到1.5 mL离心管中. 将解吸液冷冻旋转蒸干, 以1 mL ACN/H2O(体积比95∶5)混合溶液复溶, 经涡旋离心后取上层清液10 μL, 进样高效液相色谱-质谱(HPLC-MS)进行分析.
1.3 色谱及质谱分析条件
1.3.1 色谱条件 Alltima HP HILIC色谱柱(150 mm×2.1 mm i.d., 3 μm). 流动相A为0.5%甲酸-甲酸铵缓冲溶液(pH=2.33), 流动相B为乙腈, 梯度洗脱程序: 0~3 min: 95% B; 3~5 min: 95%~60% B; 5~14.5 min: 60% B; 14.5~15 min: 60%~95% B; 15~40 min: 95% B. 流速为0.4 mL/min, 柱温40 ℃, 进样量为10 μL.
1.3.2 质谱条件 采用正离子扫描, 质谱多反应监测(MRM)模式检测咪唑丙酸, 设置母离子为141.0, 子离子为81.0的MRM定量通道. 脱溶剂(DL)管温度为250 ℃, 加热模块温度为400 ℃, 雾化气流速3 mL/min, 干燥气流速15 mL/min.
2 结果与讨论
2.1 萃取条件的优化
SPE条件会影响其萃取回收率和结果的可靠性, 萃取条件主要包括吸附剂用量、 上样液pH值、 解吸液组成及其用量, 实验对这些萃取条件进行了优化. 采用100 ng/mL咪唑丙酸标准溶液优化SPE条件. 回收率的计算方法: 用咪唑丙酸经NiO@SiO2萃取解吸后进行LC-MS检测的量除以相同浓度的咪唑丙酸标准溶液进行LC-MS检测后的量. 所有实验均重复3次.
2.1.1 上样液pH的优化 分别用磷酸盐缓冲溶液调节上样液pH值至3, 5, 7, 9, 11, 再进行NiO@SiO2SPE实验. 如图1(A)所示, 当上样液pH=3和pH=9时咪唑丙酸的峰面积相对较高. 由于咪唑丙酸的分子结构中含有咪唑环, 环上的N原子有的具有碱性, 有的具有酸性, 随着溶液pH值的改变, 分子存在形式也会变化, 从而与NiO@SiO2的作用不同. 考虑到酸性条件下SiO2基质更稳定, 后续实验采用pH=3的上样溶液.
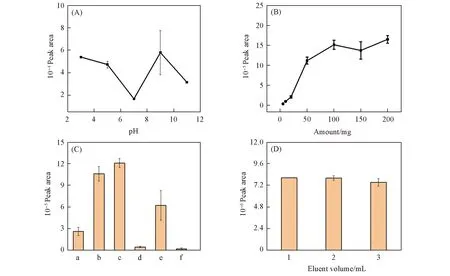
Fig.1 Optimization of the extraction conditions(A) pH of sample matrix(3, 5, 7, 9 and 11); (B) NiO@SiO2 sorbent amount(10, 20, 50, 100, 150 and 200 mg); (C) six kinds of eluent solution: a. ammonium hydroxide/acetonitrile(1∶99, volume ratio); b. ammonium hydroxide/H2O(1∶99, volume ratio); c. ammonium hydroxide/H2O(5∶95, volume ratio); d. formic acid/H2O(1∶1000, volume ratio); e. formic acid/acetonitrile(1∶1000, volume ratio); f. H2O. (D) Eluent solution: ammonium hydroxide/H2O(1∶99, volume ratio).
2.1.2 吸附剂用量的优化 考察了吸附剂用量分别为5, 10, 20, 50, 100, 150和200 mg条件下咪唑丙酸的回收率. 如图1(B)所示, 在5~100 mg范围内, 解吸液中咪唑丙酸的含量随吸附剂用量的增大而增加, 吸附剂用量大于100 mg, 该值基本达到稳定值. 而实际血清样品中成分复杂, 含有蛋白质、 多肽、 脂肪、 氨基酸、 激素和核苷衍生物等, 基质干扰较严重, 因此, 在血清基质中对吸附剂用量(100, 150, 200, 250和300 mg)进行继续优化, 当吸附剂用量为200 mg时, 血清基质的解吸液中咪唑丙酸的含量最高. 因此, 选择200 mg为吸附剂用量进行后续实验.
2.1.3 解吸液的优化 解吸液组成直接影响解吸效果. 分别考察了含1%(质量分数)NH3·H2O的乙腈溶液、 含1% NH3·H2O的水溶液、 含5% NH3·H2O的水溶液、 含0.1% FA的水溶液、 含0.1% FA的ACN溶液及纯水等6种解吸液对NiO@SiO2SPE柱萃取咪唑丙酸后的解吸效果. 结果如图1(C)所示. 含有NH3的解吸液中NH3能与Ni2+配位与咪唑环形成竞争, 将咪唑丙酸洗脱下来. 可见, 含NH3·H2O的水溶液萃取效果较好, 其中含1%和5% NH3·H2O的水溶液解吸效果相差无几, 因此, 在后续的实验中采用含1% NH3·H2O的水溶液作为解吸液. 然后分别以1.0, 2.0和3.0 mL含1% NH3·H2O的水溶液作为解吸液对SPE柱进行解吸, 考察了不同解吸液用量的洗脱效果. 结果如图1(D)所示, 1 mL解吸液用量时能够解吸完全, 因此选择1.0 mL 1% NH3·H2O的水溶液进行解吸.
由于咪唑丙酸为亲水性物质, 硅胶也会对其产生吸附作用. 为了说明NiO@SiO2与咪唑丙酸的作用机制, 在上述优化后的萃取条件下通过比较NiO@SiO2与SiO2对咪唑丙酸的萃取效果发现, 在SiO2材料上咪唑丙酸的回收率仅为0.3%, 而在NiO@SiO2材料上其回收率可达72.2%, 说明NiO@SiO2与咪唑丙酸之间的吸附主要是基于NiO与目标分析物之间的相互作用.
图2(A)为血清样品和添加2.5 ng/mL咪唑丙酸的血清样品经NiO@SiO2固相萃取后的色谱图. 可见, 咪唑丙酸的保留时间为6.89 min, 血清样品在咪唑丙酸保留时间处无干扰. 图2(B)为图2(A)中咪唑丙酸出峰处的质谱图, 图中m/z123.00和81.00处可归属为咪唑丙酸的2个特征子离子.
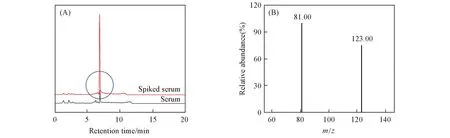
Fig.2 Chromatogram of serum and spiked serum with 2.5 ng/mL imidazole propionic acid after NiO@SiO2 SPE(A) and the mass spectrum of the chromatographic peak at 6.89 min(B)
2.2 方法学考察
最优SPE条件下, NiO@SiO2对血清中咪唑丙酸的萃取回收率(Recovery, %)计算公式如下:
式中:A0为血清基质中咪唑丙酸经NiO@SiO2SPE萃取后测得的峰面积;Ai为加入10 ng/mL咪唑丙酸后的血清样品经萃取后测得的峰面积;As为血清基质经萃取后再添加10 ng/mL咪唑丙酸测得的峰面积. 血清中的咪唑丙酸在经过NiO@SiO2SPE萃取后回收率为77.7%, 3次实验值的RSD为5.8%, 表明NiO@SiO2能充分萃取血清中的咪唑丙酸. 为了消除仪器检测时的基质效应, 在随后的方法学实验中将硝基咪唑(160 ng/mL)作为内标对其进行定量分析.
向血清样本中加入不同浓度的咪唑丙酸标准溶液, 使上样液浓度范围为0.05~10 ng/mL, 每个浓度重复实验3次. 以分析物和内标的峰面积比值为纵坐标, 质量浓度(ng/mL)为横坐标, 得到的标准工作曲线的线性回归方程为y=0.1464x-0.0016(相关系数R2=0.996), 表明在0.05~10 ng/mL范围内, 线性关系良好. 以3倍信噪比计算得出方法的检出限为0.02 ng/mL, 10倍信噪比计算得到方法的定量限为0.05 ng/mL. 日内、 日间精密度通过测定添加高、 中、 低(10, 1.0和0.25 ng/mL)3个浓度咪唑丙酸时的加标回收率进行评价. 日内精密度测定在1天内重复5次实验, 日间精密度测定在连续3天内每天各重复3次实验. 如表1所示, 加标回收率为84.0%~119%, 日内日间精密度在0.25%~17.2%之间, 表明这种方法具有较好的准确度和精密度, 适用于血清样品中咪唑丙酸的分析.

Table 1 Precisions and recoveries for the determination of imidazole propionic acid in serum
2.3 实际样品分析
将建立的方法用于实际血清样品中咪唑丙酸的分析, 表2分别列出了20位2型糖尿病人及20位正常人血清中咪唑丙酸含量的测定结果. 通过单因素方差分析可知, 2型糖尿病人与正常人血清中咪唑丙酸的含量存在显著性差异(P<0.01), 与文献[3]报道一致. 此结果进一步扩大了NiO@SiO2SPE的应用范围, 同时表明咪唑丙酸作为小分子代谢物在医疗诊断中的巨大潜力.
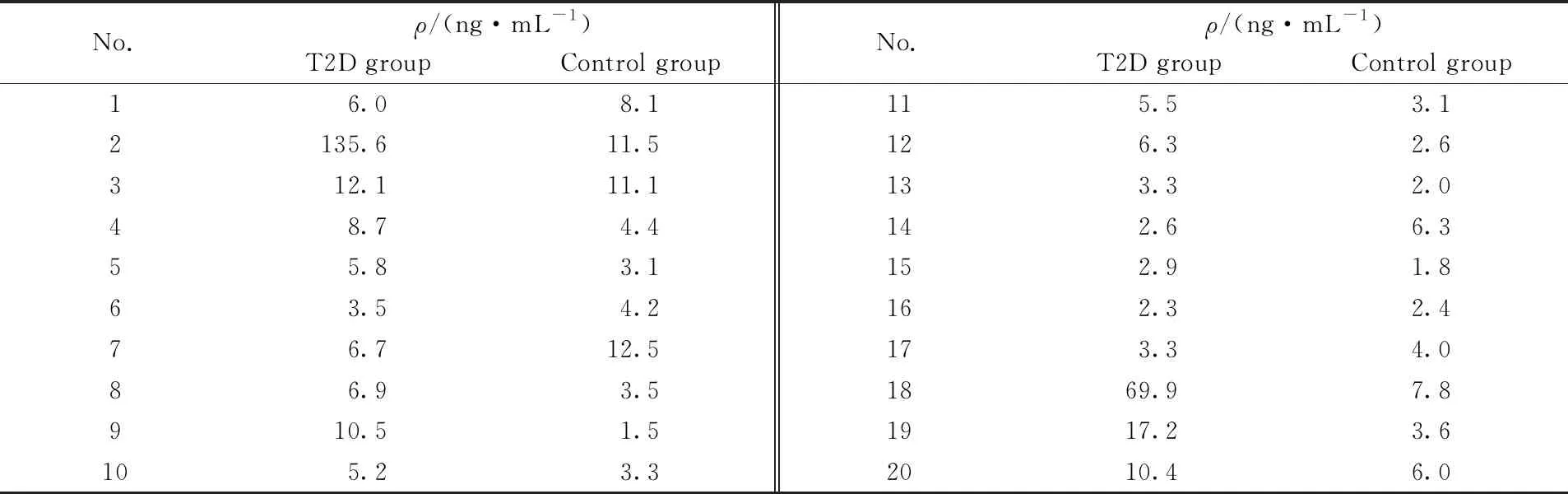
Table 2 Imidazole propionic acid amounts in Type 2 diabetes(T2D) patients and control
3 结 论
以NiO@SiO2作为固相萃取材料, 将NiO@SiO2SPE与高效液相色谱-质谱检测结合, 建立了一种人血清中咪唑丙酸的分析方法. 该方法简单、 准确度和精密度均较好, 将其应用于2型糖尿病人与正常人血清中咪唑丙酸含量的检测, 发现具有显著性的差异. 本文结果不仅拓宽了液相沉积材料NiO@SiO2的使用范围, 同时也表明咪唑丙酸在未来2型糖尿病以及其它并发症的医学诊断中具有较大的潜力. 在未来的疾病诊断中, 该方法有望用于疾病诊断的辅助指导.