脊髓IL-33在关节炎大鼠痛觉过敏中的表达*
2020-02-11赵媛孔高茵周搏唐轶珣裴万敏潘冰冰
赵媛,孔高茵,周搏,唐轶珣,裴万敏,潘冰冰
[湖南省人民医院(湖南师范大学第一附属医院) 麻醉医学中心(湖南省围术期加速康复麻醉临床医学研究中心),湖南 长沙 410005]
类风湿关节炎是一种自身免疫性疾病,常以进行性的关节肿胀、对称性、晨僵及疼痛为临床表现,对患者生活质量造成很大的影响。类风湿关节炎患者的病理学改变主要为关节腔内有大量炎症细胞浸润,呈慢性炎症增生性改变。细胞因子是炎症的主要介质,并且导致自身免疫疾病。白细胞介素-33(Interleukin-33, IL-33)属于IL-1 细胞因子家族的成员,参与各种炎症性疾病的发病机制[1],包括过敏性疾病[2]、自身免疫性疾病[3]、感染性疾病[4]及神经性疼痛[5]。有文献报道,IL-33/ST2 在以疼痛为重要临床表现疾病中的适应性和先天性免疫应答中有很重要的作用[6]。脑和脊髓是人体IL-33 表达最多的部位[7],但类风湿关节炎患者中枢神经系统IL-33 的表达尚无相关研究。本研究通过检测佐剂诱导关节炎(adjuvant induced arthritis, AIA)大鼠脊髓中IL-33 的表达,探讨其在类风湿关节炎中的作用。
1 材料与方法
1.1 实验动物与材料
清洁级雄性SD 大鼠,体重200 ~250 g,由湖南斯莱克景达实验动物有限公司提供。7370 型热痛仪(意大利UGO 公司),VonFrey 机械痛阈测定套件(美国Stoelting 公司),鼠抗β-tublin 多克隆抗体(北京鼎国昌盛公司),兔抗IL-33 多克隆抗体(NBP1-76394)(美国Novus 公司),辣根过氧化物酶标记的羊抗小鼠IgG 和羊抗兔IgG(美国Jackson 公司),完全氟式佐剂(complete Freund's adjuvant, CFA)(F-5881)( 美 国Sigma 公司)。
1.2 模型复制与分组
大鼠以每笼2 或3 只群养,适应生活环境3 d 后开始实验,50 只大鼠随机分为对照组(Sham 组)和佐剂性关节炎组(CFA 组),每组25 只。Sham 组大鼠左侧足底注射生理盐水100 μl,CFA 组大鼠左侧足底注射CFA(1 mg/ml)100 μl。
1.3 观察指标
1.3.1 关节形态学评估 关节和足趾体积测量使用足趾容积测量仪,测量并计算大鼠左侧足趾和关节的体积,评价大鼠足趾和关节肿胀程度。
1.3.2 行为学检测 行为学检测包括机械痛阈(paw withdrawal threshold, PWT)和热痛阈(paw with-drawal latency, PWL)检测,分别于术前1 天和术后第1、3、7、14 和21 天检测两组大鼠左侧后肢的PWT 和PWL。每间隔5 ~10 min,重复检测2 次,取平均值。
1.3.3 脊髓Western blotting 检测 两组分别在术后第1、3、7、14 和21 天处死5 只大鼠,沿棘突切开皮肤并去除棘突和椎板,取出脊髓腰膨大,提取各组细胞总蛋白,BCA 法检测蛋白浓度,每孔蛋白上样量50 μg,行SDS- PAGE 电泳,湿法转膜将蛋白转移至PVDF 膜上,5%脱脂奶粉封闭2 h,加入IL-33(1 ∶1 000),β-Tublin(1 ∶5 000)一抗,4℃孵育过夜。PBS 洗膜,按一抗种属来源加入相应二抗。加入二抗后常温反应2 h,加入发光液,运行Image Lab 程序发光,保存条带。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较做析因设计的方差分析,进一步两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠足趾和关节体积的变化
Sham 组与CFA 组大鼠足趾和关节体积的比较采用析因设计的方差分析,结果:①不同时间点大鼠足趾和关节体积有差异(F=478.846,P=0.000);②两组大鼠足趾和关节体积有差异(F=612.542,P=0.000);③两组大鼠足趾和关节体积随时间的变化趋势有差异(F=299.000,P=0.000)。CFA 组大鼠在术后第3 天开始,足趾和关节体积增大,延至整个观察期(P<0.05)。见表1 和图1。
2.2 各组大鼠PWT 和PWL
Sham 组与CFA 组大鼠PWT 和PWL 变化的比较采用析因设计的方差分析,结果:①不同时间点大鼠PWT 和PWL 变化有差异(F=151.033 和57.641,均P=0.000);②两组大鼠PWT 和PWL 变化有差异(F=431.746 和515.000,均P=0.000);③两组大鼠PWT和热PWL 随时间的变化趋势有差异(F=161.370 和88.342,均P=0.000)。CFA 组大鼠在术后第6 h 开始,与术前比较,PWT 和PWL 均降低,延至整个观察期(P<0.05)。见表2、3 和图2、3。
表1 两组大鼠不同时间点足趾和关节体积比较 (±s)
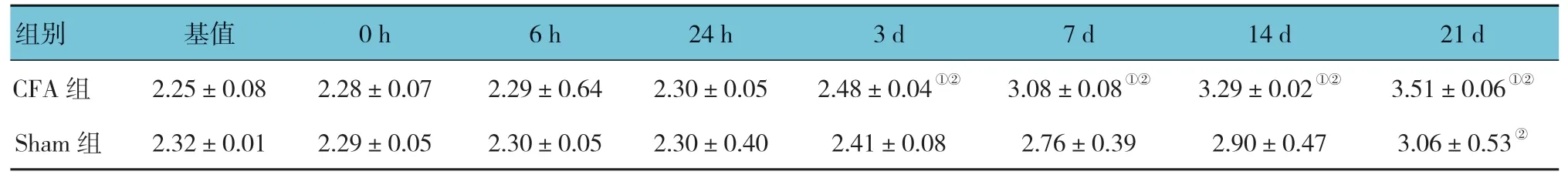
表1 两组大鼠不同时间点足趾和关节体积比较 (±s)
注:基值为未用药前的数值;①与Sham 组比较,P <0.05;②与基值比较,P <0.05。
组别 基值 0 h 6 h 24 h 3 d 7 d 14 d 21 d CFA 组 2.25±0.08 2.28±0.07 2.29±0.64 2.30±0.05 2.48±0.04①② 3.08±0.08①② 3.29±0.02①② 3.51±0.06①②Sham 组 2.32±0.01 2.29±0.05 2.30±0.05 2.30±0.40 2.41±0.08 2.76±0.39 2.90±0.47 3.06±0.53②
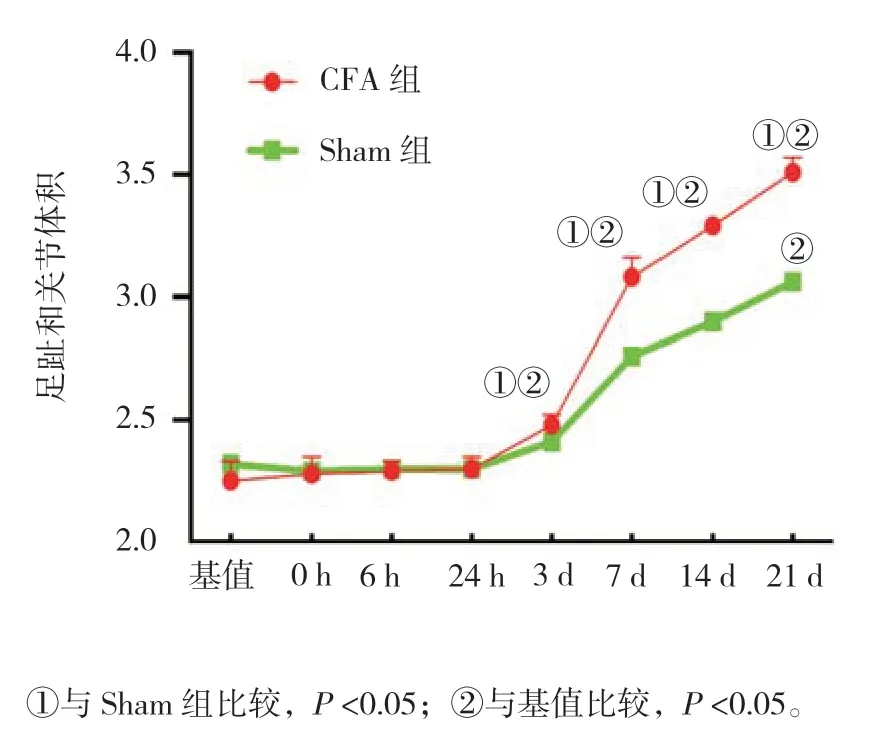
图1 两组大鼠不同时间点足趾和关节体积变化(±s)
2.3 两组大鼠脊髓IL-33 蛋白水平表达变化
两组大鼠脊髓IL-33 蛋白表达的比较采用析因设计的方差分析,结果:①Sham 组各时间点大鼠脊髓IL-33 蛋白表达水平比较,差异无统计学意义(F=1356.316,P=23.317);②CFA 组大鼠脊髓IL-33 蛋白表达水平从第3 天开始升高,差异有统计学意义(F=33 423.543,P=0.000);③CFA 组与Sham 组随时间的变化趋势比较,差异有统计学意义(F=31856.357,P=0.000)。见表4 和图4。
表2 两组术后不同时间点PWT 比较 (g,±s)

表2 两组术后不同时间点PWT 比较 (g,±s)
注:基值为未用药前的数值;①与Sham 组比较,P <0.05;②与基值比较,P <0.05。
组别 基值 0 h 6 h 24 h 3 d 7 d 14 d 21 d CFA 组 17.46±2.32 17.47±2.31 3.86±0.30①② 1.69±0.60①② 4.73±0.83①② 1.4±0.34①② 0.61±0.23①② 0.85±0.20①②Sham 组 17.20±2.01 17.20±2.01 16.47±2.01 17.20±2.01 16.47±2.01 15.73±1.64 16.47±2.01 18.53±2.61
表3 两组术后不同时间点PWL 比较 (s,±s)
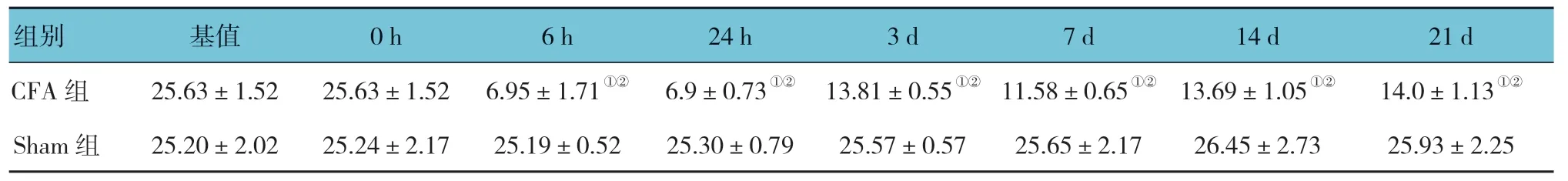
表3 两组术后不同时间点PWL 比较 (s,±s)
注:基值为未用药前的数值;①与Sham 组比较,P <0.05;②与基值比较,P <0.05。
组别 基值 0 h 6 h 24 h 3 d 7 d 14 d 21 d CFA 组 25.63±1.52 25.63±1.52 6.95±1.71①② 6.9±0.73①② 13.81±0.55①② 11.58±0.65①② 13.69±1.05①② 14.0±1.13①②Sham 组 25.20±2.02 25.24±2.17 25.19±0.52 25.30±0.79 25.57±0.57 25.65±2.17 26.45±2.73 25.93±2.25

图2 两组大鼠不同时间点PWT 的变化 (±s)
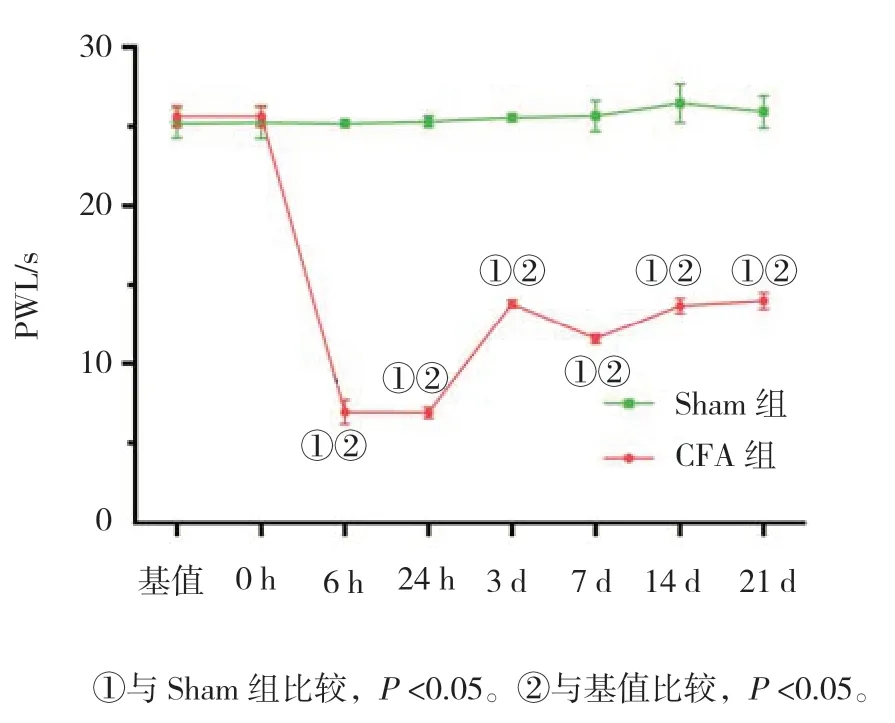
图3 两组大鼠不同时间点PWL 的变化 (±s)
表4 两组大鼠脊髓IL-33 蛋白水平表达比较 (±s)

表4 两组大鼠脊髓IL-33 蛋白水平表达比较 (±s)
注:①与Sham 组比较,P <0.05;②与24 h 比较,P <0.05。
组别 24 h 3 d 7 d 14 d 21 d CFA 组 7 678.62±161.90 12 889.60±135.55①② 18 861.37±167.64①② 20 114.61±78.47①② 19 434.54±514.97①②Sham 组 7 073.99±141.04 7 023.81±91.95 7 145.91±143.82 7 014.39±97.03 7 018.73±90.58

图4 两组大鼠不同时间点脊髓IL-33 的表达
3 讨论
10年前IL-33 被确认为IL-1 家族中的一员,认为在先天和适应性方面起着关键免疫作用,IL-33 与其独特的受体ST2 在炎症和免疫介导的疾病中起重要作用[8]。IL-33 主要表达于内皮细胞和上皮细胞的细胞核,在炎症刺激下,警示组织损伤或应激[9]。有研究表明,在CIA 模型中,IL-33 可以加重关节炎的症状[4],在RA 大鼠的滑膜中可以检测到IL-33 和ST2,其中IL-33 水平较高[10]。提示类风湿关节炎与外周IL-33 升高关系密切。
在所有器官研究中,中枢神经系统的IL-33 表达水平最高,IL-33 和ST2 由多种细胞表达,IL-33 通过大胶质细胞、星形胶质细胞和少突胶质细胞[11]表达,ST2 通过小胶质细胞[12]表达。有研究显示[13],在CFA小鼠中,脊髓星形胶质细胞在关节炎发作后第10 天开始增加。IL-33 像IL-1 其他细胞因子一样,会导致周围神经系统炎症疼痛和调解抗原诱导的皮肤和关节的痛觉过敏,VERRI 等[14]研究表明,IL-33 可能诱发小鼠关节和皮肤痛觉过敏的产生,提示IL-33 在关节炎疼痛中起关键作用。但CFA 大鼠脊髓是否会出现IL-33 相应的表达变化尚无相关研究。
本实验研究发现,大鼠足底注射CFA 后6h 开始出现PWT 和PWL 明显下降,到第3 天两者都有轻度恢复继之下降的过程,总体呈下降的趋势,提示实验组大鼠注射CFA 后6 h 即出现痛觉过敏。观察到大鼠足趾和关节变化也提示关节炎的形成。与此同时检测相应时间点的脊髓IL-33 蛋白,发现第3 天脊髓IL-33蛋白水平开始明显升高,此后一直持续到第21 天。该结果提示,当CFA 大鼠形成早期的痛觉过敏时,脊髓IL-33 并未参与,3 d 后脊髓IL-33 明显升高,说明CFA 大鼠后期的痛觉过敏形成与脊髓IL-33 相关。
综上所述,根据IL-33 在AIA 大鼠脊髓的表达,笔者认为IL-33 在类风湿关节炎疼痛过敏中扮演重要角色,如果通过调控脊髓IL-33 水平进而调节其炎症反应和中枢敏化,有可能减轻类风湿关节炎患者的疼痛,但是这需要更进一步和大样本的研究。
