自驱动植入式能源收集器件的研究进展
2020-02-10刘儒平
李 舟 李 喆 刘儒平
1(中国科学院北京纳米能源与系统研究所 北京 100083)
2(中国科学院大学纳米科学与技术学院 北京 100083)
3(北京印刷学院印刷包装工程学院 北京 102600)
1 引 言
目前,包括心脏起搏器、除颤器、深部脑刺激器和人工耳蜗在内的大多数植入式医疗电子器件(Implanted Medical Electronics,IMEs)均由电池供电。然而,电池容量限制了 IMEs 的使用寿命。例如,心脏起搏器的寿命约为 7~10 年,而深度脑刺激器的寿命仅为 3~5 年[1-2]。定期更换这些电源不仅会引起环境污染,而且还会增加患者的经济负担和精神负担。另外,电池也占据植入式电子器件大部分的重量和体积。因此,近年来,研究人员将主要工作聚焦在提高电池寿命、降低 IMEs 中能量收集部分的重量和体积[3-4]。
能源收集(Energy Harvesters)器件是一种可以收集生物机械能、热能或化学能的电子器件。它能够将收集到的能量转化为电能。现有的能源收集器件主要有压电式纳米发电机(Pizoelectric Nanogenerator,PENG)、摩擦纳米发电机(Triboelectric Nanogenerator,TENG)、光伏电池(Photovoltaic Cells,PVC)、自驱动腕表(Automatic Wristwatch,AW)、热释电发电机(Pyroelectric Nanogenerator,PYENG)、生物燃料电池(Biofuel Cell,BFC)和耳蜗内电位(Endocochlear Potential,EP)收集器等。人体运动的机械能和体内的化学能,如心跳、呼吸、血液循环和葡萄糖的氧化还原等,都具有转化为电能的潜力。因此,可以制作植入式能源收集器件(Implantable Energy Harvesters,IEHs)收集人体能量。
众所周知,人体可产生大量机械能。例如,心脏输出功率约为 1.4 W[5]。如果可以将心脏收缩和舒张产生的机械能收集起来,并用于驱动心脏起搏器,那么上述电池续航不足的问题将可得到解决。除了心脏跳动产生的能量以外,肺的运动以及升主动脉的收缩/舒张变形也可作为生物的体内能量来源。近年来,压电式纳米发电机和摩擦纳米发电机已被广泛应用于收集大鼠、牛、猪等动物的心跳和呼吸运动产生的机械能[6-11]。除此之外,光伏电池[12-14]、自驱动腕表[15-17]及热释电发电机[18-19]等器件也被用作 IEHs。由于生物燃料电池(BFC)可以将体内化学能转化为电能,因此 BFC 也可以作为一类 IEHs。然而,BFC 较低的输出电压限制了其实际应用。研究显示,因为受到氧气和生物燃料的氧化还原电位限制,大多数 BFC 的输出电压只有 0.5 V,而 IEHs 的持续稳定工作大多需要 2~3 V 的电压驱动,所以BFC 不能被广泛用于为 IMEs 供电[20]。目前,已经可以通过一些方法提高 BFC 的输出电压,如将几个电池串联[21-22],或将电能存储在电容器等介质中以释放高压短脉冲[23-24]。耳蜗内电位是在耳蜗内淋巴间隙产生的另一种体内生物化学能,已经被证明可以作为植入式电子器件的能量来源[25-27]。
除了用于收集能量外,IEHs 还可以用于生物医疗传感。例如,植入式摩擦电传感器固定在猪心包上,可以用于监测心率和呼吸频率,也可以用来检测心律失常[28]。柔性压电式能源收集器件贴在猪心脏左心室心尖和右心室之间,可用于监测猪的心脏活动。此外,基于压电和摩擦纳米发电机的能源收集器件可用于为细胞、组织或器官提供电刺激,因此,IEHs 在促进干细胞神经分化、促进神经元组织再生和刺激心脏跳动等领域也具有潜在的应用价值[29-34]。
为了实现生物体能量的有效收集并解决IMEs 的能源供给问题,本文对近年来的 IEHs 进行分类和总结。具体地,主要讨论了 IEHs 的种类、代表性应用及现存的挑战,并对其未来的应用进行了展望。
2 分 类

图1 植入式能源收集器件[10,16,25]Fig.1 Implantable energy harvesting devices[10,16,25]
植入生物体内的能源收集器件可以分为 7类:压电纳米发电机、摩擦纳米发电机、光伏电池、热释电发电机、自驱动腕表、生物燃料电池和耳蜗内电位收集器(见图 1)。其中,压电纳米发电机、摩擦纳米发电机和自驱动腕表,都可将机械能转化为电能。利用生物体内葡萄糖的生物燃料电池和利用耳蜗内电位的蜗内电位收集器,均可用来给电子医疗器件供电。光伏电池虽然不能直接在体内获取生物能源,但可以从周围环境中收集光能来为植入式器件供电。热释电发电机通过将低梯度恒温的热能转化为电能,可以驱动医疗电子器件。
2.1 压电式纳米发电机 (PENG)
压电材料是受到压力作用时会在两端面间出现电位差的晶体材料,它能够实现机械能和电能的相互转换。以氧化锌(ZnO)为例。氧化锌具有非中心对称性的纤锌矿结构,当施加外力时,材料表面会产生正负电荷面,称之为极性面。这些极性面产生的压电势可用于驱动外部电路中电子的移动,实现机械能向电能的转化。利用压电材料的能量转化特性,王中林教授于 2006 年首次研发出 PENG[35]。迄今为止,用于 IEHs 的压电材料主要包括氧化锌、锆钛酸铅、聚偏氟乙烯(PVDF)、聚偏氟乙烯-三氟乙烯(Polyvinylidene Fluoride-Trifluoroethylene,PVDF-TrFE)和钛酸钡。
将无机压电材料的压电效应和肖特基[35]触点在界面处的门控效应结合,PENG 可作为“充电泵”驱动电子运动,进而在外电路中产生交流电。2010 年,Li 等[6]提出一种基于氧化锌的PENG,并将其植入活鼠体内获取呼吸和心跳产生的能量(图 2(a)),这是将生物机械能转化为电能的首次成功尝试。其中,植入膈腹侧时的开路电压和短路电流分别为 1 mV 和 1 pA,紧贴心脏表面时分别为 3 mV 和 30 pA。为了提高无机压电器件的输出性能,Kim 等[36]于 2017 年制备了一种基于 PMN-PZT(Lead Zirconatetitanate)的高性能植入式压电能源收集器件。该器件可获得猪心跳产生的 17.8 V 的开路电压和 1.74 µA 的短路电流。此外,该 IEHs 也被用于制备自供能无线通信系统(图 2(b))。为了增加压电器件的应用场景,Dong 等[37]于 2019 年设计了一种利用心脏能量为起搏器供能的自驱动电子器件(图 2(c))。该柔性器件紧密包裹在起搏导线上,可以实现能量的有效采集和利用,进而为生物体能量的有效收集提供了又一新思路。
有机压电材料(如 PVDF、PVDF-TrFE 等)制备的 PENG 也被广泛用于收集生物机械能,如血管搏动产生的能量。2015 年,Zhang 等[7]提出一种基于 PVDF 薄膜的柔性植入式 PENG(图 2(d))。他们将该器件包裹在猪的升主动脉周围,获取到血管搏动的机械能。在血压为160/105 mmHg 和心率为 120 bpm 时,开路电压和短路电流分别为 1.5 V 和 300 nA。实验结果表明,包裹升主动脉的紧密性明显影响输出,而优化包裹张力是 PENG 获得高输出的关键。为了真正实现自供能器件的可植入性,Cheng 等[38]展示了一种由压电薄膜制备的自供能 IEHs,并将该薄膜植入约克夏猪升主动脉周围用于收集血管搏动能量(图 2(e))。研究人员也将该器件用于测量血压,体内最大瞬时功率为 40 nW。

图2 基于压电式纳米发电机的自驱动植入式能源收集器件Fig.2 Self-powered IEHs based on pizoelectric nanogenerator
此外,PENG 也可以用于收集腿部运动产生的能量。2017 年,Wang 等[39]利用静电纺丝技术制备了 PVDF-TrFE 纳米纤维支架,并用来获取腿部运动的机械能(图 2(f))。该系统皮下植入在大鼠腿部,可获得 6 mV 的开路电压和 6 nA的短路电流。此外,该系统还可应用于组织工程和骨再生等方面。
2.2 摩擦纳米发电机(TENG)
TENG 由 Fan 等[9]于 2012 年首次提出,目前该领域已取得许多重要进展。TENG 工作原理是基于摩擦起电和静电感应协同作用:当两种不同的材料接触时,在接触面产生相反电荷;此后界面分离,产生电位差。附着在表面上的两个电极通过负载连接,自由电子从一个电极流向另一个电极,从而产生一个相反的电位来平衡感应静电场。由于两个摩擦层不断地接触和分离,在外电路中产生交变电流,因此实现了将外部机械能转化为电能。
2014 年,Zheng 等[11]首次证明了植入式纳米发电机(Implanted Triboelectric Nanogenerator,iTENG)的可行性(图 3(a))。该器件由聚酰亚胺、聚对苯二甲酸乙二醇酯、铝薄膜和聚二甲基硅氧烷制备而成。将 iTENG 置于左胸皮下或活鼠的膈肌与肝脏之间,可以获得周期性呼吸产生的机械能。呼吸产生的开路电压和短路电流分别为 3.73 V 和 0.14 µA,转换后的电能可被储存在电容器中以驱动原型起搏器。此后,他们又提出了一种生物可降解摩擦纳米发电机(Biodegradable Implanted Triboelectric Nanogenerator,BD-iTENG)用于收集体内生物机械能(图 3(b))[34]。当将 BD-iTENG 皮下植入到大鼠背部时,该器件能以 3 V 的输出电压工作24 h 以上,并在 72 h 内基本完全溶解。

图3 基于摩擦纳米发电机的自驱动植入式能源收集器件Fig.3 Self-powered IEHs based on triboelectric nanogenerator
2019 年,基于人体运动过程中摩擦带电现象,Shi 等[40]设计了一种整合自供能系统(图 3(c)):通过机体运动,植入体内的电极可收集机械能并将其转换成电能。结果表明,机体整合自供能系统不仅是一个能源收集装置,还可进行步态分析、人体活动识别和运动传感。同年,Tian 等[41]提出了一种自供能的柔性植入式电刺激器件,它由一个 TENG 和一个柔性交叉电极组成(图 3(d))。结果表明,该柔性植入式电刺激器件可显著促进成骨细胞的附着、增殖和分化,这对电诱导骨重塑具有重要意义。
2.3 光伏电池(PVC)
太阳能是环境中丰富而清洁的能源,随着科学的进步,人们对太阳能电池的研究也日渐成熟。部分研究人员将 IMEs 植入到大鼠、兔子和猪体内,并利用太阳能电池为其供电。
2004 年,Laube 等[12]制备了用于传输光能并为眼内微系统供电的光伏电池,证实了在兔子长效性视网膜修复时,可将光伏电池作为人工晶状体一部分,如图 4(a)所示。人工晶状体由光伏电池和发光二极管(Light-Emitting Diode,LED)组成。当用 850 nm 的红外光作为光源时,两个光伏电池串联可产生 2 V 的开路电压,光电转换效率可达到 40%。LED 可作为信号显示能量传输是否成功。研究人员在兔子体内进行了植入试验,证明微系统可持续工作 14 天到 7 个月以上。2016 年,Song 等[14]描述了基于光伏技术的超薄 IEHs,并将其与可充电电池和定制起搏器一起整合在柔性衬底上,如图 4(b)所示。整个系统被植入到活体无毛小鼠体内,利用该系统,透过小鼠皮肤的光能可被转换为电能并存储在电池中,由电池再为起搏器供电。此后,他们又展示了一种柔性可植入光伏器件(图 4(c))。研究人员将器件植入皮下,并对电学性能进行了研究。结果表明,根据皮肤的厚度和色调,皮下的器件可产生 0.51~9.05 mW·cm-2功率密度的能量。这对功能性医用电子植入体的可持续电源设计具有重要的参考价值[42]。

图4 基于光伏电池的自驱动植入式能源收集器件Fig.4 Self-powered IEHs based on photovoltaic cells
2.4 自驱动腕表(AW)
AW是一种以手腕运动为动力源的手表。当佩戴者移动时,手表中偏心摆动的重物使得弹簧弯曲,弹簧拨动齿轮转动,进而驱动微型发电机在几毫秒内产生电能,并为电容器或可充电电池等储能设备充电。利用这种能量转化机制,自驱动腕表可以获取体内机械能(图 5(a))。1999年,Goto 等[15]将基于石英表的自供能系统置于狗的右心室壁上。在约 200 次/分钟的心跳速度下,该系统 30 min 内可收集到 80 mJ 心跳能,相当于每次心跳产生了约 13 µJ 的能量。2017年,Zurbuchen 等[16]对前期的质量不平衡振荡发生器(Mass Imbalance Oscillation Generator,MIOG)进行了优化,通过去除不必要的部件减轻了器件的重量和体积。他们分别在猪的不同心外膜部位植入了 MIOG,观察到植入部位对能量转换率有显著影响。这些 MIOG 还可连接电容器以储存转化来的能量,并为特定的心脏起搏器供电。

图5 基于腕表和热释电发电机的自驱动植入式能源收集器件Fig.5 Self-powered IEHs based on automatic wristwatch and pyroelectric nanogenerator
2.5 热释电发电机 (PYENG)
热释电效应是可自发极化晶体的一种自然物理效应。它是一种晶体的极化强度随温度改变而表现出的电荷释放现象,宏观上是温度的改变使在材料的两端出现电压或产生电流。基于热释电效应的发电机能将低梯度恒温的热能转化为电能,可用于人类活动相关的热能收集[18-19]。2015年,Liu 等[43]研究了 PVDF 的热释电特性及其在近红外光辐照下的远距离操纵性能,设计了一种由热释电发电机提供可调节电脉冲的无线植入装置。该装置可通过红外辐射为起搏器供电或刺激生物神经(图 5(b))。
2.6 生物燃料电池(BFC)
生物燃料电池是一种利用生物体内物质化学反应产生电能的能源收集器件,可分为两类:微生物燃料电池(Microbial Fuel Cells)和酶燃料电池(Enzyme bioFuel Cells)[44-45]。其中,微生物燃料电池通常太大,不适合在体内应用;酶燃料电池在体内可以利用酶催化氧化葡萄糖,故常被用作植入式电子器件的电源。目前,研究人员已经证明在修饰电极上使用酶催化剂,可获得活体动物体内葡萄糖和氧气之间氧化还原反应产生的电能。该氧化还原过程可写成如下:


图6 植入式生物燃料电池Fig.6 Implantable biofuel cells
基于酶的 BFC 已经在植物(仙人掌[46]、葡萄[47]和橘子[48]),哺乳动物(大鼠[23,49-51]、兔子[47]和猪[52]),软体动物(蜗牛[53]和蛤[22]),昆虫(曼陀罗[54]和蟑螂[54-56]),龙虾[21]等生物体上进行研究应用(图 6)。
2010 年,Flexer 和 Mano[46]提出使用固定有氧化还原酶的电极植入到活的仙人掌茎中,并能对可见光做出实时动态响应。除了利用分子自组装法、溶胶-凝胶法等方法固定酶电极,Cinquin 等[49]也提出了一种只涉及各种酶和氧化还原介质机械束缚过程的酶电极制备方法。所制备的功能性植入式葡萄糖 BFC 植入到自由活动大鼠的腹膜后间隙可以产生电能(图 7(a))。为了扩大 BFC 的应用范围,Schwefel等[54]于 2014 年首次将海藻糖/氧气 BFC 植入蟑螂和飞蛾体内,该电池可为安装在昆虫背部的用于无线通信的振荡器供能(图 7(b))。在飞蛾活动时,BFC 可以产生 15.6 µW·cm-2的面积功率密度。这表明 BFC 具有构建自供能“机械”昆虫的潜能。
2.7 蜗内电位(EP)
蜗内电位是存在于耳蜗内淋巴间隙的一种类似电势的电化学梯度,是声压振动在听神经处传导为神经递质信号的主要驱动力(图 8(a))。Mercier等[25]展示了一种基于外淋巴和内淋巴之间 K+离子转移产生 EP 的植入式电源(图 8(b))。他们将两个电极片插入麻醉豚鼠耳蜗,电极轴与位于豚鼠体外的微电子芯片相连,结果表明豚鼠的蜗内电压可以驱动芯片持续工作 5 h,相当于蜗内压每 40~360 s 发射一次 2.4 GHz 无线电监测信号。

图7 基于生物燃料电磁的自驱动能源收集器件Fig.7 Self-powered IEHs based on biofuel cell
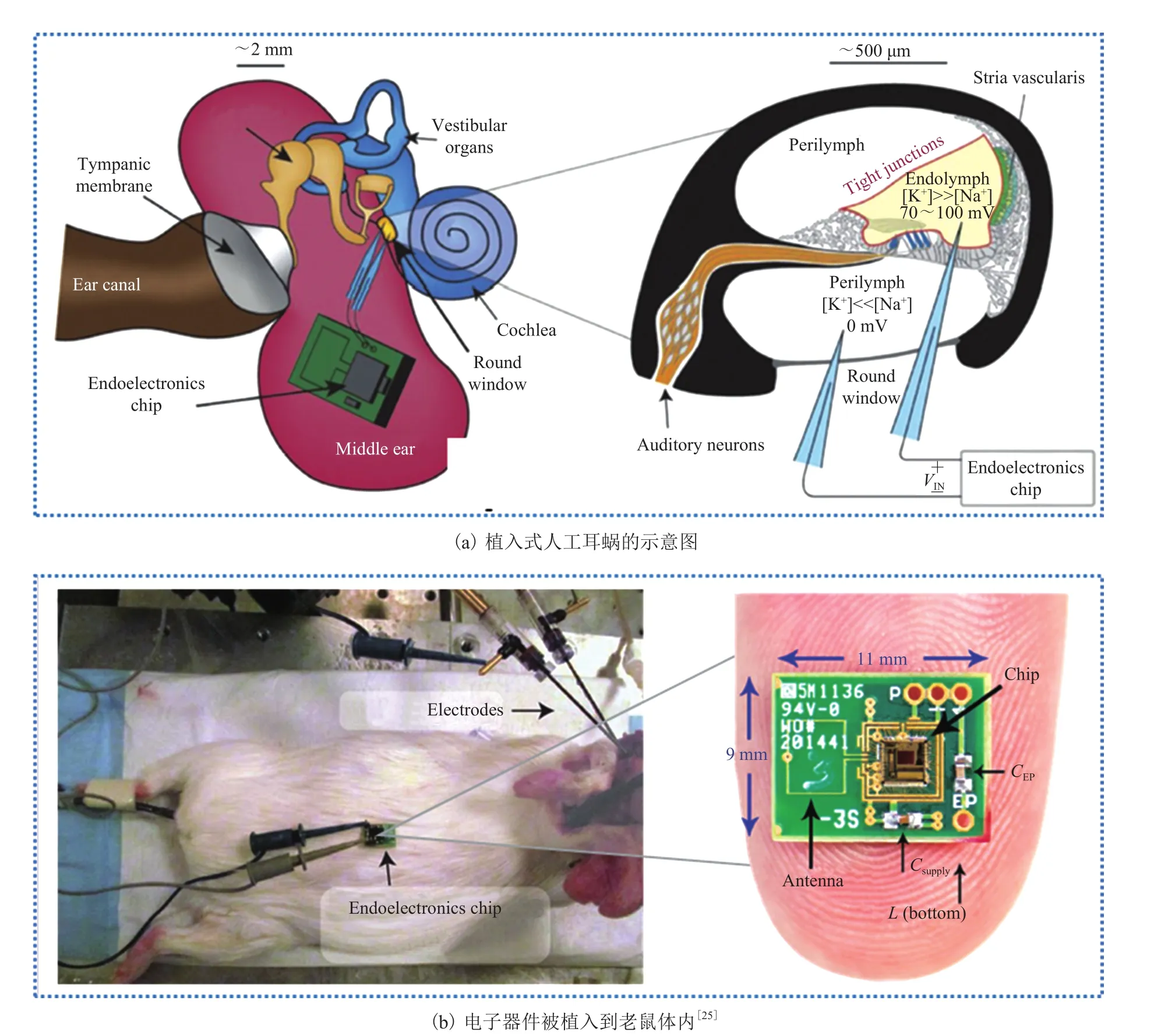
图8 利用蜗内电位的自供能植入式电子器件Fig.8 Self-powered IEHs based on endocochlear potential
3 应 用
3.1 传感应用
IEHs 不仅可以作为电源,还可以作为传感器,特别是有源传感器。由于内脏运动产生的能量可被 IEHs 收集到,所以 IEHs 的输出电压、电流与许多生物医学信号密切相关,如心电、心率、血压、血流速度、呼吸频率和相位等。
基于 iTENG,Zheng 等[10]研制了一种用于实时监测心脏活动的自供能无线传输系统(图 9(a))。利用该系统,发电机收集到的信号可以无线传输给外部设备,并实时显示心脏的部分信息。鉴于 iTENG 在体内输出较高,且可以稳定工作,不仅可用于给 IMEs 供电,还可用于构建自供能无线医疗监测系统。Ma 等[28]提出了一种自供能植入式摩擦有源传感器(Implantable Triboelectric Active Sensor,iTEAS),并将其用于监测房颤、室性早搏等多种生理、病理征象(图 9(b))。他们将 iTEAS 植入活体猪的心包内发现,输出信号可反映心率和节律、血压、血流速度、呼吸速率和呼吸周期等信息。因此,iTEAS 可作为实时诊断心脏疾病的辅助性器件,如房颤、室性早搏、慢性阻塞性肺病和哮喘。

图9 植入式能源收集器件用作自驱动传感器Fig.9 IEHs were applied as self-powered sensors
基于压电效应的 IEHs 也可用于检测生理信号。例如,基于锆钛酸铅((1-x)Pb(Mg1/3Nb2/3)O3-(x)Pb(Zr,Ti)O3,PMN-PZT)的可消化柔性压电装置能够收集胃肠道内的机械能,并且可以感知胃腔的机械形变(图 9(c))。作为胃肠传感器,这种装置可用于诊断和治疗运动障碍,也可监测减肥时的食物摄入[57]。Liu 等[58]设计了一种小型、柔性、自供能的心内压传感器 (Endocardial Pressure Sensor)(图 9(d))。将该传感器植入到猪的左心室和左心房中,在高、低压环境下均具有良好的响应性能和机械稳定性。此外,心内压传感器还可以检测室性颤动和室性早搏等心律失常症状。该装置推进了微型植入式医疗传感器用于心血管疾病监测和诊断的进程。
3.2 治疗应用
植入式自供能器件可以收集机械能并能将其转化成电能,因此 iTENG 有望成为 IMEs 的可持续电源——提供电刺激或给电子器件供电。
Jiang 等[59]用甲壳素、纤维素、丝素纤维、米纸和蛋清 5 种天然材料制备了 BD-iTENG,(图 10(a))。它们分别可以产生 8~55 V 的开路电压和 0.08~0.6 μA 的短路电流。BD-iTENG 作为电源,加速了功能障碍心肌细胞簇的搏动,改善了细胞收缩的一致性,为治疗心动过缓、心律失常等心脏疾病提供了一种新方案。Li 等[60]制备了一系列具有半球阵列结构的 BD-iTENG(图 10(b))。同时,他们利用金纳米棒对近红外光敏感这一特性,有效地调控了发电机在体内的降解过程。此外,将发电机的体内输出施加在成纤维细胞上,加快了细胞在划痕处的迁移速度,促进了成纤维细胞的增殖,这对伤口愈合过程非常有利。该工作证明了 iTENG 用于促进组织修复的可行性。
2019 年,Ouyang 等[61]制备了一种基于 iTENG的全可植入共生起搏器,它可以在大型动物上实现能源收集、存储以及心脏起搏(图 10(c))。这种共生起搏器成功地纠正了窦性心律失常,防止了病情恶化。该植入式共生生物电子器件有望在疾病的治疗和诊断领域得到应用。同年,Zhao 等[62]利用新型永磁摩擦纳米发电机(Magnet Triboelectric Nanogenerator)成功建立了一种用于肿瘤治疗的纳米药物传递系统(Drug Delivery System),如图 10(d)所示。该研究采用阿霉素负载红细胞作为抗肿瘤药物系统。其中,阿霉素的释放量在发电机电刺激下显著增加,结束刺激后释放量恢复正常,从而建立了可控药物传递系统。研究表明,该新型永磁摩擦纳米发电机控制的药物传递系统在肿瘤治疗中具有显著的治疗效果,在临床中具有广阔的应用前景。
4 总结与展望
纳米技术与生物医疗系统的快速协同发展,正在引领医疗领域的新一轮革命。其中,自驱动生物医疗系统的发展依赖于微型芯片功耗的不断降低以及 IEHs 工作效率的持续提升。目前,研究工作者已对 IEHs 进行了深入研究,并且已在一些动物、植物等活体模型上进行了实验。除了用于能源收集,IEHs 还可作为自供能传感器用于监测生理体征,包括心电图、心率、血压、血流速度、呼吸频率和相位;也可用于监测一些病理状况,如房颤、室性早搏和高血压等。此外,IEHs 也能作为电刺激源,用于刺激脊髓、心脏和大脑等器官,进而治疗慢性疼痛、心率异常和帕金森综合征等疾病。

图10 植入式能源收集器件用于疾病治疗Fig.10 IEHs were applied for treatment of disease
目前,IEHs 所面临的主要挑战是柔性部件的集成化以及系统的小型化。因此,在保证对能源收集器件有足够能量供应的同时降低它的重量和体积,对于能源收集器件植入体内至关重要。IEHs 需要具有较高的输出及稳定性,而有效的电源管理可以大大提高 IEHs 能源转换效率,进而提高它的输出性能。此外,为了进一步发掘IEHs 在医疗领域的潜力,需要对器件的柔性、灵敏度、弹性、拉伸性能、稳定性和生物相容性等多个关键性能进行革新。随着材料科学、电子工程和微加工技术的发展,科研工作者可以利用柔性集成电路技术制备具有高能量转换效率、高输出及超薄柔性结构的 IEHs。另外,生物安全性也是植入式装置最重要的标准之一,包括器件的生物相容性、植入手术安全性和长期耐用性,这些性能保证了器件真正应用于临床。现阶段依旧迫切需要对 IEHs 的性能及其实际应用和商用潜力进行定性和定量评价。其中,合适的标准化评价对于设计 IEHs 具有重要意义。随着植入式能源收集器件的不断优化和发展,该类器件将被广泛用于生物医疗领域,包括心血管传感、脉搏监测、神经电刺激、细胞电刺激、药物递送等,可对未来医疗健康产业产生重要影响。
