黑藻与金鱼藻自然衰亡过程中营养盐释放规律研究
2020-02-07王立志宋红丽
王立志, 宋红丽, 董 彬, 李 宝
临沂大学资源环境学院, 山东省水土保持与环境保育重点实验室, 山东 临沂 276005
沉水植物是水生态系统中至关重要的组成部分. 沉水植物在生长过程中将化学元素和太阳能转化为鱼类、水禽、昆虫、大型哺乳动物和微生物的食物,植物在生长过程中向水体释放氧气,改变水体环境,为水体中生物的生长提供必要的条件[1]. 沉水植物扎根底泥,植株生长在水中,占据了整个水体,同时具有许多重要的生态功能,如提升湖泊生态系统的自净能力,形成合理的生态结构[2]. 然而,沉水植物生命周期一般都比较短(1 a左右). 当沉水植物衰亡分解后,植物光合作用停止,氧气释放结束. 细菌和真菌在分解植物残体的过程中反而消耗水体中的氧,加剧了水质的恶化过程[3]. 因此,对以沉水植物主导的湖泊控制和管理显得尤为重要.
在湖泊控制管理中,沉水植物分解对湖泊水质的影响一直备受关注[4]. 水生植物分解研究大多关注沉水植物重量变化、温度效应、化学物质的迁移转化等[5]. 同时,在植物分解试验中多采用将植物体风干或烘干后再进行分解试验. 试验结果虽然能反应植物分解速率,但是与实际的植物分解环境差别较大. 同时,植物在分解过程中底泥和水之间存在物质交换,底泥对水环境的影响复杂,因此很难消除底泥的影响. 据此,该研究采取底泥覆膜的方式阻隔底泥和水之间直接的物质交换,水中营养盐的变化均由沉水植物导致. 选取我国广泛分布的沉水植物黑藻和金鱼藻作为试验材料,在黑藻和金鱼藻进入衰亡过程时开展试验,模拟自然状态下黑藻和金鱼藻的分解过程,研究其营养盐释放规律,分析环境因子及生物量的变化与营养盐之间的关系,以期为以沉水植物主导的草型湖泊综合治理提供依据.
1 材料与方法
1.1 试验材料与设计
底泥采自山东临沂沂蒙湖富营养化水华暴发水域,采用彼得森采泥器于2017年7月采集. 采集后样品经过低温风干后过筛(筛孔尺寸0.150 mm),去除粗粒及动植物残体,然后充分混匀. 将混匀后的底泥加入小型玻璃容器中(顶直径×底直径×高=5 cm×5 cm×10 cm,容器壁预先用蒸馏水冲洗干净),底泥铺设厚度为10 cm,底泥面与桶顶部平行,以免多余的水进入,同时便于下一步薄膜封顶.
黑藻和金鱼藻幼苗均采集自沂蒙湖(2017年5月),室内培育至9月份开始试验. 选用健壮无附着物的植物体,存在少量附着物的植物进行人工清洗后再进行下一步操作,并连根整株采集,将黑藻和金鱼藻根部捆扎后分别栽植在多个小型玻璃容器中,每个栽植180 g,然后用塑料薄膜捆扎植物根部并将塑料薄膜外边缘捆扎在小型玻璃容器外壁,以阻隔底泥与水之间的直接物质交换,底泥与水之间的物质交换只能通过植物通道进行(见图1). 将捆扎好的植物放置在大试验桶中(顶直径×底直径×高=32 cm×32 cm×80 cm,桶壁预先用蒸馏水冲洗干净). 每大桶放置3个小型玻璃容器(生物量总计540 g),然后缓慢注入处理后的沂蒙湖湖水52 L(湖水过0.45 μm滤膜过滤以弱化藻类及其他浮游生物的影响). 黑藻和金鱼藻分别设置3个平行组. 试验进行100 d,采样间隔为10 d.
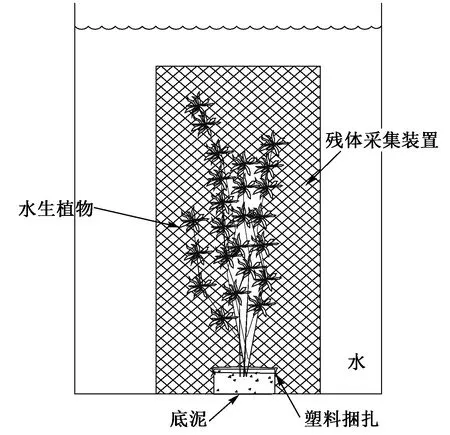
图1 试验装置示意Fig.1 Schematic diagram of the experimental device
试验在挡雨通风棚内进行,以最大限度接近自然环境,挡雨棚与外界空气连同,试验时间为9—12月. 初始水温为(17.80±0.5)℃,试验开始前采集水样进行测定,同时采用电极测定底质物理指标,上覆水及底泥初始理化指标作为初始0 d的数值,结果如表1所示.
1.2 取样与分析
水样采集采用虹吸管抽取的方式,每次采集水面以下10、40和70 cm处的等体积水(总计10 mL)混匀. 上覆水ρ(TP)、ρ(TN)、ρ(DTP)、ρ(DTN)采用过硫酸钾氧化法测定;ρ(DTP)、ρ(DTN)是将水样预先过0.45 μm孔径的醋酸纤维滤膜,而后用过硫酸钾氧化法测定;ρ(SRP)、ρ(NH4+-N)、ρ(NO3--N)是将水样预先过0.45 μm孔径的醋酸纤维滤膜,而后用比色法测定. 磷浓度用连续流动分析仪(意大利Systea公司,FLOWSYSTEA-Ⅲ)测定.ρ(PP)为(PP表示颗粒态磷)ρ(TP)与ρ(DTP)之差,ρ(PN)为(PN表示颗粒态氮)ρ(TN)与ρ(DTN)之差,ρ(DOP)为ρ(DTP)与ρ(SRP)之差,ρ(DON)为ρ(DTN)与ρ(NH4+-N)、ρ(NO3--N)之差. 每个样品均重复测定3次,采用3次平均值作为计算数据.
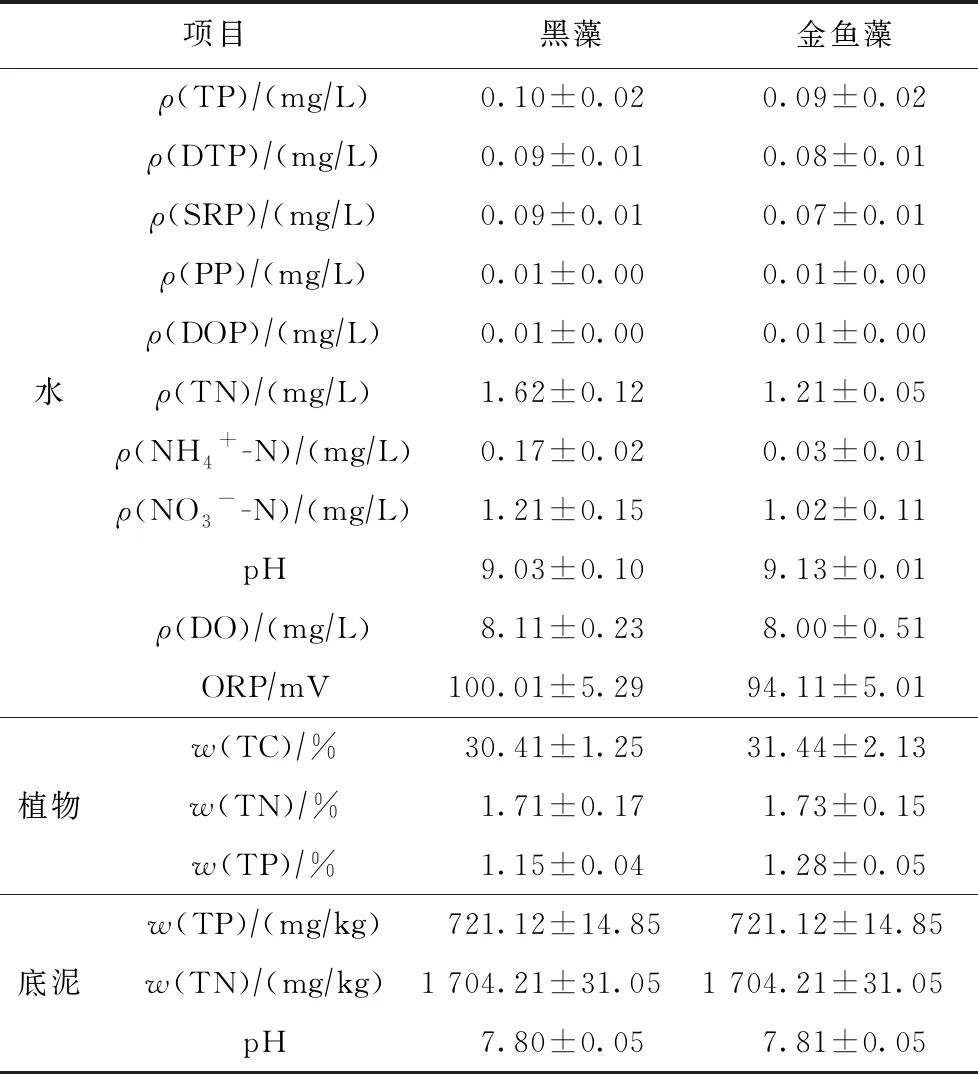
表1 底泥和上覆水初始理化指标
注: TC为总碳; DTP为溶解性总磷; SRP为溶解性活性磷; PP为颗粒态磷; DOP为溶解性有机磷; ORP为氧化还原电位.n=9. 数据为平均值±标准差.
植物和底泥中氮、磷消解后用连续流动分析仪测定其质量分数. pH和ORP采用pH多参数分析仪(上海仪电科学仪器股份有限公司,PHSJ-4A)测定.ρ(DO)采用便携式溶氧仪(美国,YSI-550A)测定.
1.3 生物量计算及统计分析
植物生物量统计时,将试验装置的残体收集装置整体去除水面,然后进行称量,以计算生物量的损耗. 然后按Olson指数衰减模型[6]计算其分解速率,表达式为
Wt=W0e-kt
(1)
式中:t为时间,d;Wt为植物在第t天时生物量与初始生物量的百分比,%;W0为植物初始生物量,定义为100%;k为植物分解速率,d-1.
1.4 数据分析
数据分析采用SPSS 16.0,主成分分析采用SPSS 16.0中因子分析模块逆推导进行计算,数据通过Z-score 标准化方法进行标准化处理后提取各指标主成分得分(特征根)大于1. 建立营养盐主成分与环境因子主成分之间的函数关系,分析环境因子变化与水中营养盐指标之间的关系. 显著性检验采用SPSS 16.0中T检验. 方差分析多重比较采用One-Way ANOVA中的LSD检验法.
2 结果与分析
2.1 植物分解速率
由图2可见,黑藻和金鱼藻两种沉水植物分解速率均表现出先快后慢的变化趋势,其分解速率(k)分别为0.011、0.010 d-1,金鱼藻和黑藻两种沉水植物生物量剩余50%时分别为63.01和69.31 d. 因此,黑藻的分解速率略大于金鱼藻. 方差分析表明,黑藻和金鱼藻在分解过程中生物量无显著性差异(P>0.05). 经过100 d的分解金鱼藻和黑藻两种沉水植物的生物量剩余百分比(37%~39%)基本稳定,即每个大试验桶生物量稳定在200 g左右.
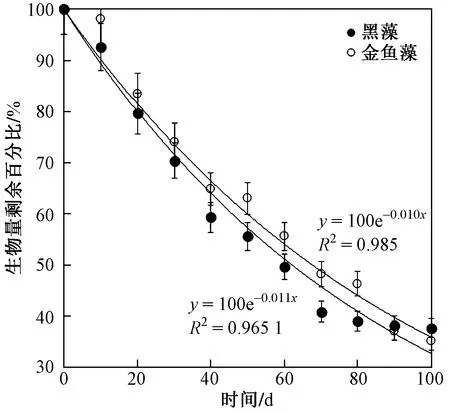
图2 黑藻与金鱼藻生物量剩余百分比变化及Olson指数衰减模型Fig.2 Changes of biomass residual percentage and Olson index attenuation model of H. verticillata and C. demersum
2.2 水中氮、磷质量浓度变化
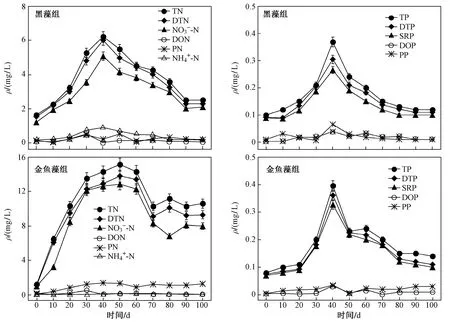
图3 水中氮、磷质量浓度的变化Fig.3 The concentrations of P and N in water
由图3可见,水中氮、磷质量浓度在试验开始后呈加速上升趋势,黑藻组ρ(TN)、ρ(DTN)、ρ(NO3--N)、ρ(NH4+-N)、ρ(TP)、ρ(DTP)、ρ(SRP)、ρ(PP)在试验第40天时达最大值,分别为(6.23±0.31)(6.02±0.22)(5.09±0.15)(0.90±0.03)(0.37±0.08)(0.30±0.05)(0.27±0.06)(0.06±0.01)mgL. 金鱼藻组ρ(TN)、ρ(DTN)、ρ(NO3--N)在试验第50天时出现最大值,分别为(15.14±1.02)(13.80±1.41)(12.85±1.21)mgL.ρ(TP)、ρ(DTP)、ρ(SRP)、ρ(DOP)、ρ(PP)在试验第40天时达最大值,分别为(0.40±0.05)(0.36±0.04)(0.33±0.04)(0.04±0.00)(0.04±0.00)mgL. 总体来看,试验组氮、磷质量浓度在试验第40~50天时出现最大值. 水中磷形态以DTP和SRP为主,氮形态以DTN和NO3--N为主,所以黑藻和金鱼藻在衰亡过程中向水体释放的氮、磷形态主要为NO3--N和SRP. 方差分析表明,金鱼藻组ρ(TN)、ρ(DTN)、ρ(NO3--N)、ρ(NH4+-N)、ρ(PN)显著高于黑藻组(P<0.05), 而金鱼藻组与黑藻组之间各形态磷质量浓度无显著差异(P>0.05).
2.3 水中环境因子变化
由图4可见,试验时间处于秋冬交替时期,温度(T)呈逐渐下降趋势,在试验后期,温度略有回升. 水中环境因子pH、ρ(DO)、ORP在试验过程中均呈不同程度的先降后升趋势. 在试验40~50 d时,水体中氮、磷质量浓度最高,pH、ρ(DO)、ORP的值最低. 植物分解过程中由于微生物分解植物残体对水中DO的消耗,引起了环境因子pH和ORP同时下降. 在试验后期,植物分解速率相对较缓慢,环境因子pH、ρ(DO)、ORP缓慢上升. 黑藻组和金鱼藻组pH平均值变化范围分别为7.02~9.61、7.09~9.13;ρ(DO)平均值变化范围分别为6.02~9.57、7.22~9.75 mgL. 黑藻组和金鱼藻组之间pH与ρ(DO)无显著差异(P>0.05). 黑藻组和金鱼藻组ORP平均值变化范围分别为62.12~140.31、28.66~94.31 mgL. 黑藻组ORP显著大于金鱼藻组(P<0.05).
2.4 水中环境因子与氮、磷质量浓度变化之间的关系
水生植物在衰亡过程中向水体释放营养盐的同时改变了水体中的理化环境. 植物、营养盐和环境因子三者之间相互作用,存在一定的联系. 基于此,采用数据降维的方式通过主成分分析建立三者之间的函数关系,通过数学模型阐明其之间的相互联系.
金鱼藻和黑藻试验组环境因子分别提取出1个主成分,命名为Fj和Fh. 各试验组营养盐及环境因子主成分各因子载荷系数如表2所示.
金鱼藻组营养盐提取出2个主成分为F1和F2. 黑藻组营养盐提取出3个主成分为f1、f2和f3(见表2). 因子载荷表明,金鱼藻组营养盐主成分F1主要体现的指标分别为ρ(TN)、ρ(DTN)、ρ(NO3--N)、ρ(NH4+-N)、ρ(SRP)、ρ(TP)、ρ(DTP)、ρ(DOP);F2主要体现的指标分别为ρ(PN)、ρ(DON)、ρ(PP). 黑藻组营养盐主成分f1主要体现的指标分别为ρ(TN)、ρ(PN)、ρ(DTN)、ρ(NO3--N)、ρ(NH4+-N)、ρ(SRP)、ρ(TP)、ρ(DTP)、ρ(DOP);f2主要体现的指标为ρ(DOP);f3主要体现的指标为ρ(DON)、ρ(PP).
黑藻和金鱼藻组营养盐第一主成分解释了大部分指标,同时通过各营养盐、环境因子主成分和生物量剩余百分比函数拟合表明,F1、f1与Fj、Fh和生物量剩余百分比函数拟合的效果较好,其余主成分拟合效果较差,因此取F1、f1进行分析.
Fj和Fh与F1、f1之间二次曲线拟合效果较好〔见图5(a)(b)〕,随着Fh的增加,F1呈二次曲线变化趋势,而金鱼藻组f1呈下降趋势.
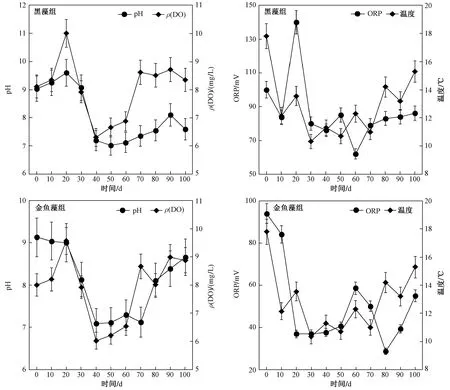
图4 水中环境因子的变化Fig.4 The environmental factors in water
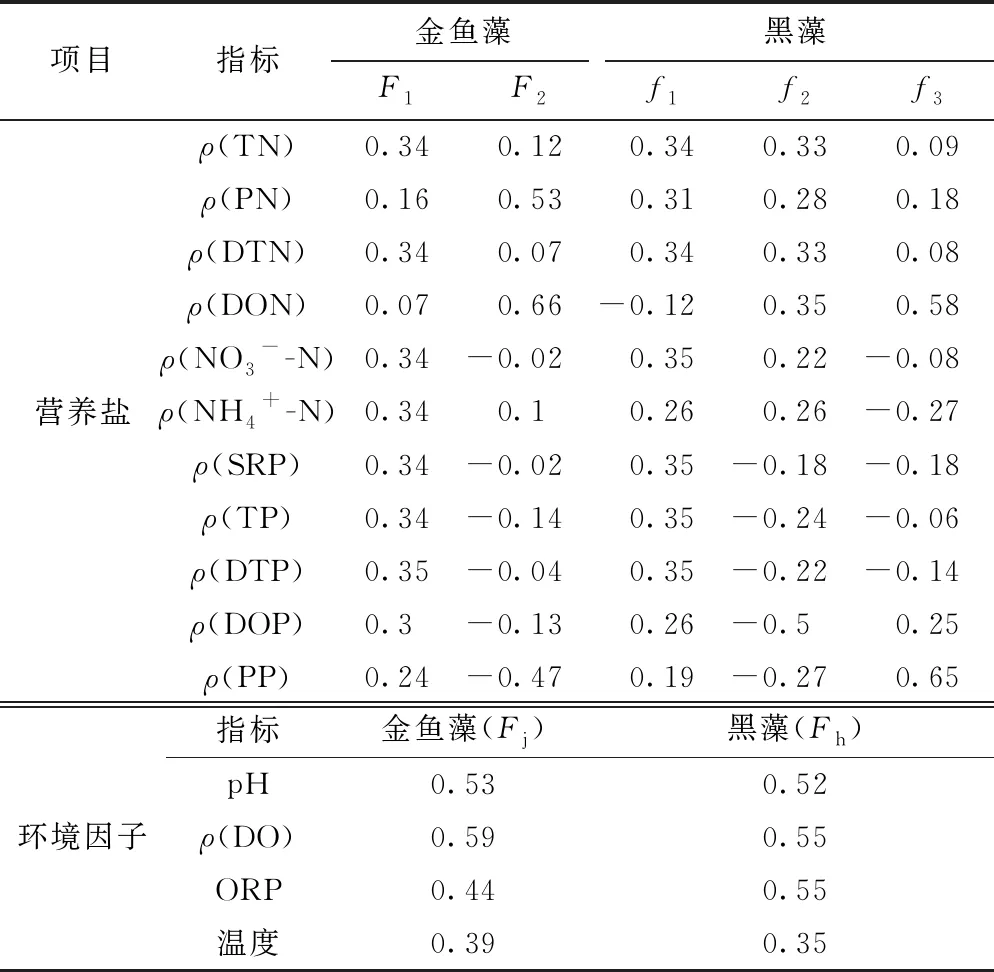
表2 营养盐及环境因子主成分各因子载荷系数
F1、f1与环境因子主成分Fj和Fh函数表达式分别为
F1=0.477 6Fh2-1.677 2Fh-1.108 6,
R2=0.715 5
(2)
f1=0.045 1Fj2-1.580 1Fj-0.099 5,
R2=0.841 8
(3)
Fh和Fj与各环境因子指标以及F1和f1与各营养盐指标之间的表达式分别为
Fh=0.53ZpH+0.59ZDO+0.44ZORP+0.39ZT
(4)
Fj=0.52ZpH+0.55ZDO+0.55ZORP+0.35ZT
(5)
F1=0.34ZTN+0.16ZPN+0.34ZDTN+0.07ZDON+
0.34ZNO3--N+0.34ZNH4+-N+0.34ZSRP+
0.34ZTP+0.35ZDTP+0.3ZDOP+0.24ZPP
(6)
f1=0.34ZTN+0.31ZPN+0.34ZDTN-0.12ZDON+
0.35ZNO3--N+0.26ZNH4+-N+0.35ZSRP+
0.35ZTP+0.35ZDTP+0.26ZDOP+0.19ZPP
(7)
式中,Zi为Z-score标准化后的指标,其中i为TN、PN、DTN、DON、NO3--N、NH4+-N、SRP、TP、DTP、DOP、PP.
生物量剩余百分比与F1和f1之间二次曲线拟合效果也较好〔见图5(c)(d)〕,随着生物量剩余百分比的增加,黑藻和金鱼藻营养盐第一主成分F1和f1均呈先升后降的抛物线趋势.
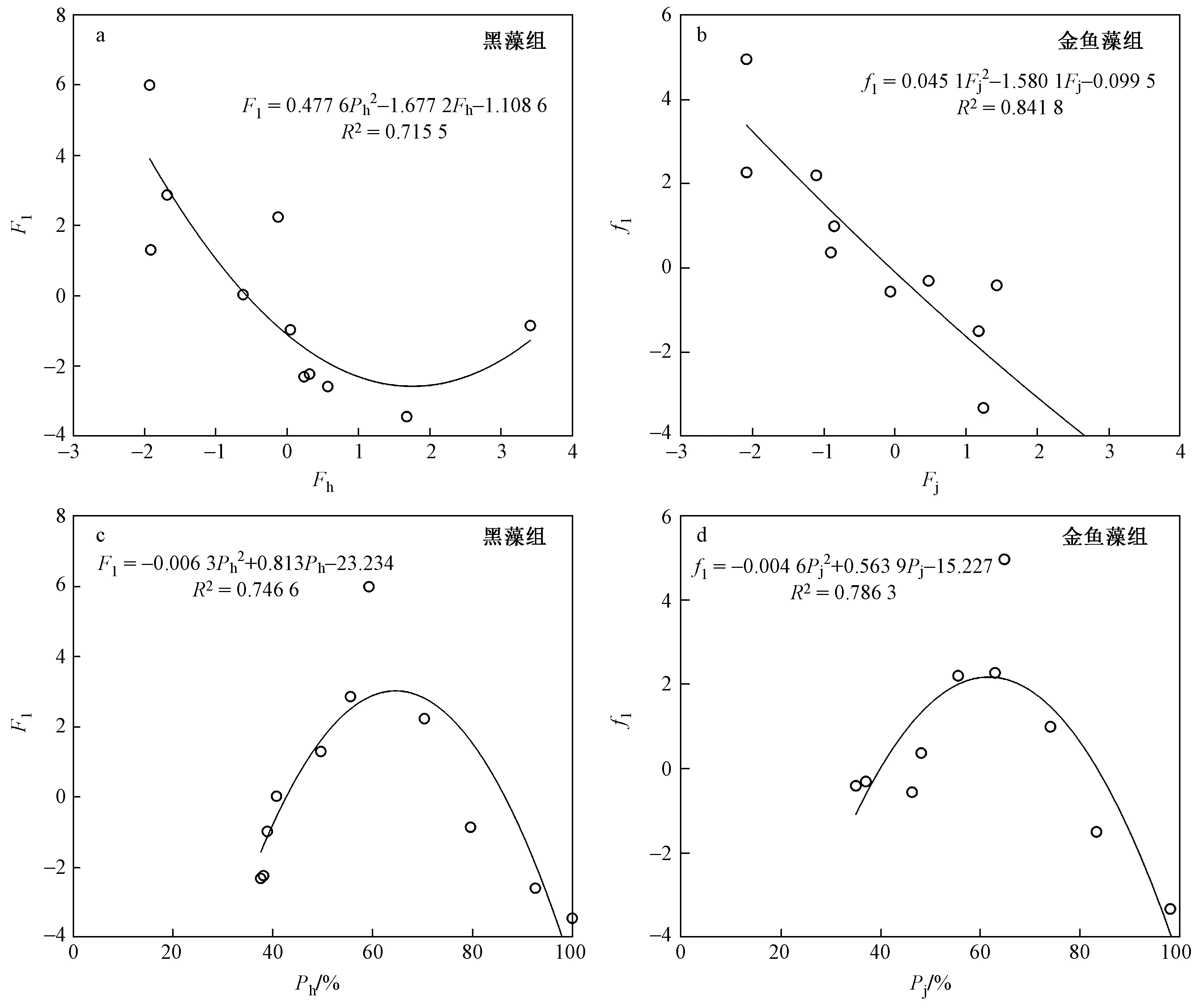
图5 营养盐第一主成分与环境因子主成分及生物量剩余百分比之间函数关系Fig.5 Functional relationship between the first principal component of nutrients and the principal component of environmental factors and the residual percentage of biomass
黑藻组和金鱼藻组营养盐第一主成分与生物量剩余百分比(P)函数表达式分别为
F1=-0.006 3Ph2+0.813Ph-23.234
R2=0.746 6
(8)
f1=-0.004 6Pj2+0.563 9Pj-15.227
R2=0.786 3
(9)
3 讨论
3.1 水生植物分解的阶段性
水生植物衰亡具有明显的阶段性,水生植物残体的分解可分为3个阶段,即物理淋溶阶段、微生物降解阶段、机械和无脊椎动物破碎阶段[7]. 这主要是由于水生植物分解初期,其植物体内部易溶性的有机颗粒及无机盐类含量相对较多,分解主要以物理性的淋溶溶解为主,植物消减速率快. 随着分解过程的继续,植物中难溶性物质的含量相对增大,植物分解速率下降[8]. 因此,也可以将水生植物分解粗略的划分为2个阶段,第1个阶段是植物残体的快速淋溶阶段,第2个阶段是难溶性的物质与微生物以及胞外酶作用缓慢分解阶段[9]. 黑藻和金鱼藻在模拟条件下分解过程符合阶段性理论过程,植物在第1个阶段分解速率相对较高,分解时间相对较短,约30 d(见图2). 其后的时间黑藻和金鱼藻进入第2个分解阶段,分解速率下降.
3.2 干湿处理方式对水生植物分解速率的影响
对植物的处理方式不同(干或湿)也会导致植物的分解速率不一致,目前较多研究采用将植物直接烘干或风干处理后进行分解速率的测定. 如叶春等[10]对黑藻分解试验表明,前16 d的平均分解速率为 0.038 5 d-1,而第16~64天对应的平均分解速率为 0.009 6 d-1;Carvalho等[11]和Howard-Williams等[12]研究表明,眼子菜(P.pectinatus)的分解速率分别为0.019和 0.020 5 d-1;XIE等[13]研究表明,凤眼蓝(Eichhorniacrassipes)、苦草(Vallisnerianatans)和微齿眼子菜(Potamogetonmaackianus)的分解速率分别为0.047~0.099、0.03、0.01 d-1;Rogers等[14-15]试验获得鲜菹湿处理和干处理分解速率分别为0.04和0.02 d-1. 各水生植物分解速率对比见表4. 该研究采用鲜植物模拟自然分解方式获得黑藻和金鱼藻分解速率分别为0.011、0.010 d-1,与已有研究[10]比较略偏低,这可能与该试验条件采用将植物培育于底泥中有关. 该试验是从植物生长后期开始,植物在叶部衰亡过程时根系仍然具有一定的活性,植物主体仍然处于缓慢的光合作用之中,所以其分解速率相对较慢.
3.3 CN对水生植物分解速率的影响
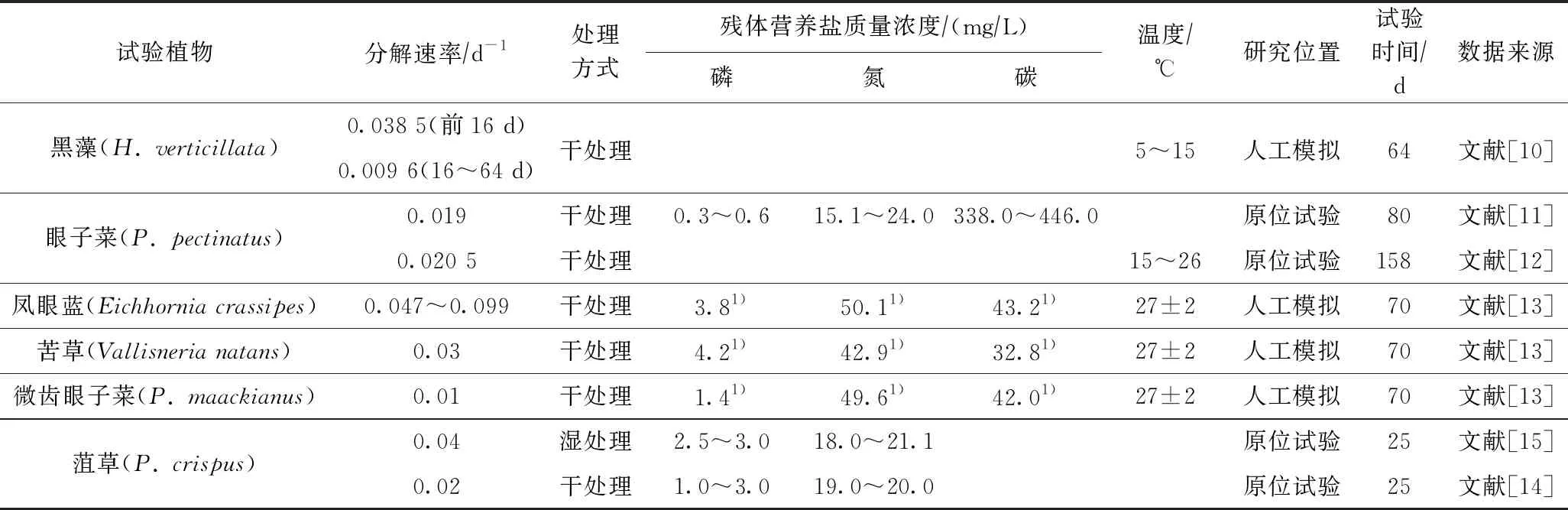
表4 水生植物分解速率对比
注: 1) 表示试验初始值.
影响水生植物分解速率的因素有很多,外部环境因素包括水体的温度、pH、ρ(DO)及水体营养盐浓度等[16]. 内部因素包括木质素、碳、氮的含量等. 植物内部物质组成尤其是CN被认为是影响分解速率的主要因素[17-18]. Taylor等[19]通过对陆生植物的衰亡进行研究,认为植物体CN能够很好地预测植物的分解速率,CN越高分解越慢,反之亦然. 曹勋等[20-21]通过对芦苇(Phragmitescommunis)、马来眼子菜(P.wrightiiMorong)、荇菜(Nymphoidespeltatum)、茭草(Zizanialatifolia)、莲(Nelumbonucifera)、菹草(P.crispus)、狐尾藻(Myriophyllumverticillatum)等水生植物的研究也得出了类似的结果. 该研究中金鱼藻与黑藻的CN分别为18.17±1.32和17.78±1.01,在水生植物中处于相对较低的水平,所以分解速率相对于挺水植物等其他大型植物较高.
3.4 环境因子与植物营养盐释放之间的相互作用
该研究表明,随着试验的进行,水中各形态氮质量浓度迅速上升,而试验结束时,水中各形态氮质量浓度降至较低水平,这主要是由于在试验开始时随着植物的分解,植物体内尤其是叶片所含的氮被快速的释放出来,导致水中各形态氮含量迅速升高[22]. 在植物腐烂分解初期时,由于水体中DO含量相对较高,水中有机态氮易于被氧化为无机态氮,因此水中各形态无机态氮含量迅速升高[23]. 随着试验的进行,植物腐烂分解消耗水中的DO,致使其含量维持较低的水平. 水体中的无机态氮一部分在反硝化细菌的作用下生成N2、N2O等气体扩散到空气中[24];另一部分受到植物残体的吸附作用,导致了后期水中氮含量降低[25].
水生植物组织中,磷主要以磷酸根离子或化合物的形态存在,极易被淋溶而损失[26]. 李燕等[27]通过烘干样品测定黑藻、梅花藻(Batrachiumtrichophyllum)、苦草、小茨藻(Najasminor)、金鱼藻5种沉水植物的衰亡过程,发现水生植物TP的释放速率比TN快,一般需10 d左右,而TN和有机物的释放分别需要29和20 d左右. 潘慧云等[28]在沉水植物自然分解下的研究表明,苦草和金鱼藻在秋冬季节死亡后,植物衰亡分解缓慢,向水体释放的氮、磷并不高,并不会导致水体中氮、磷质量浓度的显著升高,直至翌年回暖后,水体氮、磷质量浓度才有所升高. 从释放时间上该研究也表明,TP的释放要快于TN,这与李燕等[27]的研究结论一致. 同时,黑藻和金鱼藻在模拟自然状态下衰亡速率与潘慧云等[28]研究结果基本一致.
沉水植物分解是一个复杂的生化学过程,受到众多环境因素的影响[29]. 环境因子对沉水植物的分解影响很大[30]. 如温度越高微生物活动越活跃,从而导致了对沉水植物残体分解的加速. Jacobs等[31]研究表明,夏天水生植物残体分解速率明显高于冬天. 自然条件下,沉水植物在冬季分解缓慢,而在春季温度上升回暖的时候才开始大规模的腐烂分解. 这与该研究在模拟自然状态下得到的沉水植物黑藻和金鱼藻分解速率相对较小的结论一致. 同时也说明,冬季尽可能将水生植物打捞出水体,是减少第二年“二次污染”的一个重要途径. 在植物快速分解过程中,试验组pH迅速下降,是由于植物残体在微生物的作用下分解生成CO2所致,这一时期,植物大量衰亡,体内不稳定的有机物被快速释放到水体中,水中CO2含量上升,打破了水中ρ(H+)和ρ(OH-)的平衡,从而使得pH下降[32]. 在植物快速衰亡期,植物向水体释放了大量的溶解性有机碳,从而刺激了微生物的大量繁殖,而大量微生物的繁殖对植物的分解又消耗了水中的DO,从而导致水中ρ(DO)和ORP的下降[33].
沉水植物在腐烂分解的过程中释放营养盐,同时改变其自身的生物量与周围的环境因子,因此,他们之间应该存在必然的联系. 马月等[34]通过在菹草-金鱼藻耦合生长的方式,研究菹草腐解-金鱼藻生长耦合作用对水质的改善效果,同时采用线性拟合的方式对建立水体ρ(TN)、ρ(DTN)、ρ(DTP)、ρ(DOP)、ρ(TOC)与植物叶绿素、水体叶绿素、植物可溶性蛋白、植物丙二醛之间的多元线性拟合. 该研究虽然对营养盐进行了主成分分析,但未对主成分分析结果进行进一步的数学分析. 另外大多数研究对环境因子与营养盐之间的关系多基于某一指标的分析,获得的数学函数模拟效果较为不理想[35-36]. 该研究采用对环境因子和营养盐分别提取主成分的方式对数据进行降维处理,然后进行函数拟合获得了较好的拟合效果,能够较好地反应生物量变化对营养盐的影响,以及环境因子与营养盐之间的函数关系.
4 结论
a) 黑藻和金鱼藻两种沉水植物在模拟自然状态下,分解速率分别为0.011、0.010 d-1. 在分解过程中两种沉水植物生物量无显著性差异(P>0.05).
b) 试验组氮、磷质量浓度在试验第40~50天时出现最大值. 水中磷形态以ρ(DTP)和ρ(SRP)为主,氮形态以ρ(DTN)和ρ(NO3--N)为主,黑藻和金鱼藻在衰亡过程中向水体释放的氮、磷形态主要为ρ(NO3--N)和ρ(SRP).
c) 水中环境因子pH、ρ(DO)、ORP在试验过程中均呈不同程度的先降后升趋势. 通过对环境因子和营养盐分别提取主成分的方式对数据进行降维处理,可以获得环境因子与营养盐以及生物量剩余百分比与营养盐之间较好的函数拟合效果,建立他们之间的函数关系.
