经皮腔内血管成形术治疗人工血管移植物内瘘狭窄或闭塞的疗效
2020-01-15彭嘉欣万恒刘正军
彭嘉欣,万恒,刘正军
(南方医科大学南方医院 血管外科,广东 广州 510515)
慢性肾脏病是指肾脏结构或功能障碍超过3个月的疾病,全球范围内患病率为11.7%~15.1%[1]。2012年我国的流行病学调查显示国内成年人的慢性肾脏病患病率达10.8%,终末期肾病(end stage renal disease,ESRD)患病率达0.03%[2]。ESRD患者需进行肾脏代替治疗,大部分患者选用血液透析治疗。因此,建立一条有效的血液透析通路对ESRD患者非常关键。最理想的血液透析通路是自体动静脉内瘘(arteriovenous fistula,AVF),具有手术简单、通畅率高及并发症少等优点。但对于自体浅静脉条件欠佳(管径细或距离皮肤位置深)、AVF术后不成熟、AVF长期使用后无充足的可穿刺部位、AVF并发症无法修复等患者,众多的指南以及专家共识均认为人工血管移植物内瘘(arteriovenous graft,AVG)是除AVF以外的第一选择[3-4]。近年国外数据显示,AVG的1、3年初级通畅率分别为40%~75%、27%~54%[5],尽管AVG的初级通畅率较AVF差,但经修复可以达到较好的次级通畅率。以往针对AVG的狭窄或闭塞,采用传统的外科开放手术治疗居多,如旁路搭桥、补片成形等,但开放手术修复存在一系列问题,如创伤较大,无法反复进行修复以及术后移植物感染风险等。随着血管腔内技术高速发展,经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)也 应用于AVG狭窄和闭塞的治疗中,本研究通过收集AVG后狭窄和闭塞患者的临床资料,对其进行随访和回顾性分析,探讨PTA对AVG术后狭窄和闭塞的疗效。
1 资料与方法
1.1 一般资料
收集自2016年1月—2018年3月南方医科大学南方医院血管外科收治的AVG术后狭窄和闭塞的66例患者共进行105次PTA的临床资料,其中男25例,女41例;年龄范围在18~80岁,中位数为57.5岁。病例纳入标准:⑴确诊为ESRD,需要行血液透析;⑵AVG建立至少1个月,且至少完成1次有效透析;⑶因AVG内狭窄或者继发血栓形成导致无法进行正常血液透析治疗;⑷术前影像学检查明确为AVG闭塞,或狭窄病变程度>70%。病例排除标准:⑴移植物感染;⑵患者心脏功能差,射血分数<30%;⑶瘘管侧中心静脉狭窄或闭塞。本组患者导致肾脏功能衰竭的原发病情况和AVG吻合方式如表1-2所示。
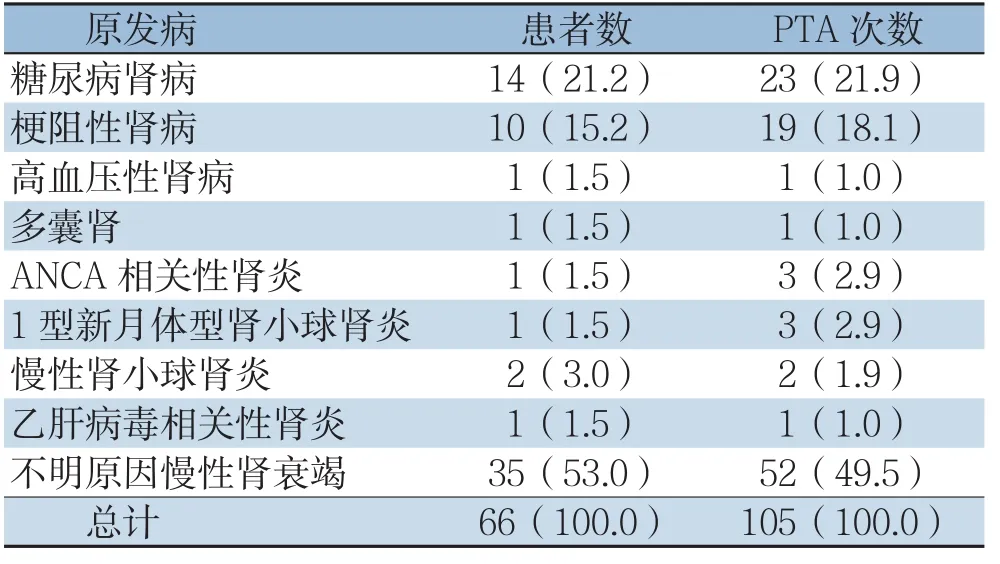
表1 患者肾脏功能衰竭的原发病情况及PTA次数[n(%)]Table 1 The primary disease of patients with renal failure and times of PTA performed[n(%)]

表2 患者AVG吻合方式及PTA次数[n(%)]Table 2 AVG anastomosis methods of the patients and times of PTA performed[n(%)]
1.2 手术方法
根据术前判断的病变部位,采用1%利多卡因局部浸润麻醉穿刺点,Seldinger技术经皮穿刺置入血管鞘(6 F或7 F)。静脉推注0.5 mg/kg肝素,进行全身肝素化。移植物闭塞性病变的处理如下:置入交叉鞘(从动脉端向静脉端置入鞘,从静脉端向动脉端置入鞘),首先采用经鞘抽吸的方式清除部分移植物内的血栓,然后采用2个20 mL注射器抽取肝素盐水,分别接2个鞘,进行交替抽吸清除移植物内血栓(图1)。清除血栓后,造影显示人工血管、内瘘静脉吻合口、近心端静脉狭窄情况(图2)。根据狭窄部位的情况采用0.035导丝或0.018导丝配合4 F椎管开通后,置入球囊导管(美国波科,Gladiator),球囊直径根据病变情况选择,压力泵充盈球囊(图3),至狭窄病变完全打开,扩张2次,每次持续时间30 s,扩张后造影证实残余狭窄<30%(图4)。如扩张后造影显示残余狭窄>30%,则选择直径更大的球囊再次PTA,术中若球囊达到最大压力仍然无法打开的狭窄病变,则采用同直径的切割球囊(美国波科)进行扩张直至狭窄病变打开。移植物狭窄性病变的处理如下:经鞘造影明确狭窄病变部位(自移植物动脉端吻合口至中心静脉全程造影)(图5),根据狭窄部位的情况采用0.035导丝或0.018导丝配合4 F椎管开通后,选用相应直径的高压球囊进行PTA治疗(美国波科,Gladiator)(图6),压力泵充盈球囊,至狭窄病变完全打开,扩张2次,每次持续时间30 s,扩张后造影证实残余狭窄<30%(图7)。如扩张后造影显示残余狭窄>30%,则选择直径更大的球囊再次PTA,术中若球囊达到最大压力仍然无法打开的狭窄病变,则采用同直径的切割球囊(美国波科)进行扩张。PTA后出现严重的弹性回缩导致残余狭窄>30%,或出现血管破裂,则使用覆膜支架植入(美国戈尔Viabahn)。治疗结束后,再次造影,观察AVG动脉端吻合口、内部以及静脉流出道全程通畅,同时检查AVG震颤及杂音是否正常。缝合切口后拔除鞘管,压迫穿刺点止血后,无菌敷料覆盖。术后继续观察瘘管通畅情况,若有需要可即时使用AVG进行穿刺血透。

图1 交叉鞘交替抽吸血栓Figure 1 Alternating thrombus aspiration by using the cross-sheath

图2 AVG闭塞患者PTA术前造影 A-B:移植物;C:静脉流出道Figure 2 Preoperative angiography in patient with AVG occlusion A-B:The graft;C:Venous outfl ow tract

图3 AVG闭塞患者行球囊扩张 A:球囊扩张动脉端吻合口;B-I:球囊扩碎移植物内血栓;J:球囊扩张静脉端吻合口Figure 3 Balloon dilation in patient with AVG occlusion A:Balloon dilation of the anastomotic stoma of the arterial end;B-I:Balloon fragmentation of the thrombus in the graft;J:Balloon dilation of the anastomotic stoma of the venous end

图4 AVG闭塞患者PTA术后造影 A:动脉端;B:静脉端;C:静脉流出道Figure 4 Postoperative angiography in patient with AVG occlusion A:Arterial end;B:Venous end;C:Venous outfl ow tract

图5 AVG狭窄患者PTA术前造影 A:移植物内部穿刺点、静脉端吻合口;B:静脉流出道狭窄Figure 5 Preoperative angiography in patient with AVG stenosis A:Puncture site inside the graft and anastomotic stoma of the venous end;B:Stenosis at the venous outfl ow tract

图6 AVG狭窄患者行球囊扩张 A-B:球囊扩张移植物穿刺点狭窄;C:球囊扩张静脉吻合口狭窄Figure 6 Balloon dilation in patient with AVG stenosis A-B:Balloon dilation of stenosis at the puncture site of the graft;C:Balloon dilation of stenosis at the vein anastomotic stoma

图7 AVG狭窄患者PTA术后造影 A:动脉端;B:静脉端Figure 7 Postoperative angiography in patient with AVG stenosis A:Arterial end;B:Venous end
1.3 术后随访及评价指标
术后24 h内再次予以 低分子肝素3 000 U进行皮下注射,此外不再予以额外的抗栓治疗(患者因其他原因如冠心病、周围动脉病需要进行抗栓治疗的按照原方案进行)。术后要求患者每3个月复诊,随访内容包括瘘管流量、静脉压力、透析过程是否异常等,并进行常规超声检查等。本组所有患者随访截止时间为2019年4月1日。血管狭窄程度分级:轻度狭窄<50%,中度狭窄50%~<70%,重度狭窄≥70%。技术成功:解剖学成功(血流恢复和残余狭窄<30%)且至少一项血流动力学异常指标或临床指标(静脉压、动脉压、通路内血流量、体格检查)恢复至正常或基线值。干预后初级通畅时间:从此次干预到下一次干预之间的时间间隔,包括对该通路任何问题的所有干预措施。干预后累计通畅时间:对血管通路干预后直到通路废弃的时间间隔。
1.4 统计学处理
用Excel 2016对患者一般情况、影像学资料、手术治疗情况等数据进行汇总,采用SPSS 17.0统计软件进行统计学分析,使用Kaplan-Meier法计算手术后患者的干预后初级通畅率和干预后累计通畅率,组间比较采用Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 手术结果
本组105例次PTA中AVG狭窄病变39例次,闭塞病变66例次;101例次PTA术后能触及AVG震颤和顺利进行透析,技术成功率达96.2%。66例患者中29例(43.9%)行2次或2次以上手术。术中其他部位狭窄病变情况见表3。术中造影发现有9例(8.6%)出现中心静脉狭窄,但患者无肿胀手表现。5例术中球囊扩张达到最大压力,狭窄仍然无法打开,采用切割球囊扩张后狭窄均被打开。3例患者原外院植入的裸支架发生支架内狭窄,其中1例球囊扩张后支架狭窄解除,2例球扩后狭窄未见明显改善,遂植入覆膜支架。3例患者球囊扩张后弹性回缩严重,其中1例采用更大直径球囊扩张后残余狭窄<30%,2例使用更大直径球囊扩张后无法改善,植入覆膜支架。1例患者因PTA术后反复狭窄,3个月之内需要2次PTA治疗,遂植入覆膜支架。1例患者术中导丝无法开通AVG静脉端流出道闭塞,中止腔内手术改开放手术修复。其余患者AVG均能够恢复通畅,3例患者出现术后第1天瘘管血栓形成,经再次PTA手术后瘘管复通。

表3 各部位狭窄病变情况(n)Table 3 Stenotic lesions of various sites(n)
2.2 通畅率
术后随访12~27个月,随访超声如图8所示。4例患者透析期间因人工血管感染行移植物切除术;7例患者死亡,其中4例因心脑血管事件死亡,2例因肺部感染,1例因肝功能衰竭;12例患者在随访过程中失访。全组PTA术后的AVG初级通畅时间为(12.1±1.20)个月,其中狭窄组患者为(16.3±1.95)个月,闭塞组患者为(10.3±1.36)个月,两组比较,差异有统计学意义(χ2=4.335,P=0.037);全组术后AVG的6个月与1年的初级通畅率为62.7%、38.8%,其中狭窄组78.1%、48.9%,闭塞组为53.5%、33.1%。全组PTA术后的AVG累计通畅时间为(19.7±1.46)个月,其中狭窄组为(21.0±2.45)个月;闭塞组为(19.0±1.80)个月,两组比较,差异无统计学意义(χ2=0.392,P=0.531);全组术后6个月、1年的干预后累计通畅率分別为80.9%、74.1%,其中狭窄组86.9%、79.6%,闭塞组77.8%、71.4%(图9)(表4)。

图8 PTA术后随访超声 A:正常动脉端吻合口;B:静脉端吻合口轻度狭窄;C-D:静脉端吻合口重度狭窄Figure 8 Ultrasound examination after PTA A:Normal anastomotic stoma of the arterial end;B:Mild stenosis of the anastomotic stoma of the venous end;C-D:Severe stenosis of the anastomotic stoma of the venous end

图9 患者术后通畅时间曲线 A:全组初级通畅时间曲线;B:狭窄组与闭塞组初级通畅时间曲线;C:全组累计通畅时间曲线;D:狭窄组与闭塞组累计通畅时间曲线Figure 9 Patency-time curves of the patients A:primary patency-time curve of the whole group;B:Primary patency-time curves of stenosis group and occlusion group;C:cumulative patency-time curve of the whole group;D:Cumulative patency-time curve of stenosis group and occlusion group
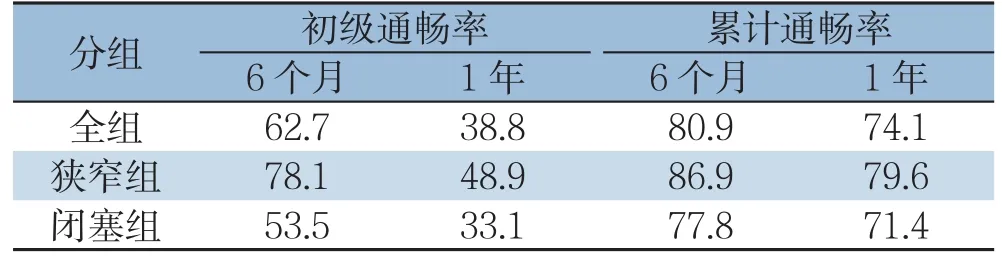
表4 干预后初级通畅率与累计通畅率(%)Table 4 Primary patency and cumulative patency rates(%)
2.3 围术期并发症
本组患者围术期无死亡病例,2例因术中腔内操作后静脉破裂出血,予球囊填塞后植入覆膜支架。2例患者术后第1天出现AVG震颤消失,超声提示血栓形成,再次手术造影发现狭窄病变处存在显著的弹性回缩,采用更大直径的球囊再次行PTA后瘘管恢复通畅。1例患者术后第1天出现移植物内血栓形成,急诊二次手术取栓后出现静脉破裂,予球囊扩张+覆膜支架植入术后,AVG搏动、震颤良好,但二次手术后第1天,再次出现移植物内瘘震颤消失,再次手术造影发现支架内血栓形成,且人工血管与支架接驳处局部移位,支架部分移位至自体静脉内,取栓后将人工血管与Viabahn覆膜支架吻合,吻合后造影显示人工血管及支架内通畅,触诊搏动震颤良好,术后患者顺利透析。1例患者在取栓、球扩后造影显示人工血管静脉端流出道腋静脉可见充盈缺损,考虑为人工血管移植物内血栓脱落所致,取栓导管反复拉栓未见明显改善,遂局部切开人工血管,向腔内插入取栓导管将血栓自人工血管切口拉出体外,缝合血管后造影显示AVG通畅,触诊AVG震颤良好,术后患者顺利透析。
3 讨论
目前国内透析患者通路类型中AVG比例较低,很多医生及患者对AVG的长期通畅率、术后并发症等问题存在诸多顾虑。AVG最常见的术后问题就是静脉端狭窄,继而导致血栓形成、瘘管闭塞,典型的组织学表现为侵袭性血管内膜增生[6],从而导致血流阻力增加、血流减少,最终形成血栓。以往临床上多采用溶栓、导管取栓、旁路搭桥以及补片成形的方式进行处理,溶栓或切开导管取栓可以清除移植物内血栓,但考虑到移植物血栓形成绝大多数继发于狭窄性病变,单纯处理血栓遗留狭窄病变移植物内短时间就可能再次闭塞。补片成形对于单一的狭窄有效,但多部位的狭窄补片的方法太过于繁琐。对于较高位的流出道静脉狭窄,旁路搭桥存在近端吻合部位可能难以暴露,需要全身麻醉等弊端,且多次手术后组织粘连,开放手术无法反复多次进行,因此越来越多的学者倾向于采用腔内手术解决AVG的狭窄或闭塞的病变[7]。PTA是通过球囊扩张的压力将增厚的内膜撕裂,从而改善管腔的狭窄,是治疗动静脉内瘘狭窄和闭塞的有效方法,具有创伤小、成功率高、不良反应少、感染率低、最大程度保护可穿刺静脉资源的特点,延长了单个部位动静脉内瘘的使用时间;且术后可立即透析,避免患者过渡期使用中心静脉置管透析[8-10]。
腔内技术处理AVG狭窄或闭塞除了微创、安全,患者体验好之外,亦拥有较好的远期疗效。文献[11]报道,传统开放手术治疗AVG狭窄或闭塞的成功率为77%~85%,但1年的干预后初级通畅率和累计通畅率仅有10%和27%。本研究显示PTA术后内瘘的成功率达96.2%,1年的干预后初级通畅率和累计通畅率均明显高于开放手术(38.8%vs.10%,74.1%vs.27%)。报道[12]中比较传统手术和PTA两种治疗方式的成功率和通畅率,并认为没有明显差异,本研究中的成功率和通畅率均高于开放手术,这可能与近年来的介入治疗的球囊、支架工具等得到更好的发展和改善有关。此外NKF-K/DOQI临床指南要求PTA治疗后 6个月初级通畅率至少应超过50%[13]。近年国外多项研究[14-15]报道,PTA治疗AVG术后6个月和1年的初级通畅率分别在36%~76%和17%~47%,本研究的数据达到指南要求,且与国外研究报道结果相一致。AVG狭窄病变PTA治疗后再狭窄的发生率较高,1年内有55%~75%的患者出现复发[16],因此需要进行规律随访监测;狭窄性的病变若达到再次干预指征需及时处理,尽量避免瘘管闭塞的发生。本研究中有29例患者(43.9%)行多次手术治疗。近年来逐渐有使用药涂球囊、切割球囊治疗顽固性狭窄的报道。一项纳入162例患者共行254次PTA的系统评价[17]报道 药涂球囊治疗AVF和AVG狭窄病灶的实验组比传统球囊对照组在6个月时具有更高的初级通畅率,且没有发生手术相关并发症。另一项纳入623例患者的前瞻性随机对照试验[18]报道,切割球囊治疗AVG静脉端吻合口的6个月和1年的初级辅助通畅率达86%和63%,明显高于高压球囊组的(56%和37%),本研究中5例患者使用切割球囊扩张后效果良好,且未见严重并发症。
本组中共有7例患者植入覆膜支架:2例因术中腔内操作后静脉破裂出血;2例因原外院植入的裸支架发生支架内再狭窄,球扩后狭窄未见明显改善;2例患者球囊扩张后弹性回缩严重,采用更大直径球囊扩张仍然无法改善;1例患者因PTA术后反复狭窄,3个月之内需要2次PTA治疗。NKF-K/DOQI临床指南建议在PTA中出现复发性狭窄(3月内需要2次及以上介入治疗)、急性弹性回缩或者处理PTA并发血管破裂时可考虑植入支架。越来越多的报道显示支架在多种条件下均可使用,包括:AVG静脉吻合口狭窄、AVG血栓形成、头静脉弓狭窄、假性动脉瘤和植入起搏器等引起的血管狭窄等[19]。从目前临床证据来看,裸支架植入术和PTA治疗AVG静脉吻合口狭窄、中心静脉狭窄的远期疗效基本一致[20-21],而覆膜支架较单纯PTA或金属裸支架显出优越的远期通畅率[22-24]。但植入支架仍有几个不可避免的问题:⑴尽管覆膜支架的远期通畅优于PTA,但仍然不可避免存在边缘性狭窄;⑵支架的价格昂贵;⑶支架植入后,牺牲了近端静脉重新吻合再构建内瘘的可能性;⑷支架植入后可能出现的支架断裂、移位、感染等并发症。本研究中发现外院植入裸支架后出现支架内再狭窄2例,支架内血栓形成3例,支架局部移位1例,虽植入支架的患者在随访尚未发现断裂、感染等并发症,有病例报道在静脉吻合口植入支架后支架远处移位到肺动脉[25]和心脏[26]中,因此支架的相关并发症仍不可忽视,植入支架是否利大于弊需要术者权衡。目前关于植入支架的适应症仍存在很大争议,需要有前瞻性、多中心的大型随机对照实验来验证。
本研究中有2例患者术中发生静脉破裂,术中进行导管导丝腔内操作均应轻柔,在X线导引下操作,PTA球囊直径的选择以及Fogarty取栓管的操作均应小心谨慎。术中出现造影剂外溢时需及时判断血肿情况,若为1级血肿(稳定、非进展性且不影响透析通路流量),可对症处理皮下瘀斑,若为2级血肿(稳定性血肿但影响同流流量)或3级血肿(静脉完全或接近完全破裂所致的不稳定行血肿),应迅速确认破裂位置并使用球囊扩张压迫填塞管腔,必要时植入覆膜支架以稳定血肿和恢复通路流量。研究中有1例因移植物内血栓脱落至静脉流出道,反复腔内处理无效后转开放手术,近年来也有报道[27]提出杂交手术可行的观点,即最大限度利用不同的方法提高成功率和通畅率。对于AVG闭塞的案例,采用杂交的方法,移植物切开取栓的方式完全清除移植物内血栓,然后造影明确狭窄部位,采用PTA的方式处理狭窄,完成治疗。合并吻合口完全性闭塞及流出道静脉多处狭窄的情况,若导丝导管无法开通吻合口处闭塞,可以采用补片或搭桥的方式处理吻合口闭塞,流出道静脉的狭窄则可由PTA的方式解决。
综上所述,PTA治疗AVG狭窄或闭塞创伤小、安全有效,患者体验好,具有较好的干预后累计通畅率;AVG狭窄病变PTA治疗后再狭窄的发生率较高,因此需要进行规律随访监测,发现狭窄性的病变若达到再次干预指征需及时处理,尽量避免瘘管闭塞的发生;对于PTA术中出现显著弹性回缩的情况,或发生血管破裂出血球囊压迫无法止血,可采用覆膜支架植入进行处理。本研究总病例数较少、失访病例较多、属于单中心回顾性分析研究,结论可能存在一定偏差,因此其疗效及安全性有待前瞻性、多中心、大样本、设计更严谨的随机对照实验来确定。
