氨基酸定点突变提高灵芝蛋白LZ-8 热稳定性的研究
2020-01-14孙熙麟蒋振彦刘志屹戴璐孙非黄伟
孙熙麟 蒋振彦 刘志屹 戴璐 孙非 黄伟
(1. 吉林大学药学院,长春 130021;2. 吉林大学再生医学科学研究所,长春 130021)
LZ-8(Lin Zhi-8)是从灵芝孢子中分离纯化出来的一种具有免疫调节和抗肿瘤活性的同源二聚体蛋白质[1],临床前研究证实LZ-8 能够有效抑制荷瘤小鼠体内肺癌和肝癌的生长[2-4],具有极高的成药潜质。目前,人们已经在毕赤酵母体内重组表达了具有生物学活性的LZ-8 分子,并实现了LZ-8 分子中试规模的表达和纯化[5]。然而,在LZ-8生产过程中,由于机械破碎、搅拌、错流式膜过滤等操作的存在,不可避免造成蛋白质溶液局部升温,引发蛋白质解折叠乃至变性,严重影响了最终产物的效价和均质性。因此,提高LZ-8 分子热稳定性,对于生产出质量可靠,适用于临床新药申报的LZ-8 分子,具有重要现实意义。
随机或定点突变是改善蛋白质热稳定性的常规方法,它们的基本原理都是使用新的氨基酸取代蛋白质特定位置氨基酸,通过改变蛋白质内部相互作用进而增强蛋白质稳定性[6-7]。随机突变需要构建大量随机突变体,再根据突变体的热稳定性状况,筛选出热稳定性改善的突变体[8]。而定点突变是基于蛋白质结构和功能关系,通过理性计算和分析待突变氨基酸位点,再通过定点或定点饱和突变技术改造蛋白的一种方法[9-12]。基于理性计算的定点突变技术在改善蛋白质热稳定性方面有着广泛应用,在脂肪酶Lipase5、米根霉α-淀粉酶、胰蛋白酶等[13-15]分子上均有成功实例。因此,本项研究将选用基于理性计算的定点突变技术改善灵芝免疫调节蛋白LZ-8 的热稳性。
1 材料与方法
1.1 材料
LZ-8 蛋白质原液由长春钻智制药有限公司提供,纯度≥99.0%;毕赤酵母X33 菌株和pGAPZα-LZ-8 质粒为本实验室自行保存样本;Muta-directTM定点突变试剂盒购自于北京赛百盛基因技术有限公司;胎牛血清(Bioin,以色列)、MEM 培养基(BI,以色列)购自于上海逍鹏生物科技有限公司;WST-1 试剂盒购自于日本同仁化学研究所。
1.2 方法
1.2.1 软件及数据分析 从RCSB 网站(http://www.rcsb.org/)下载LZ-8 晶体结构文件3F3H.pdb,采用分子动力学计算软件NAMD(Version 2.9)模拟升温过程中LZ-8 全原子运动轨迹,具体参数:(1)模拟体系构建:采用CHARMM 力场,选用TIP3P 八面体水分子盒模型,将蛋白质分子置于10 Å 的水溶剂箱內,加入Na+平衡电荷;(2)能量最小化:用sander 模块进行3000 步能量最小化,执行最陡下降法500 步后转位共轭梯度法,以消除不合理的能量势垒;(3)加热:对系统加热使其从0 K 升温至303 K、313 K 和323 K,并在保持体积不变的状态下运行50 ps 带有位置限制的动力学,将非键相互作用阈值设为8 Å,使用弱耦合的算法来控制温度;(4)平衡:在常压条件下系统分别处在303 K、313 K 和323 K条件下,进行500 ps 的分子动力学模拟,以平衡系统;(5)动力学模拟:恒温恒压系统下进行分子动力学模拟,所用步长为2 fs,以每1000 步采集一次能量与坐标信息。分析动力学模拟过程中结构的均方根偏差值(Root mean square deviation,RMSD),再选择RMSD 值平衡阶段的数据,计算每个氨基酸的均方根涨落值(Root mean square fluctuation,RMSF),形成轨迹文件,最后通过VMD 软件分析该模拟轨迹,计算不同环境温度下LZ-8 分子的稳态构象。将LZ-8晶体结构文件3F3H.pdb 输入到软件PyMOL(Version 2.3)中,根据氨基酸残基B-Factor 数值的不同,以不同颜色标示各氨基酸残基,蓝色表示该氨基酸稳定性最高,红色表示稳定性最差。
1.2.2 LZ-8 分子定点突变 以本实验室已构建质粒pGAPZα-LZ-8 为模板,采用PCR 法对LZ-8 的核酸序列进行F8W 和R9K 双位点突变。设计PCR 点突变 引 物:M-f(5′- TCCGACACCGCTTTGATATGGAA GTTGGCATGGGAC-3′)和M-r(5′-GTCCCATGCCAA CTTCCATATCAAAGCGGTGTCGGA-3′),按 照MutadirectTM定点突变试剂盒的操作说明,使用MutadirectTM酶对模板质粒进行全长PCR,MutazymeTM酶再消化模板质粒,剩余PCR 扩增的全长突变质粒转化DH5α 感受态细胞,挑取若干克隆,小量提取质粒测序,将测序正确的突变质粒扩增后,按照文献[16]报道的方法,转化酵母X33 菌株,再进行LZ-8 突变体蛋白质的表达和纯化。
1.2.3 HeLa 细胞生长抑制实验 用含10%胎牛血清的MEM 培养基对本实验室冻存的HeLa 细胞株进行常规复苏和传代培养,按照1×104个/孔的细胞密度接种96 孔板,待细胞贴壁后,加入含2%胎牛血清MEM 培养基倍比稀释的LZ-8 或LZ-8 突变体,每个蛋白质浓度设置3 个复孔,37℃、5% CO2条件下培养24 h 后,选用WST-1 试剂测定细胞活力,450 nm 波长处读取吸光度,取复孔均值,应用Prism(Version 6.0)软件计算LZ-8 及LZ-8 突变体抑制HeLa 细胞生长的IC50值。
1.2.4 样品热力学参数测定 差示量热扫描分析仪MicroCal VP-DSC(通用电气医疗,美国)测定LZ-8和LZ-8 突变体相变温度Tm和相转变焓值ΔH,实验参数:LZ-8 或LZ-8突变体样品溶于0.01 M PBS缓冲液(pH7.2-7.4),终浓度1 mg/mL,进样体积500 μL,加热范围25-55℃,加热速度1℃/min。采集原始数据,应用Origin 软件分析样品各热力学参数。
1.2.5 统计分析 计量资料以x-±s表示,采用t检验进行组间比较。
2 结果
2.1 分子动力学软件模拟不同温度下LZ-8稳态构象
采用NAMD 软件计算系统温度从0 K 升高至303 K(30℃)、313 K(40℃)和323 K(50℃)时LZ-8 单体全原子运动轨迹,VMD 软件模拟出LZ-8单体在30℃、40℃和50℃三个温度下的稳态构象(图1)。在系统不断升温过程中,LZ-8 分子N-端α螺旋结构变得不再稳定,当系统温度上升到323 K(50℃)时,α 螺旋不但出现解螺旋,还发生显著空间位移,提示N-端α 螺旋为LZ-8 分子的温度敏感区域。
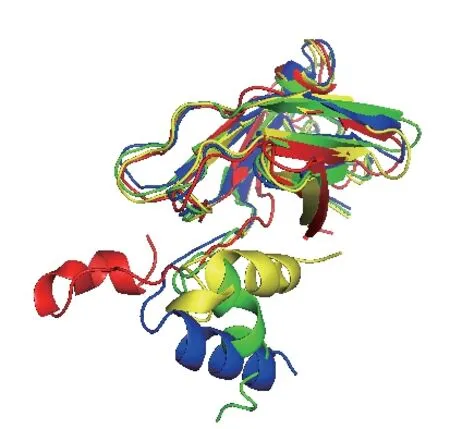
图1 不同温度下LZ-8 的稳态构象
2.2 温度因子B-factor预测LZ-8上热敏感的氨基酸位点
温度因子B-factor 常被用于反映氨基酸残基在蛋白质中的构象状态,B-factor 数值越高,模糊度越大,相应部位的构象就越不稳定或柔性越强。PyMOL 软件根据B-factor 的不同,对氨基酸残基进行色彩标记。随着B-factor 数值逐渐增大,标记颜色逐渐由蓝色、绿色、黄色转变至橙色和红色。根据温度因子B-factor的预测,LZ-8 存在3 组温度敏感位点(图2),它们分别是:(1)N-端α 螺旋上第8 和第9 位氨基酸;(2)β4 片层和β5 片层之间LOOP 环上第63-71 位氨基酸;(3)β7 片层上的第103 和104 位氨基酸。其中,N-端α 螺旋是B-factor 和NAMD 分子模拟预测的共同温度敏感区域,于是我们将待突变氨基酸位点定位到这一区域。
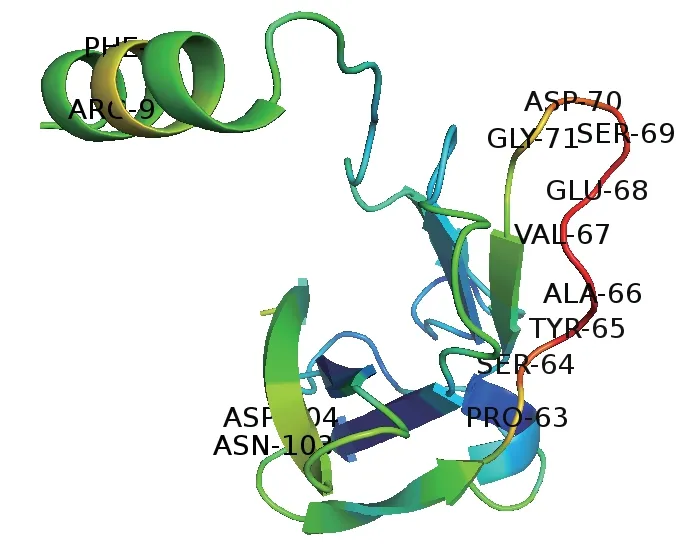
图2 B-factor 预测LZ-8 的温度敏感区域
2.3 LZ-8突变位点的选择和设计
如图2 所示,在LZ-8 分子N-端α 螺旋上,第8 位和第9 位氨基酸残基B-factor 数值高于其它位置氨基酸残基,推测它们比其它氨基酸残基对温度更为敏感,于是,选择第8 位和第9 位氨基酸残基进行双位点突变。已知,LZ-8 分子N-端α 螺旋结构的完整性对维持LZ-8 生物学活性至关重要,两个LZ-8 单体分子通过各自N-端α 螺旋交互作用,形成有活性的二聚体分子,当N 端α 螺旋结构破坏或丧失时,LZ-8 生物学活性消失[17]。为确保LZ-8 双位点突变后N-端α 螺旋结构保持不变,于是按照氨基酸残基极性相同,结构相似的原则,将第8 位苯丙氨酸(F)替换为色氨酸(W),将第9 位精氨基酸(R)替换为赖氨酸(K)(图3)。

图3 LZ-8 氨基酸双位点突变示意图
2.4 LZ-8及LZ-8突变体抑制HeLa细胞生长
LZ-8 具有抑制肿瘤细胞生长的活性,为检测LZ-8 突变体是否保留了原LZ-8 分子的生物学活性,我们对LZ-8 和LZ-8 突变体同时进行了HeLa 细胞的生长抑制实验,结果(图4)显示,LZ-8 突变体与LZ-8 具有一致的抑制肿瘤生长活性,两者作用HeLa 细胞24 h 的IC50值分别为2.407 μg/mL 和2.238 μg/mL,表明氨基酸F8W 和R9K 双位点突变没有对LZ-8 结构和生物学活性产生显著影响。
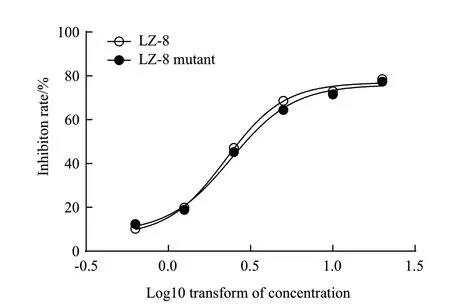
图4 LZ-8 及LZ-8 突变体对HeLa 细胞的生长抑制曲线(n=3)
2.5 LZ-8突变前后的热力学参数
差示扫描量热法通过测量以恒定速率加热时与分子热变性相关的热能改变来表征分子的热稳定性。相变温度Tm和相转变焓值ΔH是表征分子稳定性的两个重要参数,Tm值越大,表示蛋白质分子解折叠的温度越高,ΔH值越大,表示蛋白质分子解折叠的能垒越高,蛋白质分子越稳定。LZ-8 在生产及使用时均以溶液的形式存在,因此,我们应用差示扫描量热法对溶于PBS 缓冲液的LZ-8 和LZ-8 突变体进行了热力学参数分析(表1)。结果显示,LZ-8突变体较LZ-8 相变温度Tm上升0.92℃,相转变焓值ΔH提高23.14 kJ/mol,两者均显示出统计学差异,因此,氨基酸F8W 和R9K 的双位点突变改善了LZ-8 的热稳定性。

表1 LZ-8 及LZ-8 突变体的热力学参数(n=3,x-±s)
3 讨论
蛋白质热稳定性一直是制药业和酶工程领域研究热点所在,目前,蛋白质理性设计被广泛用于提高蛋白质的热稳定性[18-20]。根据提高蛋白质热稳定性机制不同,蛋白质理性设计可采用如下几种实施策略,如同源比对策略[21]、脯氨酸效应设计策略[22]、SCHEMA 模拟法[23]和温度因子设计策略[24]等。为精确定位LZ-8 温度敏感氨基酸位点,该项目选择了分子动力学模拟和温度因子预测两种实施策略相结合的方法,进行待突变氨基酸位点的选择和设计。文中分子动力学模拟了LZ-8 在3 个温度节点下的稳态构象,通过观测整体构象在升温过程中的动态变化来明确了LZ-8 分子温度敏感区域,即N-端α 螺旋,再在该区域内借助温度因子B-factor 进一步确定温度敏感氨基酸位点。这与其它应用分子动力学模拟直接预测温度敏感氨基酸位点的同类研究不同,其它研究多使用单一温度下模拟的分子稳态运动轨迹,计算被研究分子每个氨基酸的RMSF 值,再根据RMSF 值的大小判断氨基酸构象的稳定性,这一算法通常会得到数量较多的候选突变位点,还需结合分子已有结构和功能数据进一步缩小候选突变位点范围[13]。因此,在结构和功能数据不够完善的情况下,使用本文的“两步走”策略更为适宜。
明确氨基酸突变位点后,需要选择适宜的氨基酸对其进行替换。定点饱和突变是选择适宜突变氨基酸的方法之一,在该方法中研究人员需要针对待突变氨基酸构建由其它19 种氨基酸分别取代的突变体文库,再根据蛋白质性能指标对文库内蛋白质进行目标筛选[25]。虽然该技术在富马酸酶、脂肪酶/酯酶、细菌肽酶等[26-28]分子中成功实现了分子性能改善,但实验耗费的人力和物力仍是实际工作中需慎重考虑的因素。此外,研究人员还可以通过蛋白质虚拟饱和突变软件对目标突变体进行筛选,但该方法需要专门的软件,并且软件算法和参数设置不同,计算结果存在一定差异。本研究采用类似氨基酸策略,在LZ-8 的N-端α 螺旋内,选取与待突变氨基酸:第8 位苯丙氨酸和第9 位精氨酸,极性相同、结构类似的色氨酸(F8W)和赖氨酸(R9K)进行氨基酸替换,获得了温度稳定性提高LZ-8 突变体。较比苯丙氨酸和精氨酸,色氨酸的强疏水性,以及赖氨酸的高稳定性是新突变体热稳定提高的潜在原因。诚然,在本研究中没有构建F8W 和R9K 单独突变的突变体,因此尚无法从实验角度判别F8W 和R9K 各自给LZ-8 热稳定性带来的影响,这部分工作有待后续实验进一步证实。
4 结论
分子动力学模拟和B-factor 因子的联合预测能够有效定位LZ-8 分子的温度敏感区域。按照氨基酸极性相同,结构相似的原则,对LZ-8 分子N-端α螺旋进行的F8W 和R9K 双位点突变,在保证LZ-8突变前后N-端α 螺旋结构及抗肿瘤生物学活性不变的前提下,有效提高了LZ-8 分子热稳定性,有利于LZ-8 的生产、运输和存储。
