肝细胞胰岛素抵抗模型中PRKCZ的表达及其与胰岛素抵抗的相关性
2020-01-14贾朝霞常晓彤
贾朝霞,马 玉,郭 豪,常晓彤
(1.河北北方学院医学检验学院2015级,河北 张家口 075000;2.河北北方学院临床检验诊断学重点实验室,河北 张家口 075000)
糖尿病是以高血糖为特征的慢性代谢性疾病,常引起视网膜病变、肾功能衰竭等并发症。糖尿病分为4种类型,其中2型糖尿病(type 2 diabetes mellitus,T2DM)占绝大多数[1]。胰岛素抵抗(insulin resistance,IR)通常被认为是T2DM的发病因素,IR的发生可能与胰岛素信号通路中的蛋白因子改变有关。中国北方汉族人群T2DM易感基因定位于1P36.33-36.23[2],位于该区域的蛋白激酶Cζ亚型(protein kinase cepsilon zeta,PRKCZ)在胰岛素抵抗型2型糖尿病的发生发展中具有重要作用[3]。PRKCZ与糖尿病关系的最新研究也表明PRKCZ参与胰岛素信号传导,并且与胰岛分泌功能密切相关[4]。
我们利用本实验室已建立的肝细胞胰岛素抵抗模型,通过Western blot法检测PRKCZ表达情况,采用生物信息学方法分析PRKCZ与胰岛素信号通路蛋白的相互作用,探讨PRKCZ在胰岛素抵抗状态下是否表达异常以及与胰岛素抵抗的关系,为防治2型糖尿病提供理论依据。
1 材料与方法
1.1 仪器与材料
1.1.1 仪器 Omega LumG凝胶成像系统(美国Aplegen公司),Fresco低温高速离心机(赛默飞世尔科技公司),XB70型制冰机,HDB-PLUs型恒温金属浴(北京HEROS公司),YP402N型电子秤(上海精科公司),制胶器,电泳槽,转膜电泳槽,室温摇床,电泳仪,表面皿,镊子,剪刀,小铲子。
1.1.2 材料及试剂 HepG2人肝癌细胞(已建立肝细胞胰岛素抵抗模型,由本室保存),细胞裂解液(北京索莱宝科技有限公司),考马斯亮蓝染液,羊抗兔IgG二抗,β-肌动蛋白抗体,分离胶,浓缩胶,电泳缓冲液,甲醇,转膜缓冲液,PBST溶液,兔抗人PRKCZ抗体(北京博奥森生物技术有限公司),脱色液,上样缓冲液,PBS溶液,ECL显色试剂(联科生物技术有限公司),标记蛋白marker(中科泰瑞生物科技有限公司),5%脱脂奶粉,PVDF膜,滤纸,海绵垫,准备好的胶板。
1.2 方法
1.2.1 制胶 固定安装好制胶器,配制15 mL 12.5%的分离胶(两块胶的量),充分混匀后用加样枪沿两玻璃夹板的边缘迅速加到两玻璃板的夹层中,避免气泡产生,液面高度为整个玻璃板位置的2/3,快速加入蒸馏水直至夹层充满液体,使分离胶凝集并使胶面平整,若有气泡,可用加样针挑破气泡,最后在室温下放置30 min,待分离胶聚合形成直线并与加入的蒸馏水产生明显的分界线,倒掉玻璃板间的蒸馏水,加样枪迅速加入事先配制好的5%浓缩胶至玻璃板夹层中,加到适当位置后,插入梳子,放置20 min,待浓缩胶聚合后,将胶从制胶板上取下,若立即用,将胶板固定在电泳架上,放到电泳槽中,向电泳架中倒入1×电泳缓冲液,形成里高外低的液面差,以供电泳使用;若暂时不用,可以用蒸馏水浸湿的滤纸将胶包裹好放入冰箱备用(防止胶板干燥)。
1.2.2 样品处理 将已分装在EP管中的正常HepG2细胞与胰岛素抵抗的HepG2细胞在放在冰块上解冻,离心(11 600 r·min-1,4 min),加样枪吸除上清液,留取沉淀,向沉淀中(HepG2细胞)加入150 μL RIPA裂解液,再加入1.5 μL PMSF裂解抑制液,加样枪吹吸混匀使裂解液和细胞充分接触。将EP管放到冰上裂解,放置半小时,每隔10 min加样枪吹吸混匀一次,裂解完毕后,4 ℃、11 600 r·min-1离心4 min,吸出上清液放入新EP管中。按照1∶1的比例加入2×上样缓冲液,100 ℃金属浴5 min,使蛋白质变性。
1.2.3 电泳 将制作好的胶板固定电泳架放入电泳槽,缓缓向电泳槽中加入1×电泳缓冲液,形成里高外低的液面差,轻轻拔掉梳子后,若形成的孔空不齐,可先用加样针拨一拨,在第一个孔中加入15 μL的正常蛋白样品,第二个孔中加入3 μL的标记蛋白marker,第三个孔加入15 μL处理好的胰岛素抵抗蛋白样品。上样结束后,将电泳装置与电源连通,起始电压为92 V,待第一个孔中的marker移动至浓缩胶与分离胶的交界处时,将电压上调至153 V,待marker移动至胶板最底部时,立即停止电泳。
1.2.4 考马斯亮蓝染色 转膜实验开始前,考马斯亮兰染色法预染蛋白。小铲子撬开玻璃板,切去多余的分离胶,在染色盘里放入凝胶及染液,放入摇床染色2 h。脱色液脱色2 h,观察是否出现目的蛋白条带,并更换新的脱色液,脱色过夜,观察结果,查看marker对应区域是否有目的条带。
1.2.5 转膜 电泳结束后,取下胶板,去除浓缩胶和标记蛋白之外的分离胶。将大小适宜的PVDF膜放入甲醇中浸泡5 min,按照“三明治”的结构顺序放在转膜架上,加入转膜缓冲液进行冰上转膜,电压6 V,时间83 min。
1.2.6 封闭 转膜后的PVDF膜于5%脱脂奶粉中封闭12 h。
1.2.7 洗膜 封闭后的PVDF膜用PBST清洗2次,每次10 min,第3次用PBS清洗10 min。
1.2.8 孵育一抗 PBS稀释一抗兔抗人PRKCZ抗体,比例为1∶300,稀释β-肌动蛋白抗体比例为1∶5000。把PVDF膜和稀释后的一抗置于摇床上轻轻震荡2 h,洗膜,方法同1.2.7。
1.2.9 孵育二抗 PBS稀释羊抗兔IgG二抗,比例为1∶2000,将PVDF膜放入二抗稀释液中,孵育1 h。结束后拿出,按照1.2.7进行洗膜。
1.2.10 显色成像 避光配置显色液,以可覆盖全膜为标准。滤纸吸除PVDF膜上残留PBS,将PVDF膜放入上述显色液,黑暗处室温反应。将PVDF膜从显色液中取出,用塑料薄膜平整包裹PVDF膜(避免气泡和褶皱产生),OmegaLumG凝胶成像系统拍照记录。所有实验均重复5次。
1.2.11 图像及数据分析 利用ImageJ软件分析PRKCZ和β-actin条带的灰度值,并计算灰度值之比,灰度值之比代表PRKCZ的表达水平。GraphPad 8.0分析正常组和胰岛素抵抗组PRKCZ的相对表达量。
1.2.12 生物信息学分析 通过STRING10.0(http://www.string-db.org/)对PRKCZ与胰岛素信号通路蛋白的相互作用进行分析。
2 结 果
2.1 PRKCZ蛋白表达
胰岛素抵抗组中PRKCZ在翻译水平的表达量较正常组下降,差异有统计学意义(P<0.05)(图1)。
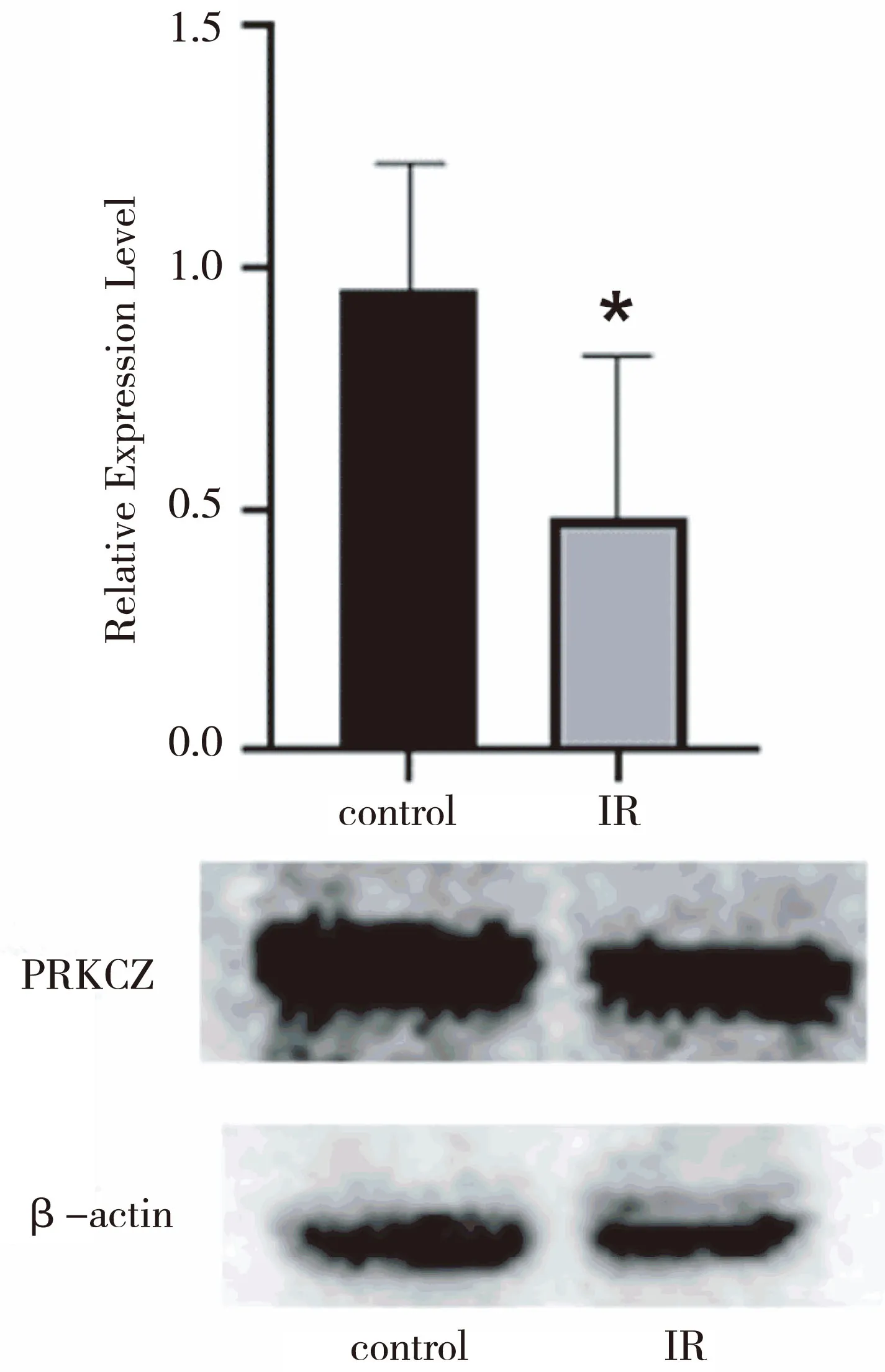
图1 正常和胰岛素抵抗状态下肝细胞中PRKCZ的表达
2.2 生物信息学分析
蛋白质的相互作用如图2所示。PRKCZ在磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)途径和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)级联中发挥作用,参与有丝分裂信号传导、细胞增殖、细胞极性、炎症反应。在脂多糖(lipopolysaccharide,LPS)的作用下或有丝分裂刺激后,PI3K下游信号可激活MAP2K1/MEK1-MAPK1/ERK2,产生信号级联效应。
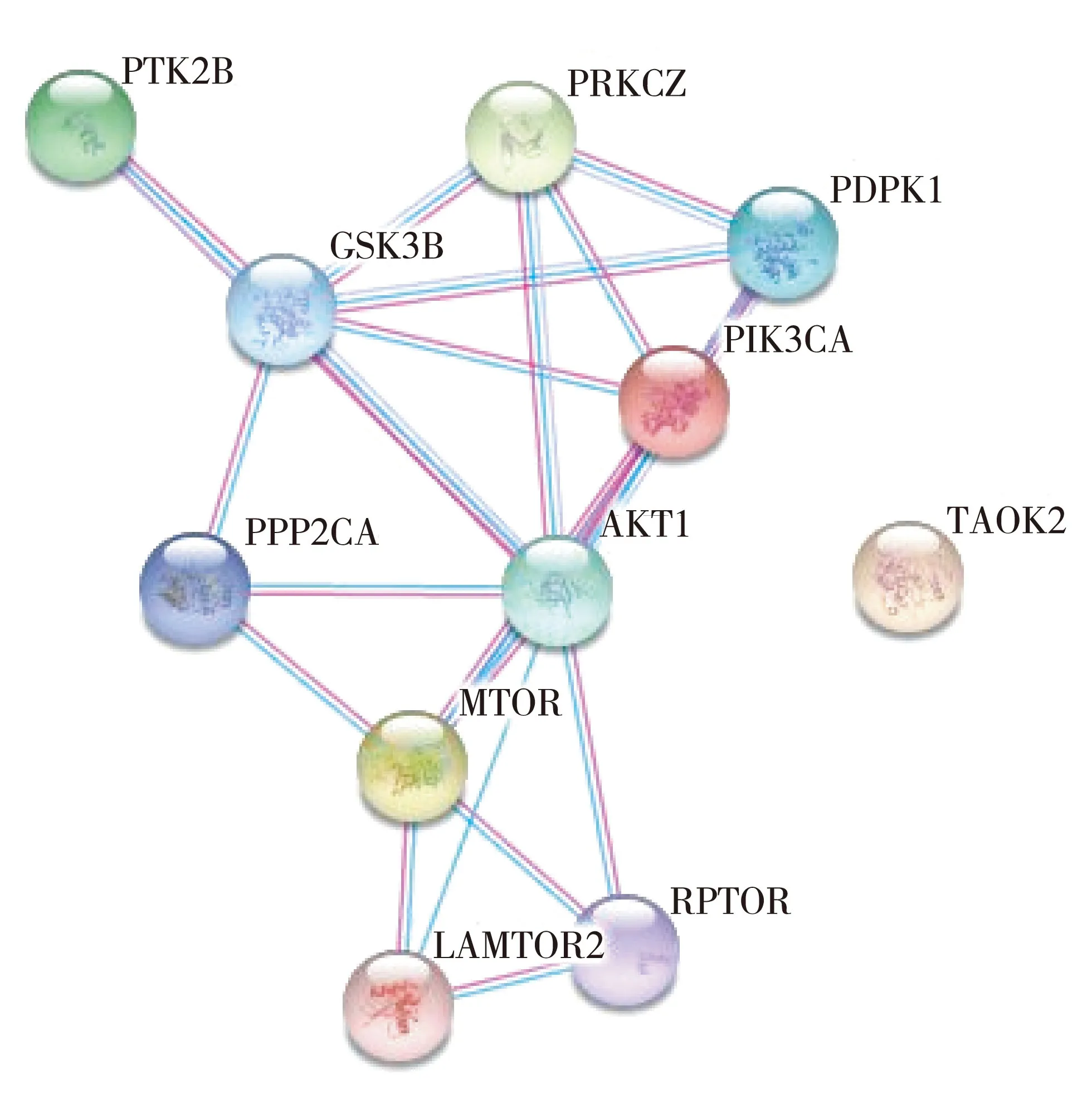
图2 PRKCZ蛋白的相互作用网络图
3 讨 论
胰岛素抵抗是一种病理生理状态[5],导致组织对葡萄糖的利用率下降,机体内葡萄糖含量升高,引起T2DM[6]。PRKCZ属于丝氨酸/苏氨酸蛋白酶家族成员,该家族包含至少10个同工酶[7],这些酶按其生化特性的不同分为传统蛋白激酶C(cPKC)、新型蛋白激酶C(nPKC)、非典型蛋白激酶C(aPKC)三个亚族,PRKCZ属于非典型蛋白激酶C(aPKC),其活性不依赖于钙离子和甘油二酯,对PKC抑制剂不敏感[8]。研究表明PRKCZ参与胰岛素信号传递及T2DM的发病过程,是T2DM的重要致病因素之一[9-10]。
PRKCZ位于胰岛素信号传导途径中磷脂酰肌醇3激酶的下游,参与胰岛素信号传导。胰岛素是控制糖脂代谢的主要激素[11],胰岛素激活胰岛素受体酪氨酸激酶,聚集并磷酸化各种底物蛋白,使底物蛋白暴露出结合位点,与其他信号转导相关蛋白结合[12]。PI3K对胰岛素功能有重要影响,而且主要通过激活蛋白激酶B(Akt/PKB)和PRKCZ级联实现[13]。Akt是胰岛素信号通路的重要组成部分,Akt激活后可通过抑制糖原合成酶3(GSK-3)诱导糖原合成,降低周围组织的血糖浓度[14];Akt还可通过下游信号通路调节细胞的生长和凋亡[15]。此外,糖尿病肾病中内源性沉默信息调节因子1(silent information regulator 1,Sirt1)和Akt表达降低,而FOXO3a表达升高[16],FOXO3a可负反馈调节PI3K/Akt信号通路[17]。胰岛素信号通路中任何信号转导分子对维持胰岛素正常生理功能都有重要作用,任何干扰都可能影响通路的正常运转[18]。当机体受到某种刺激或有炎症发生时,胰岛素受体底物发生丝氨酸磷酸化,抑制胰岛素通路的下游信号传导,影响胰岛素功能,进而导致胰岛素抵抗发生[19-20]。胰岛素抵抗发生时,通路中信号分子的表达异常和相关信号通路相互作用的改变引起机体糖代谢紊乱[1]。有研究显示通过转基因抑制肌肉中PRKCZ的表达可产生与年龄和肥胖相关的葡萄糖耐受,表明PRKCZ对脂肪酸介导的胰岛素抵抗具有保护作用,提示PRKCZ可能参与2型糖尿病的发生[21]。
本研究中,通过蛋白质印迹检测PRKCZ在胰岛素抵抗肝细胞中的表达,结果显示PRKCZ在胰岛素抵抗肝细胞中表达下降,提示PRKCZ与胰岛素抵抗具有相关性。KEGG数据库分析显示,PRKCZ与PDPK1、PIK3CA、Akt1、GSK3B蛋白均存在直接的相互作用,提示蛋白激酶Cζ亚型参与胰岛素信号通路的转导,可能通过PI3K/Akt信号通路影响胰岛素发挥正常生物学作用。深入研究PRKCZ在胰岛素信号通路中的作用,可为T2DM的防治提供理论参考。
