浓香型白酒窖泥中梭菌的分离、鉴定及产丁酸性能的比较研究
2020-01-13田雨思衡小成邹伟叶光斌
田雨思,衡小成,邹伟,2,叶光斌,2*
1(四川轻化工大学 生物工程学院,四川 宜宾,644000) 2(酿酒生物技术及应用四川省重点实验室,四川 宜宾,644000)
浓香型白酒是以窖池与酒醅为基础,半开放式、多菌种协同固态发酵的方式进行生产。窖泥作为白酒酿造中的“微生物黄金”,其质量对白酒品质改善及特质香气的形成具有重要的影响。而窖泥微生物的种类、数量、群落构成及代谢产物的多样性对窖泥质量以及窖泥微生态平衡有直接影响,进而影响浓香型白酒的品质[1]。
窖泥微生物的种类繁多,包括细菌、放线菌、古生菌、霉菌和酵母菌等[2]。近年来的微生物生态学研究表明,窖泥中的细菌多样性丰富,多达34个类。主要分布于14科及2个科级分类地位未知的梭菌纲和拟杆菌纲类群内,并且大多细菌属于严格厌氧细菌[3]。陶勇等[4]利用焦磷酸测序法研究了浓香型白酒不同窖龄窖泥中微生物群落结构与多样性,发现有14个属的优势微生物,其中有5个优势类群属于梭菌纲,分别为Anaerobrancaceae、ClostridiumIV、Sedimentibacter、Ruminococcaceae及Syntrophomonas。胡晓龙等[5]通过高通量测序技术对窖泥微生物多样性进行研究,提出乳杆菌属、梭菌属、瘤胃球菌属及甲烷菌是维持窖泥基本性能的主要微生物,且窖泥质量与窖泥中优势梭菌菌群相对含量之间存在较好的正相关性。梭菌一直被认为是影响浓香型白酒风味物质形成的重要菌体,对己酸、丁酸、己酸乙酯和丁酸乙酯等典型风味物质的形成具有重要作用,典型的有库氏梭菌(C.kluyveri)、酪丁酸梭菌(C.tyrobutyricum)和丁酸梭菌(C.butyricum)等[6-7]。
但是由于梭菌菌群专性厌氧,且没有较为明确的培养基及培养条件导致可培养技术无法完全分离窖泥中的优势梭菌属。此外梭菌属本身是一个异源的分类类群,同属不同种之间的16S rDNA序列相似度在88%~100%之间,造成梭菌属的菌种在系统发育和表型特征上并不一致。目前对窖泥梭菌代谢产物研究主要集中在产己酸菌群的分离筛选[8-11],对其他可培养梭菌代谢产物的研究较少。
本研究以川内不同浓香型白酒酒厂的窖泥开展富集分离,结合16S rDNA序列分析和自动进样-气相色谱-质谱法(SPME-GC-MS)对分离获得的梭菌开展鉴定及产丁酸性能的研究。旨在丰富浓香型白酒梭菌资源,为浓香型白酒的风味物质研究和窖泥老熟、窖泥养护等研究提供菌种资源。
1 材料与方法
1.1 材料与培养基
窖泥样本取自川内不同名优酒厂老窖池,装入厌氧袋后,用冰盒迅速运回实验室,分别于4和-80 ℃冰箱保存。
富集培养基:MES 0.5 g/L,KH2PO40.5 g/L,Na2SO45.0 g/L,NaCl 1.0 g/L,MgCl2·6H2O 0.4 g/L,NaHCO30.3 g/L,NH4NO30.3 g/L,无水CaCO30.15 g/L,酵母粉1.0 g/L,蛋白胨1.5 g/L,葡萄糖0.5 g/L,可溶性淀粉5.0 g/L,乙酸钠3.0 g/L,乳酸钠3 mL/L,半胱氨酸盐酸盐1 g/L,窖泥浸提液20 mL/L,刃天青钠盐(厌氧指示剂)1 mg/L,自然pH,121 ℃灭菌20 min。
强化梭菌培养基(RCM)[12](g/L):蛋白胨10,酵母粉3,葡萄糖5,可溶性淀粉1,乙酸钠3,半胱氨酸盐酸盐0.5,琼脂粉20,自然pH,121 ℃灭菌20 min。
发酵培养基(同RCM液体):添加刃天青钠盐(厌氧指示剂)1 mg/L。
1.2 仪器与设备
AW200SG厌氧工作站,金坛市科技分析仪器有限公司;HW326 恒温水浴锅,上海一恒科技有限公司;BF-2000M 氮吹仪,北京八方世纪科技有限公司;S1000 PCR仪,百乐科技有限公司;JY-600C 电泳仪,北京君意东方电泳设备公司;SC805 凝胶成像仪,上海山富科技仪器有限公司;7890A-5975B 气相色谱-质谱联用仪,安捷伦公司;Allegra 64R 高速冷冻离心机,美国贝克曼库尔特有限公司;DM3000M 显微镜,德国徕卡公司。
1.3 实验方法
1.3.1 窖泥富集与厌氧梭菌的分离
1.3.1.1 窖泥富集
称取10 g窖泥加入装有10 mL无菌水的蓝盖瓶中,80 ℃恒温水浴处理10 min,冷却后以5%的接种量接种到除氧灭菌后的富集培养基中,于35 ℃富集培养1个月。
1.3.1.2 菌株的分离纯化
采用稀释涂布法分离富集液中的厌氧梭菌,将富集液分别稀释至10-1~10-6,吸取10-3~10-6的菌液0.1 mL涂布于RCM平板(已在厌氧工作站除氧24 h),于35 ℃厌氧培养箱培养3~5 d。将具有不同形态特征的菌落进行再次划线纯化,获得单菌落。
1.3.2 菌株的16S rDNA序列的测定与分析
1.3.2.1 DNA的提取
将纯化后不同形态的单菌落接种至除氧后RCM液体培养基中,35 ℃培养5 d,吸取2 mL培养液于无菌离心管中,13 000 r/min离心10 min,弃去上清液,收集菌体沉淀(共2~3次)。菌体沉淀使用细菌基因组DNA快速提取试剂盒并按操作步骤提取基因组DNA。
1.3.2.2 PCR扩增及系统发育树的构建
将1.3.2.1得到的DNA溶液作为扩增模板,采用细菌通用引物27F-1492R[13]进行PCR扩增,50 μL反应体系:5×Buffer(含Mg2+)10 μL,200 μmol/L dNTPs 1 μL,正反向引物各1 μL,Taq DNA聚合酶1 μL,模板DNA 3 μL,加无菌水补足至50 μL。扩增条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30个循环后,72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,PCR产物送至成都擎科伟业生物技术有限公司测序。
测序序列通过BioEdit剪切后,将可靠序列片段上传至NCBI核酸比对网站进行比对,选取序列同源性最高的序列,使用MEGA 6.0软件构建系统发育树。
1.3.3 代谢产物分析
使用无菌水将纯化后的单菌落制成相同浓度的种子液,按5%接种量接种至除氧后50 mL RCM液体培养基中,35 ℃发酵5 d,取发酵液20 mL使用2 mol/L硫酸酸化至pH值为2,加无水乙醇定容至25 mL,12 000 r/min、4 ℃冷冻离心5 min,取上清液,过0.2 μm微孔滤膜[14]。进样前加10 μL乙酸丁酯(84 mg/mL)作为内标混匀。
气相色谱条件:DB-WAX(60 m×250 μm×0.25 μm)色谱柱;载气为高纯度He,流速1 mL/min,进样口温度230 ℃;升温程序:初始温度为60 ℃保持1 min,然后以8 ℃/min的升温速率升至180 ℃保持2 min,再以15 ℃/min升至230 ℃,保持5 min。
质谱(MS)条件:电子离子源(EI),70 eV电子能量,采集模式为全扫描,质量范围20~550 u,离子源温度230 ℃,四级杆温度150 ℃,接口温度230 ℃。
定性分析:质谱图通过与美国Agilent公司提供的美国国家标准技术研究所(national institute of standards and technology,NIST)标准谱库05a.L进行比对,选择匹配度均>80进行定性分析[15]。
半定量分析:以乙酸丁酯作为内标,测定样品中酸类、酯类、醇类及芳香类化合物的峰面积与乙酸丁酯峰面积之比,再根据乙酸丁酯的质量浓度来进一步计算其含量[16]。
2 结果与分析
2.1 窖泥中厌氧梭菌的分离
通过菌落形态、显微形态差异并结合生理生化特性研究,筛选获得23株厌氧梭菌,后续对其进行分子鉴定。
2.2 菌株16S rDNA序列分析
对分离获得的23株菌进行基因组DNA的提取和16S rDNA序列的扩增。将测定细菌的16S rDNA序列提交NCBI进行比对分析并下载参比序列构建系统发育树(图1),共有23株与Gen Bank中5种梭菌相关。
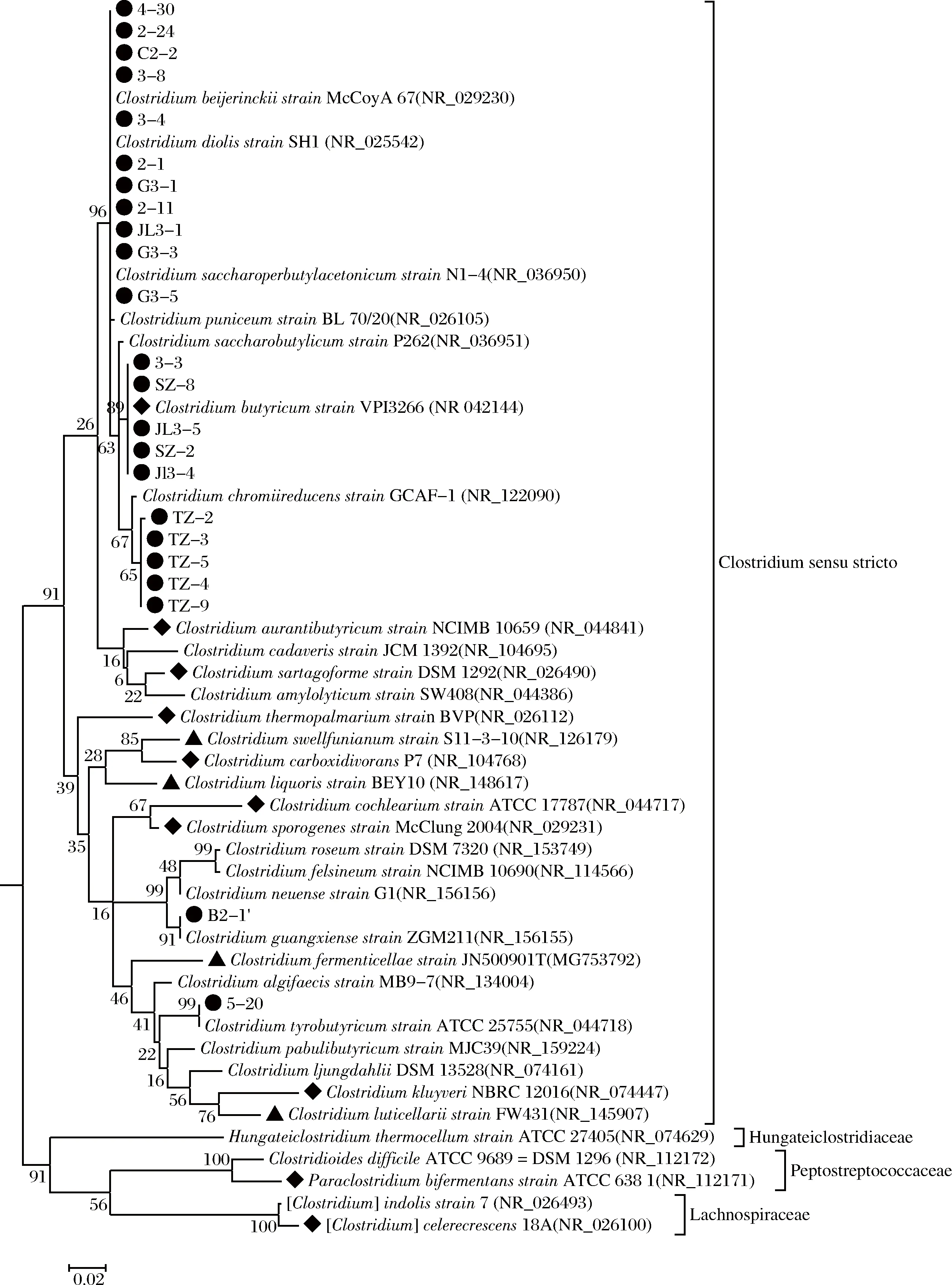
●-本次研究分离获得的菌株;▲-近年来在IJSEM,Antonie Van Leeuwenhoek等杂志发表的窖泥来源的梭菌属新种[17-20];◆-郑州轻工业大学等[21]报道的窖泥梭菌,其中Paraclostridium bifermentans ATCC 6381和[Clostridium] celerecrescens 18A不属于严格意义上的梭菌属微生物图1 窖泥中梭菌的16S rDNA序列系统发育树Fig.1 Phylogenetic tree of Clostridium spp.from pit mud based on the 16S rDNA sequences
由图1系统发育树可以看出,5株代表菌株(2-1、3-3、TZ-2、B2-1′、5-20)分属于拜氏梭菌(Clostridiumbeijerinckii)菌群、还原铬梭菌(C.cochlearium)、丁酸梭菌(C.butyricum)、酪丁酸梭菌(C.tyrobutyricum)、广西梭菌(C.guangxiense),其中C.cochlearium和C.guangxiense是首次在窖泥中获得分离,在一定程度上丰富了窖泥中梭菌物种的多样性。
此外,从图1系统发育树可以看出菌株2-1等11个梭菌菌株无法鉴定到种,它们与拜氏梭菌菌群的6个近似属种(拜氏梭菌(C.beijerinckii)、C.diolis、C.saccharobutylicum、C.chromiireducens、C.puniceum、C.saccharoperbutylacetonicum)具有高于97%的相似度。表2为DNAMAN软件对以上6个近似梭菌16S rDNA序列相似度的交叉分析表。由表1可知:C.beijerinckii与其他近似梭菌C.diolis、C.saccharobutylicum、C.chromiireducens、C.puniceum、C.saccharoperbutylacetonicum的16S rDNA序列相似度分别为97.7%、98.5%、97.9%、97.7%、98.0%,且表1中6种不同梭菌的交叉相似度均超过97%,现有的16S rDNA测序结果和系统发育树分析难以将他们鉴定到种。由于现有的高通量测序技术已经广泛应用于浓香型白酒窖泥、糟醅等样本的研究,其OTU分类是基于16S rDNA序列相似度,即相似度低于97%界定为不同OTU。因此对于16S rDNA序列相似度高于97%的近似属种的高通量数据开展分析时,无疑会低估窖泥梭菌类群的生物多样性。
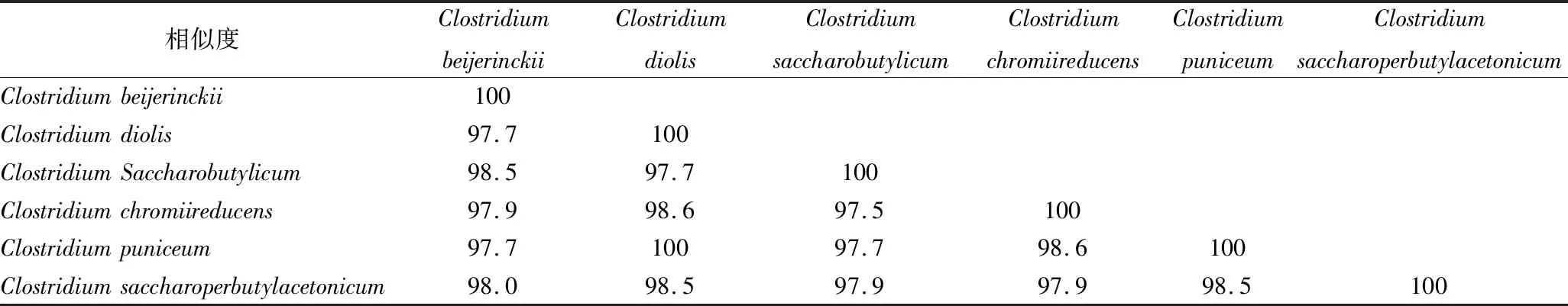
表1 不同梭菌属序列相似度交叉分析表 单位:%Table 1 Cross-analysis of sequence similarity of Clostridium
注:Clostridiumbeijerinckii菌株代表NCBI登录号为NR.029230,Clostridiumdiolis菌株代表NCBI登录号为NR.025542,Clostridiumsaccharobutylicum菌株代表NCBI登录号为NR.122061,Clostridiumchromiireducens菌株代表NCBI登录号为NR.122090,Clostridiumpuniceum菌株代表NCBI登录号为NR.026105,Clostridiumsaccharoperbutylacetonicum菌株代表NCBI登录号为NR.036950。
此外,梭菌作为一类重要的窖泥功能微生物,目前还未见学者对窖泥内梭菌类群的分布情况开展研究。图1的系统发育树展示了近年来纯培养分离获得的窖泥来源梭菌属种的分布信息。可以看出,目前来源于窖泥的可培养梭菌微生物主要分布在梭菌属cluster I(Clostridiumcluster I)即严格意义的梭菌属(Clostridiumsensu stricto)类群的16个属种和菌群组合内,包括拜氏梭菌菌群(C.beijerinckiigroup)、丁酸梭菌(C.butyricum)、还原铬梭菌(C.cochlearium)、C.aurantibutyricum、C.sartagoforme、C.thermopalmarium、窖泥梭菌(C.swellfunianum)、C.carboxidivorans、白酒梭菌(C.liquoris)、C.cochlearium、C.sporogenes、广西梭菌(C.guangxiense)、老窖梭菌(C.fermenticellae)、酪丁酸梭菌(C.tyrobutyricum)、库氏梭菌(C.kluyveri)、C.luticellarii。
2.3 菌株代谢产物分析
根据1.3.3方法对筛选梭菌风味物质进行分析,并与空白培养基相比较,结果见表2。
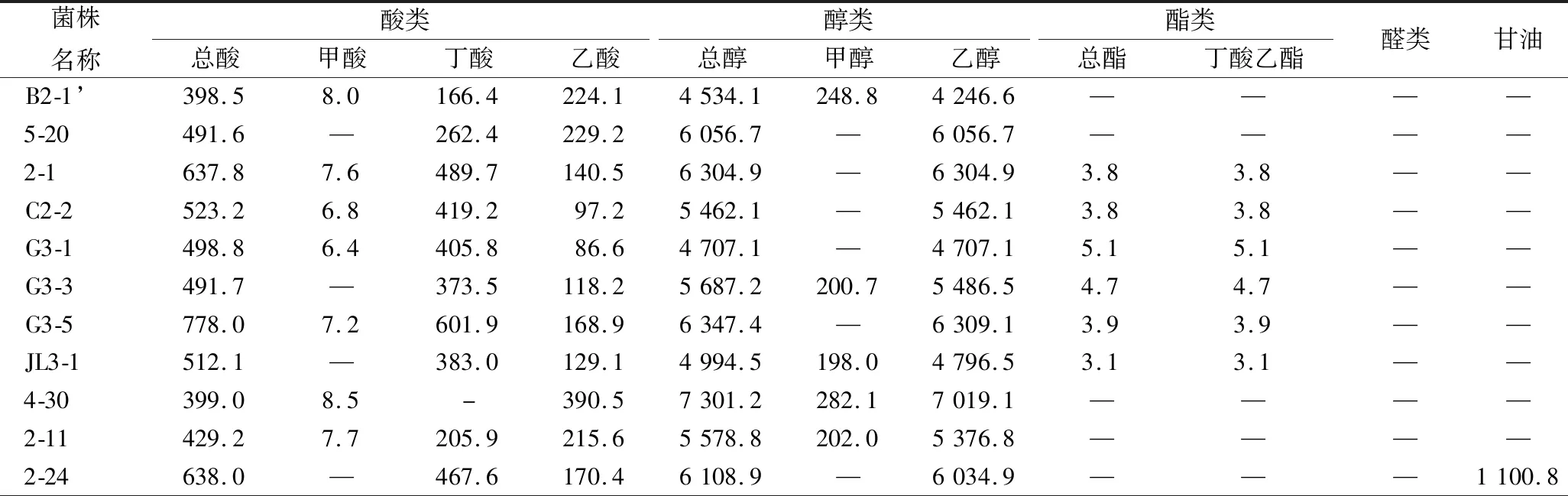
表2 分离菌株代谢产物分析结果 单位:mg/(100 mL)Table 2 Analysis results of metabolic products of isolated strains
续表2

菌株名称酸类醇类酯类总酸甲酸丁酸乙酸总醇甲醇乙醇总酯丁酸乙酯醛类甘油3-4480.9—367.0113.94454.8—4454.8—3.0——JL3-4420.6—178.9241.76012.7192.65820.1————JL3-5953.019.1402.2531.78253.2—8142.9——108.526.23-3518.38.3228.7281.36645.7198.26447.5————TZ-2830.313.8381.0435.57290.2—7236.4————TZ-3676.212.6285.6378.06743.4—6743.4————TZ-4688.58.8306.3372.47195.1—7195.1————TZ-5644.97.7297.7339.56035.0—6035.0————TZ-91237.921.5576.8639.67822.7—7822.7——64.7—SZ-2319.6—149.6170.04260.0—4260.0194.0———SZ-8145.2——145.24201.2171.24030.0————3-8882.2—680.6201.66181.0—6181.05.15.1——空白————3015.6—3015.6————
注:本次研究以未接种的空白培养为对照,采用相同的处理方法处理样本,并进行GC-MS分析,未对空白接种进行数据扣除。由于接种样本的乙醇含量均高于空白样本检测值,表明接种样本均能够产乙醇;“—”表示未检测出来。
由表2可知,23株梭菌的主要代谢物包括酸类、醇类、酯类及一些其他化合物,主要风味物质为丁酸等。其中菌株G3-5与3-8丁酸产量最高,分别可达601.9和680.6 mg/100 mL;TZ-9丁酸产量次之,约为576.8 mg/100 mL;丁酸产量在300~500 mg/100 mL的菌株从高到底依次为2-1、2-24、G3-1、G3-3、JL3-5、JL3-1、TZ-2、3-4、TZ-4;丁酸产量在300 mg/100 mL以下的菌株分别为TZ-5、TZ-3、5-20、3-3、2-11、JL3-4、B2-1′、SZ-2、SZ-8、4-30,其中SZ-8与4-30较为特殊,不产丁酸。结合16S rDNA鉴定结果,表明2-1、C2-2、G3-1、G3-3、G3-5、JL3-1、4-30、2-11、2-24与3-4同属于拜氏梭菌菌群,但其发酵代谢产物丁酸的产量却存在明显的差异。除此之外,B2-1′、G3-3、JL3-1、4-30、2-11、JL3-4、3-3代谢产物中含有较高的甲醇,4-30产量最高,可达282.1 mg/100 mL。2-1、C2-2、G3-1、G3-3、G3-5、JL3-1、3-4、3-8同属拜氏梭菌菌群,发酵能够产生一定量的丁酸乙酯。
3 结论
本研究采用传统分离方法从浓香型白酒窖泥中分离得到23株厌氧梭菌,分别与5类梭菌—拜氏梭菌菌群、丁酸梭菌、还原铬梭菌、酪丁酸梭菌、广西梭菌具有较高的同源性,其中首次报道了广西梭菌和还原铬梭菌在窖泥中的存在。通过对不同梭菌菌株的代谢产物的分析,检测到包括酸类、醇类、酯类等16类化合物,且主要代谢产物为丁酸。不同梭菌菌株在产丁酸能力上具有显著差异。其中,菌株TZ-9综合产酸能力最强,菌株3-8产丁酸能力最强。通过对窖泥中厌氧梭菌的分离鉴定及代谢产物分析,能够初探窖泥优势梭菌菌株的组成,为后续其在白酒酿造过程中的功能性研究提供菌种资源。
