液相色谱-串联质谱法同时测定饲用血液制品中18种β-受体激动剂
2020-01-13索德成魏书林肖志明王培龙王瑞国李阳
索德成,魏书林,肖志明,王培龙,王瑞国,李阳
液相色谱-串联质谱法同时测定饲用血液制品中18种β-受体激动剂
索德成,魏书林,肖志明,王培龙,王瑞国,李阳
(中国农业科学院农业质量标准与检测技术研究所,北京 100081)
【背景】饲用血液制品是一种非常规动物源性饲料原料,由家畜或家禽的血液凝成块后经高温蒸煮,压除汁液、晾晒、烘干后粉碎而成,主要用于畜牧养殖。但由于动物养殖过程中存在非法使用β-受体激动剂的现象,一些含有β-受体激动剂的血液制成饲用血液制品可能成为对人类健康潜在的危害源头。为了降低安全风险,研究饲用血液制品中β-受体激动剂的方法是十分必要的。β-受体激动剂检测方法主要有酶联免疫吸附分析(ELISA)法、高效液相色谱(HPLC)法、气质联用(GC-MS)法和液相色谱串联质谱(LC-MS/MS)法等。目前所有方法或标准大多针对商业成品饲料或动物源性食品,缺乏对饲用血液制品中β-受体激动剂的检测技术进行相关的研究。【目的】为了研究和监控饲用血液制品中β-受体激动剂的情况,研究建立了固相萃取结合液相色谱-串联质谱检测饲用血液制品中18种β-受体激动剂的方法。【方法】称取2 g(精确至0.01 g)血液制品样品于50 mL离心管中,准确加入20 mL乙酸铵提取液(pH=5.2)和50 μLβ-葡萄糖苷酸酶/芳基硫酸酯酶,漩涡混合均匀,于37 ℃水解过夜(应大于16h),然后8 000 r/min离心5 min,取5 mL上清液转移至另一离心管中,加入0.5mL 高氯酸溶液,漩涡混合30 s, 然后于8 000r/min离心5min,上清液备用。PCX固相萃取小柱依次用3 mL甲醇,3 mL水活化。取上清液过柱,用3 mL水和3 mL甲醇淋洗,抽干,用3 mL氨水甲醇溶液洗脱,洗脱液于50 ℃氮气吹至近干,用1.0 mL 0.1%甲酸水+乙腈溶液(95+5)溶解,过0.22 μm滤膜。进Waters TQ液相色谱串联质谱仪检测,使用ACQUITY UPLC BEH C18(100 mm,2.1 mm,1.7μm) 色谱柱。乙腈和0.1%甲酸溶液做流动相,梯度洗脱。质谱电离方式采用电子喷雾离子源,正离子检测方式,多反应监测(HRM)。喷雾电压为3.5 kV;雾化气温度为480℃;源温度为150℃;雾化气流速为600L·h-1;锥孔气流速为5 L·h-1。脱溶剂气、锥孔气、碰撞气均为高纯氮气。【结果】18种β-受体激动剂在5—100μg·L-1呈良好的线性关系,相关系数在0.99—0.999之间。在血粉、血浆蛋白粉、血球蛋白粉三种基质中在5、10 和50 μg·kg-1三个添加水平上的平均回收率为65.1%—110%之间,相对标准偏差小于15%,批间变异系数小于20%。检出限为低于5ng·g-1。【结论】从方法回收率、精密度结果及实际样品的检测结果来看,该方法适用于血液制品中β-受体激动剂的监测。
β-受体激动剂;液相色谱-串联质谱;饲用血液制品
0 引言
【研究意义】β-受体激动剂(β-agonists)俗称“瘦肉精”,是苯乙胺类药物。在医学主要用于扩张支气管和增加肺通气量,治疗支气管哮喘。β-受体激动剂能显著提高动物酮体瘦肉率、增重和提高饲料转化率。因此,β-受体激动剂被非法使用于畜牧生产,以促进家畜生长和改善肉质[1-4]。导致了动物性食品中药物残留严重超标,消费者食用这类食品后会产生严重的毒副作用,至今已发生了多起“瘦肉精”集体中毒事件[5-8]。为此,中国和欧盟禁止β-受体激动剂在动物养殖中使用[8-11]。饲用血液制品是一种非常规动物源性饲料原料,由家畜或家禽的血液凝成块后经高温蒸煮,压除汁液、晾晒、烘干后粉碎而成,其主要类型有血粉、血浆蛋白粉、血球蛋白粉等[12]。其在畜禽及水产养殖过程中大量应用[13-15]。由于血液制品的加工原料来源自于动物血液,如果在生产过程中使用了含有β-受体激动剂的动物血液,常规加工无法将残留于血液中的β-受体激动剂去除,会使β-受体激动剂在饲用血液制品中残留,进而影响饲料质量和畜产品安全。因此,为了评价饲用血液制品中含有β-受体激动剂风险,建立饲用血液制品中β-受体激动剂的检测方法是十分必要的。【前人研究进展】目前国际上β-受体激动剂检测方法主要有酶联免疫吸附分析(ELISA)法、高效液相色谱(HPLC)法、气质联用(GC/MS)法和液相色谱串联质谱(LC-MS/MS)法[16-28],BUCKNALL 等建立了竞争ELISA 检测法用于检测牛肝中的克伦特罗残留,检测限达到0.5 ng·g-1[16]。KOOLE 等应用免疫亲和净化,建立了高效液相色谱检测尿液中5种β-受体激动剂的方法,检测限达到ng·mL-1水平[20]。LIU等研究建立GC-MS检测牛组织中β-受体激动剂的方法,应用N-甲基-N-(三甲基硅烷)三氟乙酰胺进行衍生, 检测限达到5 ng·g-1 [22]。ELISA为目前主流的筛选方法。但是无法对样品中β-激动剂含量进行定量确证;液相色谱法对样品基质要求较高,检测限较高,无法满足监测要求;气相色谱串联质谱联用仪测定β-激动剂需要衍生,样品重复性差。近年应用LC-MS/MS进行β-激动剂多残留检测的研究日趋增多[25-28]。【本研究切入点】现有方法或标准大多针对商业成品饲料或动物源性食品,目前尚无饲用血液制品中β-受体激动剂的检测技术,这在一定程度上加大了饲料企业使用血液制品的风险,也限制了政府部门对β-受体激动剂的有效监管,因此,亟需饲用血液制品中β-受体激动剂的检测方法。【拟解决的关键问题】针对血液制品成分复杂、蛋白质和脂肪含量高的问题,通过摸索液相质谱条件的优化、提取、净化方法,建立了一种准确、灵敏测定饲用血液制品中18种β-受体激动剂含量的LC-MS/ MS方法。为饲用血液制品的风险评价和政府监管提供必要的技术支撑。
1 材料与方法
试验于2014年6—10月在中国农业科学院农业质量标准与检测技术研究所实验室完成。
1.1 仪器与试剂
Acquity 超高效液相色谱带有TQ三重四极杆质谱仪(美国Waters 公司);PCX混合型阳离子交换柱(美国Agilent公司)。MS2 漩涡混合器(德国IKA 公司);Centrifuge 5810 离心机(德国Eppendorf 公司);固相萃取装置(美国Supelco 公司)。
除非另有说明,所用试剂均为分析纯,购自于北京化学试剂公司。流动相所用试剂甲酸,乙腈、甲醇均为色谱纯(Fisher ChenAlert Guide 公司);实验用水为Mili-Q纯化后的超纯水(>18 MΩ)。克仑特罗、沙丁胺醇、莱克多巴胺、齐帕特罗、氯丙那林、特布他林、西马特罗、西布特罗、马布特罗、溴布特罗、班布特罗、克仑普罗、妥布特罗、利托君、沙美特罗、克伦塞罗、福莫特罗和苯乙醇胺A对照品分别购自于德国Dr. Ehrenstorfer 公司、美国Sigma公司等:纯度≥97%。饲用血液制品(血粉、血浆蛋白粉、血球蛋白粉)样品从配合饲料生产工厂的原料库采集,其来源于中国、美国、新西兰等地。阳性血液制品样品的血液来源于公益性行业(农业)科研专项项目(No. 201203088)的动物试验[30],参照血液制品的生产工艺制备成血粉,并塑封保存于0—4℃的冰箱中。
1.2 溶液配制
β-受体激动剂贮备液:分别精密称取各种β-受体激动剂对照品至棕色容量瓶中,用甲醇配成浓度约为1mg·mL-1的标准贮备液,2℃—8℃冷藏保存,有效期十二个月。
β-受体激动剂标准工作液:分别精密吸取各种β-受体激动剂贮备液,用初始流动相稀释成浓度为1μg·mL-1的标准工作液。2℃—8℃冷藏保存,有效期一个月。
1.3 样品处理
称取2 g(精确至0.01 g)样品于50 mL离心管中,准确加入20 mL乙酸铵提取液(pH=5.2)和50 μLβ-葡萄糖苷酸酶/芳基硫酸酯酶,漩涡混合均匀,于37 ℃水解过夜(应大于16 h),然后8 000 r/min离心5 min,取5 mL上清液转移至另一离心管中,加入0.5 mL 高氯酸溶液,漩涡混合30 s, 然后于8 000r/min离心5 min,上清液备用。
PCX固相萃取小柱依次用3 mL甲醇,3 mL水活化。取上清液过柱,用3 mL水和3 mL甲醇淋洗,抽干,用氨水甲醇溶液3 mL洗脱,洗脱液于50 ℃氮气吹至近干,用1.0 mL初始流动相溶解,过0.22 μm滤膜。供液相色谱-串联质谱测定。
同时选取待测样品类型相同的空白血液制品(血粉、血球蛋白粉、血浆蛋白粉)样品,按上述步骤处理,在净化、吹干后的残渣中,分别添加适量的混合标准工作溶液,配置成不同浓度(1—100μg·L-1)的基质添加标准曲线,进行基质加标定量。
1.4 色谱质谱条件
色谱柱:ACQUITY UPLC BEH C18(100 mm, 2.1 mm,1.7μm)柱温:30℃;进样量:10 μL。流动相及参考梯度洗脱程序见表1。

表1 流动相及参考梯度洗脱程序
质谱采用电子喷雾离子源,正离子检测方式,多反应监测(HRM)。喷雾电压为3.5 kV;雾化气温度为480℃;源温度为150℃;雾化气流速为600L·h-1;锥孔气流速为5 L·h-1。脱溶剂气、锥孔气、碰撞气均为高纯氮气,使用前应调节各气体流量以使质谱灵敏度达到检测要求。定性离子对、定量离子对及对应的锥孔电压和碰撞能量见表2。

表2 β-受体激动剂的定性、定量离子对及锥孔电压、碰撞电压的参考值
2 结果
2.1 不同提取方式对血粉样品提取效率研究
本研究比较了4种方法对血粉阳性样品的检测:1.酶解(EME):取1g阳性样品,加入5mL的乙酸铵缓冲液(pH 6. 8),并加入50 μLβ-盐酸葡萄糖醛苷酶/芳基硫酸酯酶,于37℃温育过夜。2. 有机溶剂加酸提取(MSE):取1g阳性样品,加入5mL0.1mol·L-1盐酸溶液+甲醇溶液提取。3. 高氯酸水解(ACE):取1g阳性样品,加5mL0.2 mol·L-1高氯酸溶液,摇匀,于60℃水解4h。4.碱水解(ALE):取1g阳性样品,加入5mL 0.1mol·L-1氢氧化钠溶液,摇匀,于60℃水解4h。
结果见图1,不同处理方法对各种血液制品的不同激动剂检测结果有所差距。对于血液制品来说,有机溶剂提取克伦特罗和苯乙醇胺A效果较好,但是对莱克多巴胺和沙丁胺醇的提取效果很差;高氯酸水解和碱水解能提取出大部分原型药物,但是提取效率相比酶解较低,酶解对4种常见激动剂提取效果最好,同时酶解后测得的莱克多巴胺和沙丁胺醇的含量要明显高于其他提取方法。
2.2 线性与检出限(LOD)、定量限(LOQ)
以每种β-受体激动剂标准溶液浓度为横坐标,β-受体激动剂的色谱峰面积比为纵坐标绘制标准曲线,试验表明18种β-受体激动剂在5—100μg·L-1呈良好的线性关系,相关系数在0.99—0.999之间。在本试验条件下,根据3倍噪音的峰响应值,确定检出限。根据回收率和精密度结果确定定量限。线性、检出限和定量限的结果见表3。
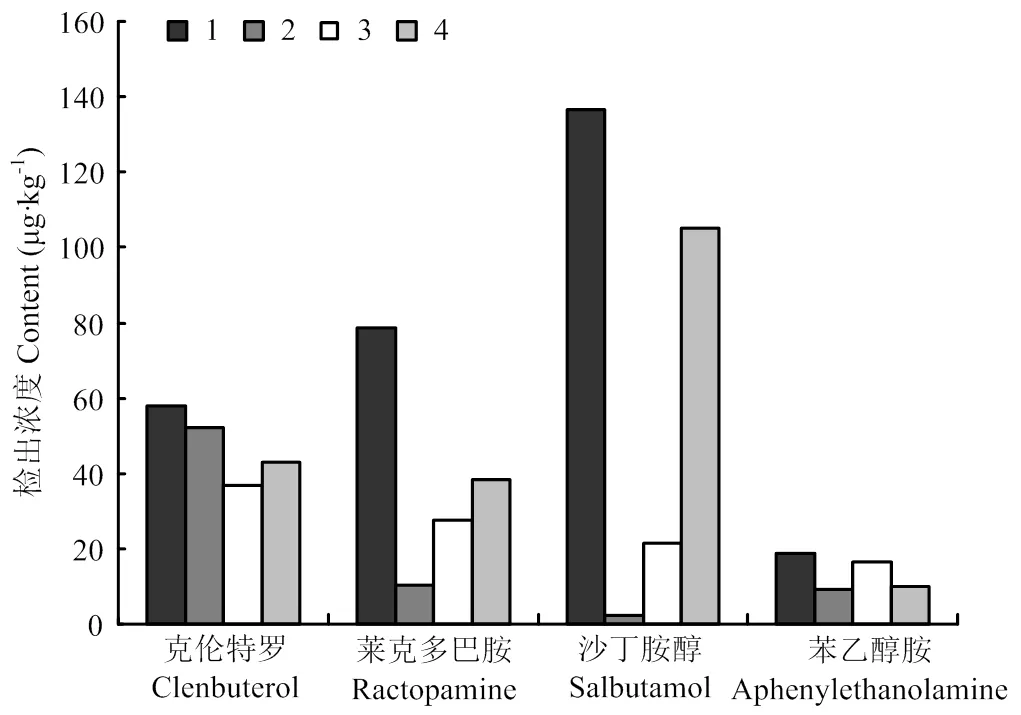
图1 不同提取方法对实际血液制品中4种受体激动剂的结果
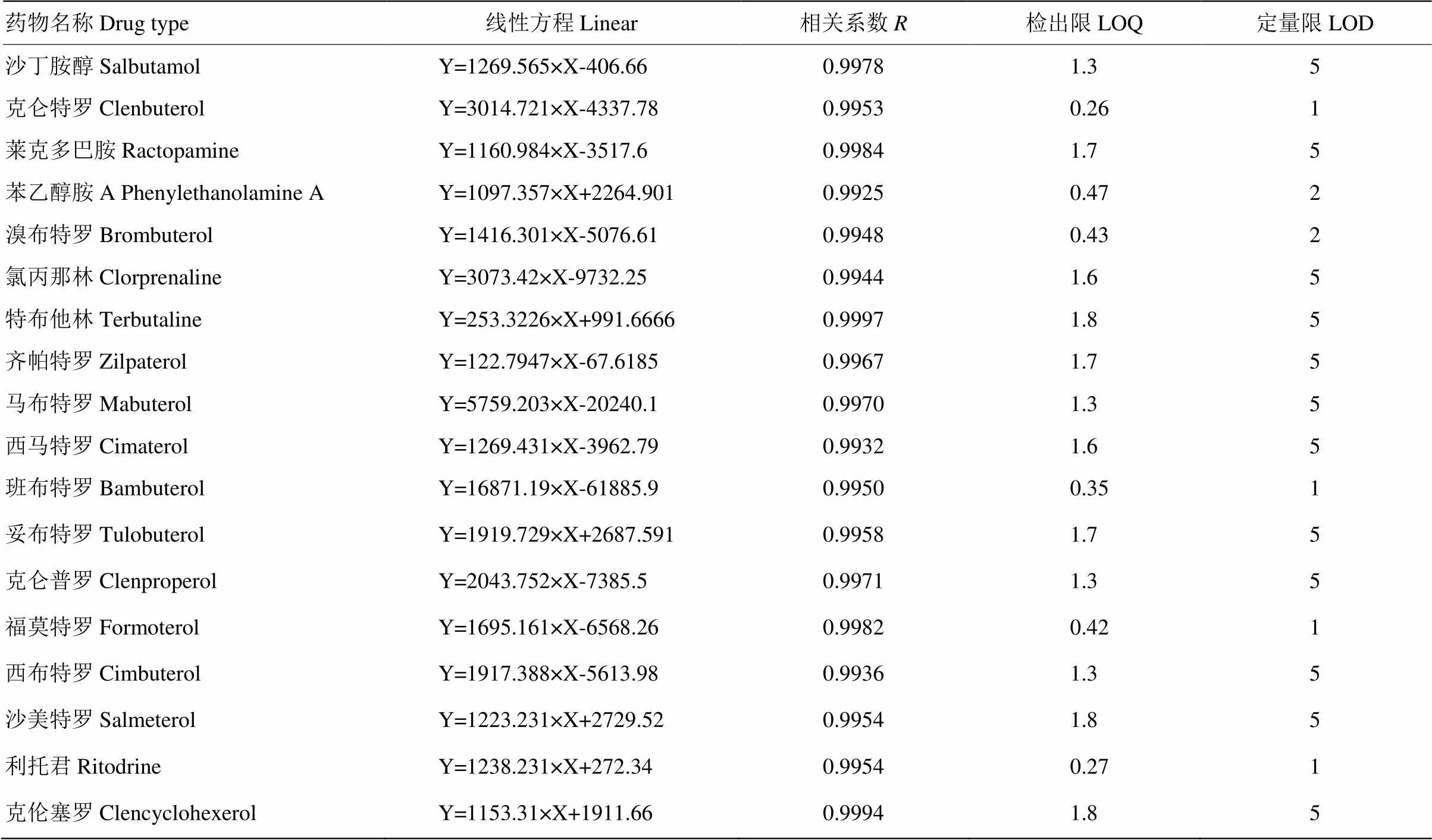
表3 β-受体激动剂标准溶液线性、LOQ,㎏LOD
2.3 回收率与精密度
我们选取3种饲用血液制品样品作为测试对象,进行加标回收率试验,以考察方法的准确度和现性。配制5、10和50μg·kg-1等3个浓度的试样,每批次内同一浓度做6次平行试验。批间重复3次。结果见表4。由表看出,方法回收率达到65.6 %—110 %之间,相对标准偏差均<15%,批间变异系数小于20%。说明该方法对不同样品中β-受体激动剂的测定均有较好的回收率和准确度。

表4 饲用血液制品回收率与精密度实验结果(n=6)

续表4 Continued table 4
3 讨论
3.1 流动相的选择
基于β-受体激动剂类药物都具有较强的水溶性,首先选择以甲醇和水作为基本流动相条件,但在质谱分析时发现有些组分的检测灵敏度较差。为了提高电离效率,优化灵敏度参数,笔者使用0.1%甲酸水溶液和乙腈代替纯水和甲醇体系。同时在流动相条件中设置梯度条件可有效分离β-受体激动剂。避免样品中的基质干扰,使得定性和定量更加准确。
3.2 监测离子对的选择
采用100 ng·L-1β-受体激动剂化合物的标准溶液分别以流动注射的方式在正离子模式下进行母离子全扫描,确定标准物的分子离子,然后分别以其分子离子为母离子,进行二级离子全扫描,选取丰度较强、干扰较小的子离子为定性及定量离子,具体参数见表2。典型的分离色谱图见图2。

1:齐帕特罗、2:沙丁胺醇、3:特布他林、4:西马特罗、5:西布特罗、6:利托君、7:克仑塞罗、8:莱克多巴胺、9:克仑普罗、10:氯丙那林、11:福莫特罗、12:妥布特罗、13:克仑特罗、14:溴布特罗、15:班布特罗、16: 马布特罗、17:苯乙醇胺A、18:沙美特罗
3.3 样品前处理方法的确定
3.3.1 提取液及提取方式的选择 β-受体激动剂经过在动物体内吸收、代谢的一系列生化反应,大部分β-受体激动剂能生成葡萄糖苷酸或硫酸等轭合代谢物[1],因此,血液制品中β-受体激动剂的残留主要以轭合物存在,因此在测定血液制品中β-受体激动剂前,首先要将轭合型β-受体激动剂解离。李阳等研究了酶解及有机溶剂提取对绵羊血浆中莱克多巴胺和沙丁胺醇含量测定的影响,结果表明,绵羊血浆中莱克多巴胺轭合率大于95%,沙丁胺醇轭合率约为40%,使用β葡萄糖醛苷/芳基硫酸酯酶可有效解离血浆中轭合的莱克多巴胺和沙丁胺醇[25]。强致懿等在65 ℃条件下用20µL葡萄糖苷酶酶解莱克多巴胺,发现酶解之后血液中莱克多巴胺含量要比酶解前高出1.5—2.5倍[29]。虽然目前还没有关于其他受体激动剂在动物血液内的存在形式的报道,但是结合β-受体激动剂在其他组织的代谢规律和对阳性血粉样品结果(图 1)可以认为:酶解能有效地将轭合态β-受体激动剂解离,而且酶解的特异性较高,酶形成的杂质较少,更有利于目标物的浓缩和净化[26-27]。因此,本试验选择用β葡萄糖醛苷/芳基硫酸酯酶来酶解样品中β-受体激动剂轭合代谢物。
由于血粉样品含有大量水溶性血红蛋白,经过酶解后样品提取液残存大量的蛋白质,对下一步SPE净化有很大的影响,需采取手段沉淀蛋白。我们比较了乙酸铅溶液和高氯酸溶液沉淀蛋白质效果,表明高氯酸溶液效果较好,净化效果见图3。同时比较加入0.5 mL 5%、10%、30%、50%的高氯酸溶液对沉淀蛋白质效果和回收率的影响,综合考虑,0.5 mL 30%高氯酸溶液效果最好。

图3 高氯酸溶液处理前后对比图
3.3.2 净化 目前常用的β-受体激动剂样品净化主要有两种方式,液液萃取和固相萃取。本试验选取了液液萃取,弱阳离子交换柱、C18柱,混合型阳离子交换柱进行比较。结果表明混合型阳离子交换柱净化效果较好,并且对实际样品的回收率较好,综合回收率和对空白样品和添加样品的净化效果,最终选取混合型阳离子交换柱对样品进行分离富集。同时,本研究中比较各种商品化了的混合型阳离子交换柱(包括Agilent Bond Elut Plexa PCX,Agela PCX 2, Oasis MCX柱)的净化效果,结果表明都对β-受体激动剂净化有非常好的效果。
3.4 基质效应
基质效应是LC-MS/MS 检测的最常见的问题。不同血液制品样品的组成比较复杂,其中含有大量的的蛋白质、脂肪和盐等干扰物,会对检测方法的灵敏度和准确性造成一定的影响,进而影响试验的检测结果。不同的基质效应对检测方法的灵敏度造成的影响也不同,为了降低基质效应对定量准确度的影响。本研究采用基质添加标准曲线来定量以弥补离子抑制造成的损失。
3.5 实际样品检测
应用建立的方法,对50份随机收集饲用血液制品样品进行测定,5份样品检出β-受体激动剂类药物残留,其他未检出β-受体激动剂类药物残留。阳性样品中1份检出西马特罗、含量为234 ng·g-1。4份检出莱克多巴胺,含量为 35—432ng·g-1之间。莱克多巴胺的检出血粉主要集中于美国进口的产品中,可能与美国允许使用莱克多巴胺作为饲料添加剂有关。
4 结论
本研究建立了基于酶解法对饲用血液制品中β-受体激动剂残留的提取,采用PCX固相萃取柱浓缩净化,UPLC-MS/MS法同时检测饲用血液制品中18种β-受体激动剂,方法回收率和精密度符合痕量分析的要求,操作简便、分析效率高,可用于相关样品的日常检测及残留监控。
[1] 李俊锁, 邱月明, 王超. 兽药残留分析. 上海: 上海科技出版社,. 2002, 641-648.
LI J S, QIU Y M, WANG C.. Shanghai: Shanghai Scientific & Technical Publishers, 2002, 641-644. (in Chinese)
[2] HANRAHAN J P.. New York, Elsevier, 1987.
[3] LÓPEZ-CARLOS M A, RAMÍREZ R G, AGUILERA-SOTO J I, ARÉCHIGA C F, MÉNDEZ-LLORENTE F, RODRÍGUEZ H, SILVA J M. Effect of ractopamine hydrochloride and zilpaterol hydrochloride on growth, diet digestibility, intake and carcass characteristics of feedlot lambs., 2010, 31: 23-30.
[4] MERSMANN H J. Overview of the effects of beta-adrenergic receptor agonists on animal growth including mechanisms of action.1998 ,76 :160-172.
[5] MITCHELL G A, DUNNAVAN G.Illegal use of beta-adrenergic agonists in the United States.1998,76(1): 208-211.
[6] KUIPER, H A, NOORDAM M Y, DOOREN-FILPSEN M M. Illegal use of beta-adrenergic agonists: European community.1998, 76:195-207.
[7] GIANFRANCO B, TELEMACO C, FLAVIA F, ROBERTA G, AGOSTINO M, FRANCESCO R, MARCO S, ALBERTO L. Clinical and pharmacological profile in a clenbuterol epidemic poisoning of contaminated beef meat in Italy.,2000, 114:47-53.
[8] MARTINEZ NAVAARI J E, Food poisoning related to consumption of illicit β-agonist in liver.1990, 336:1311-1315.
[9] Commission decision 1996/23/EC. (1996). Official Journal of European Communication L125, 10.
[10] 中华人民共和国农业部农业部公告第176号. 禁止在饲料和动物饮水中使用的药物品种目录.
Announcement of the Ministry of Agriculture of the People's Republic of China No. 176 Catalogue of Prohibited drugs in feed and animal drinking water. (in Chinese)
[11] 中华人民共和国农业部农业部公告第1519号. 禁止在饲料和动物饮水中使用的物质.
Announcement of the Ministry of Agriculture of the People's Republic of China No. 1519 Prohibited Substances in feed and animal drinking water. (in Chinese)
[12] 中华人民共和国农业部公告第1773号饲料原料目录
Announcement of the Ministry of Agriculture of the People's Republic of China No. 1773 Catalogue of Feed Raw Materials. (in Chinese)
[13] 朱森阳, 汪国和, 王志鹏. 畜禽血液资源的开发利用进展. 养殖与饲料, 2007, (1): 67-69.
ZHU S Y,WANG G H, WANG Z P. Development and Utilization of Livestock and Poultry Blood Resources, Animals Breeding and Feed, 2007, (1): 67-69. (in Chinese)
[14] 汪国和, 张日俊. 血粉高蛋白饲料的开发和应用. 饲料工业, 2004, 25(11):58-60.
WANG G H, ZHANG R J. Development and application of blood meal high protein feed., 2004, 25(11):58-60. (in Chinese)
[15] 王裕玉, 石野, 于世亮, 杨雨虹, 刘大森. 血粉在水产饲料中应用效果的研究进展. 中国饲料, 2012(23):39-42.
WANG Y Y, SHI Y, YU S L, YANG Y H, LIU D S.Research progress on the application of blood meal in aquatic feed.. 2012(23):39-42. (in Chinese)
[16] Bucknall S D, MacKenzie A L, Sauer M J. Determination of Clenbuterol in bovine liver by enzyme immunoassay., 1993, 275: 227-230.
[17] ZHAO Y Y, JIANG D M, WU K, YANG H, DU H J, ZHAO K, LI J H,DENG A P. Development of a sensitive monoclonal antibody- based ELISA for the determination of a β-adrenergic agonist brombuterol in swine meat, liver and feed samples.2016, 8:6941-6948.
[18] 杨菲, 王培龙, 石雷, 苏晓鸥. β-受体激动剂速测技术研究. 农产品质量与安全, 2015, 4:41-47.
YANG F, WANG P L, SHI L, SU X O. Study on rapid detection of beta receptor agonists., 2015, 4:41-47. (in Chinese)
[19] ESHAQ S, CHAI S C, SAMI J, GENE A, HOFFMAN I K. Determination of ractopamine in animal tissues by liquid chromatography- fluorescence and liquid chromatography/ tandem mass spectrometry., 2003, 483 :137-145.
[20] KOOLE A,BOSMAN J,FRANKE J P. Multiresidue analysis of β-agonists in human and calf urine using multimodal solid-phase extraction and high-performance liquid chromatography with electrochemical detection.1999, 726: 149-156.
[21] LIU W, ZHANG L, WEI Z Y, CHEN S P, CHEN G N. Analysis of β-agonists and β-blockers in urine using hollow fibre-protected liquid-phase microextraction with in situ derivatization followed by gas chromatography/mass spectrometry.2009, 1216: 5340-5346.
[22] PASQUALE G, BRAMBILLA G, NERI B. Purification of clenbuterol- like β2-agonist drugs of new generation from bovine urine and hair by α1-acid glycoprotein affinity chromatography and determination by gas chromatography-mass spectrometry., 2007, 587: 67-74.
[23] DU W, LEI C, ZHANG S, BAI G, ZHOU H Y, SUN M, FU Q, CHANG C. Determination of clenbuterol from pork samples using surface molecularly imprintedpolymers as the selective sorbents for microextraction in packed syringe.91 (2014) 160-168.
[24] XU Z G, HU Y F, HU Y L, LI G K. Investigation of ractopamine molecularly imprinted stir bar sorptive extraction and its application for trace analysis of β2-agonists in complex samples., 2010 ,1217: 3612-3618.
[25] 李阳, 苏晓鸥, 张维, 樊霞, 王培龙, 王瑞国, 王骁. 酶解及有机溶剂提取对绵羊血浆和尿样中两种β2- 受体激动剂含量测定的影响. 分析化学, 2014(5): 717-722.
LI Y, SU X O, ZHANG W, FAN X, WANG P L, WANG R G, WANG X. Study on influences of enzymolysis and organic solvent extraction on determination of 2 kinds of β2-agonist residues in sheep plasma and urine., 2014(5): 717-722.(in Chinese)
[26] MAURO D, CIARDULLO S , CIVITAREALE C, FIORI M, PASTORELLI A A, STACCHINI P, PALLESCHI G. Development and validation of a multi-residue method for determination of 18 β-agonists in bovine urine by UPLC-MS/MS.2014, 115: 70-77.
[27] Wang P L, Liu X M, Su X O, Zhu R H. Sensitive detection of b-agonists in pork tissue with novel molecularly imprinted polymer extraction followed liquid chromatography coupled tandem mass spectrometry detection., 2015, 184: 72-79.
[28] GB/T22286-2008. 动物源性食品中多种β-受体激动剂残留量的测定液相色谱串联质谱法
GB/T22286-2008 Determination of a number of beta agonists residues in animal derived foods by liquid chromatography tandem mass spectrometry. (in Chinese)
[29] 强致懿. 猪肝脏、肌肉、尿液和血清中莱克多巴胺残留检测方法及残留消除的研究[D]. 北京: 中国农业大学, 2007.
QING Z Y. Determination of ractopamine residue in pig liver, muscle, urine and serum and study on residue elimination. Beijing: China Agricultural University, 2007. (in Chinese)
[30] SUO D C, ZHAO G L, WANG R G, SU X O. Determination of ractopamine in animal hair: Application to residue depletion in sheep and residue monitoring., 2014, 972:124-128.
Simultaneous Determination of 18 β-agonists in Blood Products for Feeds by Liquid Chromatography Tandem Mass Spectrometry
SUO DeCheng, WEI ShuLin, XIAO ZhiMing, WANG PeiLong, WANG RuiGuo, LI Yang
(Institute of Quality Standards and Testing Technology for Agricultural Product, Chinese Academy of Agricultural Sciences, Beijing 100081)
【Background】Blood product for feeds is a kind of unconventional animal-derived feed material. It is made through coagulating the blood of livestock or poultry, cooking at high temperature, pressing out juice, drying and grinding. However, due to the existence of illegal use of β- agonists, the use of blood product from blood containing β-agonists may become a potential source of harm to human health. In order to reduce the safety risk, it is necessary to study the methods of β-agonists in blood product for feeds. The detection methods of β-agonists include enzyme-linked immunosorbent assay (ELISA), high performance liquid chromatography (HPLC), gas chromatography-mass spectrometry (GC/MS) and liquid chromatography-tandem mass spectrometry (LC-MS/MS). At present, most of the methods or standards are aimed at commercial finished feed or animal-derived food, however there is a lack of relevant research on the detection technology of β-agonists in blood product for feeds. 【Objective】In order to study and monitor the status of β-agonists in blood product for feeds, a method of LC-MS/MS combined with solid phase extraction (SPE) was developed for the determination of 18 β-agonists in blood product for feeds.【Method】2 g (accurate to 0.01 g) blood product sample was weighed in 50 mL centrifugal tube, and then 20 mL ammonium acetate extract (pH=5.2) and 50 mL beta-glucuronidase/arylsulfatase were added accurately. The eddies were mixed evenly hydrolyzed overnight at 37 (>16 hours), then centrifuged for 5 min at 8 000 r/min, the supernatant was transferred to another centrifugal tube, and 0.5 mL 30% perchloric acid solution was added. After vortex mixing for 30 seconds and centrifugation for 5 minutes at 8 000r/min, supernatant was reserved. PCX solid phase extraction column was activated with 3 mL methanol and 3 mL water in turn. The supernatant was load and washed by 3 mL water and 3 mL methanol, then drained, eluted by 3 mL 5% ammonia methanol solution. The eluent was blown to near dry by nitrogen at 50 °C, dissolved by 1.0 mL 0.1% formic acid water + acetonitrile solution (95+5) and filtered through 0.22 μm filter membrane, then detected by Waters TQ liquid chromatography tandem mass spectrometer. The column ACQUITY UPLC BEH C18 (100 mm, 2.1 mm, 1.7 μm) was used as analysis column; acetonitrile and 0.1% formic acid solution were used as mobile phase for gradient elution. The ionization modes of mass spectrometry were electron spray ion source, positive ion detection method and multi reaction monitoring (HRM), the spray voltage was 3.5 kV, the dissolvent temperature was 480 °C, the source temperature was 150 °C, flow rate of the dissolvent gas was 600L·h-1, and flow rate of the cone gas was 5 L·h-1. The dissolvent gas, cone gas and collision gas were all high purity nitrogen gas.【Result】18 β-agonists showed a good linear relationship between 5 and 100 μg·L-1, with correlation coefficients ranging from 0.99 to 0.999. The average recovery of blood powder, plasma protein powder and globulin powder was 65.1%-110% at the levels of 5, 10 and 50 μg·kg-1, and the relative standard deviation below 15%. The coefficient of variation between batches was less than 20%. The detection limit was less than 5 ng·g-1.【Conclusion】The results of recovery, precision and actual samples showed that the method was suitable for monitoring β-agonists in blood products for feed.
β-agonists; LC-MS/MS; blood products for feeds
2018-01-08;
2019-09-20
国家自然科学基金(31572443)、公益性行业(农业)科研专项项目(201203088)、农业行业标准制定和修订(农产品质量安全)项目(2015-332)、中国农业科学院“饲料质量安全检测与评价”创新团队项目
索德成,E-mail:suodecheng@caas.cn
(责任编辑 林鉴非)
