二氮嗪对氧糖剥夺后BV-2细胞凋亡及caspase-3表达的影响
2020-01-09付昱李昕韩冬郭靖宇王艺霖张鸿
付昱,李昕,韩冬,郭靖宇,王艺霖,张鸿
(中国医科大学附属盛京医院神经内科,沈阳 110004)
ATP敏感性钾通道(ATP-sensitive potassium channels,KATP)开放剂可以对脑缺血/再灌注损伤中的神经元及血脑屏障相关蛋白发挥保护作用[1-2],但对于小胶质细胞的作用及相关信号通路仍不清楚。二氮嗪是一种线粒体KATP开放剂,研究[2]表明二氮嗪可以在大鼠脑缺血/再灌注模型中对神经细胞及血脑屏障相关蛋白起保护作用。BV-2细胞是小鼠小胶质细胞,常用作小胶质细胞模型,用无糖血清和三气培养箱创造氧糖剥夺条件对BV-2细胞进行处理,可模拟缺血缺氧状态下的细胞微环境。本研究拟通过氧糖剥夺诱导的BV-2细胞探讨二氮嗪对缺血缺氧状态下小胶质细胞的影响。
1 材料与方法
1.1 主要仪器及试剂
HERA Cell 150 三气培养箱(美国 Billups-Rothenberg 公司),FACScalibur流式细胞检测分析仪(美国 BD 公司),Eclipse NI正置荧光显微镜+图像采集系统(日本尼康公司 ),RPMI1640培养基、新生胎牛血清、无糖DMEM培养基(美国Gibco公司),AV/PI凋亡试剂盒(苏州宇恒生物科技有限公司),caspase-3抗体、FITC标记二抗(美国Proteintech Group公司)。
1.2 方法
1.2.1 细胞培养:小胶质细胞系BV-2细胞用含有20%胎牛血清的RPMI1640完全培养基在37 ℃、5%CO2培养箱中培养,每48 h更换培养基1次。
1.2.2 分组建模及给药:将4个培养皿的BV-2细胞传代2 d后,分为A、B、C、D 4组。A组为对照组;B组更换为无糖无血清培养基并移至HERA Cell 150 三气培养箱中进行氧糖剥夺建模,持续充以10%CO2和90%N2,在此条件下培养6 h后复氧,更换为常氧、原培养液条件下再培养24 h;C组在氧糖剥夺处理之前给予二氮嗪100 μmol/L;D组在氧糖剥夺处理之前给予二氮嗪100 μmol/L+5-羟葵酸(5-hydroxydecanoate,5-HD)100 μmol/L。
1.2.3 流式细胞术检测BV-2细胞的凋亡:用含0.25%EDTA的胰酶对BV-2细胞进行消化处理,每样本细胞数在1×105~5×105范围内,收集细胞后在高速冷冻离心机中以300g离心5 min,弃去上清培养液。加入PBS 500 μL洗涤2次,再以300g离心5 min。弃去上清培养液后,加入100 μL流式缓冲液进行重悬,采用AnnexinV-FITC/PI双染法,每管先加入5 μL AnnexinV-FITC,混匀后再加入2 μL PI工作液振荡混匀,所有操作均在冰上进行。于室温下避光孵育15 min,1 h内上流式细胞仪检测。
1.2.4 免疫细胞荧光染色检测cleaved caspase-3蛋白表达:待培养皿中的BV-2细胞培养至对数生长期,以104/孔铺于6孔板,待细胞生长至镜下视野的70%~80%,PBS洗3次,每次3 min。用4%多聚甲醛在-20 ℃固定20 min,PBS洗3次,每次3 min。5%BSA室温封闭1 h。加入caspase-3一抗(稀释1 ∶100),在湿盒中4 ℃过夜。PBS洗3次,每次3 min。加二抗(PBS稀释1 ∶100),室温避光孵育4 h,PBS洗3次,每次3 min。加入DAPI染色剂200 μL,室温避光孵育5 min。PBS洗4次,每次5 min。加入50 μL抗荧光淬灭剂封片,利用荧光显微镜观察蛋白定位并测定蛋白平均光密度值(IOD)。
1.2.5 免疫印迹实验检测cleaved caspase-3蛋白表达情况:收集BV-2细胞至EP管,用RIPA提取总蛋白,BCA蛋白定量,高温变性。各组取40 g蛋白行10%SDS-PAGE凝胶电泳,110 V、86 mA恒压转印至PVDF膜。5 %脱脂奶粉常温封闭2 h。加入一抗(anti-cleaved caspase-3 稀释1 ∶1 000及anti-β-actin 稀释1 ∶5 000)4 ℃摇床过夜。加入二抗(1 ∶200与HRP2结合)孵育2 h,ECL染色,凝胶图像分析仪扫描图像,用Image J软件分析蛋白条带灰度,计算目的蛋白灰度值/内参蛋白灰度值。
1.3 统计学分析
2 结果
2.1 各组BV-2细胞凋亡情况
流式细胞术结果显示,B、C、D组凋亡率均有升高,与A组比较差异均有统计学意义(P<0.01);B、D组凋亡率升高较C组显著,差异有统计学意义(P<0.01),B组和D组比较差异无统计学意义(P>0.05)。见图1。
2.2 cleaved caspase-3蛋白的表达情况
免疫荧光染色和免疫印迹检测结果显示,4组细胞内均可见cleaved caspase-3蛋白表达。B、C、D组表达均高于A组,但C组低于B、D组,差异均有统计学意义(均P<0.01)),B组和D组比较无统计学差异(P>0.05)。见图2~3。
3 讨论
卒中是全球成人致死致残的主要病因,随着我国经济水平不断提高,卒中已逐步成为我国仅次于心脏疾病和肿瘤的第三大致死病因。虽然对于卒中发生的分子和细胞机制的了解越来越深入,但是目前仍然没有非常有效的治疗药物。

图1 各组BV-2细胞凋亡率Fig.1 Apoptosis rate of BV-2 cells in different groups
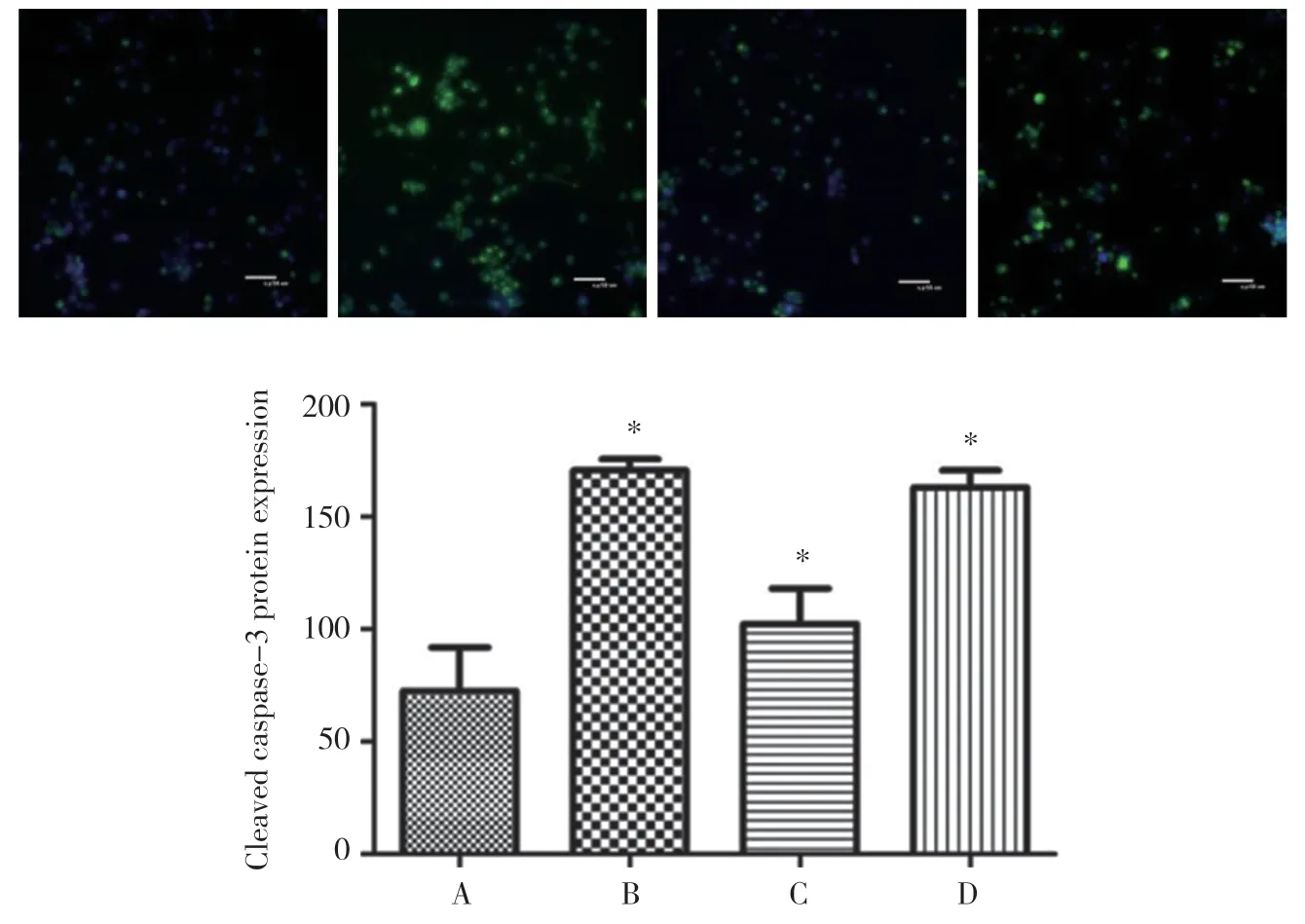
图2 各组BV-2细胞cleaved caspase-3蛋白的表达(免疫荧光染色)Fig.2 Expression of cleaved caspase-3 protein in different groups(immunafluorescence)
脑内的神经元、星形胶质细胞、血管内皮细胞、细胞外基质、周细胞以及小胶质细胞等组成神经血管单元[3]。神经血管单元中的小胶质细胞作为“中枢神经系统的巨噬细胞”,在神经系统疾病中的作用一直为众多学者所关注[4-6],特别是小胶质细胞在脑缺血/再灌注损伤中的反应,被作为一个重要的治疗靶点加以研究[7-8]。前期研究[9-11]显示,KATP开放剂吡那地尔能够明显减轻大鼠脑缺血/再灌注后的神经功能损伤,减小梗死区体积,并通过激活PI3K/Akt/Bcl-2通路,影响神经细胞的凋亡,以此对脑组织起到保护作用。
多项研究[12-13]表明,KATP开放剂二氮嗪能够降低病理条件下的神经元PC12细胞的凋亡率。也有文献[14]报道有药物能够减少氧糖剥夺后BV-2小胶质细胞炎性细胞因子的释放以及凋亡的发生,但KATP开放剂二氮嗪对氧糖剥夺后小胶质细胞的作用仍不清楚。本研究使用流式细胞术和AnnexinV-FITC/PI双染法检测了小胶质细胞系BV-2细胞的凋亡率,结果发现二氮嗪可以减少氧糖剥夺/复氧后的BV-2细胞的凋亡。caspase-3蛋白是细胞凋亡的重要相关蛋白,通常被活化剪切为P17与P12 2种片段,引起凋亡发生[15-16]。本研究结果表明,二氮嗪能减少缺氧/复氧后BV-2细胞中caspase-3的活化,而5-HD作为一种KATP阻断剂能降低二氮嗪对caspase-3的活化。证明KATP开放剂有可能是通过减少caspase-3蛋白的活化而发挥其对缺氧/复氧后的小胶质细胞的保护作用。

图3 各组cleaved caspase-3蛋白的表达水平(Western blotting)Fig.3 Expression levels of cleaved caspase-3 protein in different groups(Western blotting)
综上所述,本研究结果提示,KATP开放剂二氮嗪可能通过减少caspase-3的活化影响小胶质细胞的凋亡,从而对脑缺血/再灌注后的脑组织损伤发挥保护作用。但是,有关小胶质细胞在病理条件下对神经血管单元其他组成部分的作用以及KATP通道对脑缺血后神经血管单元的影响,有待进一步探讨。
