原儿茶醛对阪崎克罗诺肠杆菌毒力因子的抑制作用
2020-01-08李皓洲郝旭昇郭嘉璐郑晓营杨焯凯
李皓洲,郝旭昇,郭嘉璐,郭 都,郑晓营,王 硕,杨焯凯,石 超
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
阪崎克罗诺肠杆菌(Cronobacter sakazakii)是克罗诺杆菌属中的一种具有鞭毛、兼性厌氧的革兰氏阴性菌,广泛存在于婴幼儿奶粉、婴幼儿米粉、水果、蔬菜等食品中[1],有极强的致病性。人体感染阪崎克罗诺肠杆菌后,会出现脑膜炎、菌血症、坏死性小肠结肠炎等多种疾病,致死率最高可达80%[2]。同时,阪崎克罗诺肠杆菌感染性疾病即使被治愈,近20%的感染病例都会伴有严重的神经系统后遗症,包括脑脓肿、神经发育迟缓、脑积水和四肢瘫痪等[3]。国际食品微生物标准委员会把阪崎肠杆菌描述为“对特定人群造成严重危害,危及生命或引起长期慢性实质性后遗症的病原菌”[4]。
阪崎克罗诺肠杆菌的致病性与其运动能力、形成生物被膜、黏附及侵入肠上皮细胞等毒力因子密切相关[5]。阪崎克罗诺肠杆菌具有良好的运动能力,这有助于菌体感知外界环境刺激的变化而确定感染宿主细胞的位点,从而增强菌体对宿主的侵染,并且阪崎肠杆菌的运动能力有助于菌体自身生物被膜的形成[6];阪崎克罗诺肠杆菌能在不锈钢、塑料、玻璃、乳胶、硅胶等材料表面形成生物被膜[7-8],从而提高细菌对洗涤剂、生物抑杀剂、抗生素和宿主防御系统的耐受能力,增强菌体的致病风险[9-10];并且,阪崎克罗诺肠杆菌能够黏附及侵入人体肠上皮细胞,这是菌体引发脑膜炎、菌血症、败血症等感染性疾病的必要途径[11]。
抗生素是治疗细菌感染性疾病的传统方法,其主要是通过干扰微生物生长过程中的关键步骤,如细胞壁合成、DNA复制和蛋白合成等[12],从而抑制微生物生长;虽然这种方式非常有效,但也给细菌带来选择性压力,从而使耐药菌株被筛选出并成为优势群体。而毒力因子不是细菌存活必需的因素,对细菌并不会构成进化上的压力,因而不易产生耐药现象。与抗生素相比,某些植物源活性物质在不干扰细菌正常生长的情况下通过抑制细菌毒力因子进而降低致病菌的致病能力成为一种新型而有效的抗感染方式[12-13]。原儿茶醛(C7H6O3,CAS:139-85-5)是一种从乌蕨中提取的,具有抗动脉粥样硬化[14]、保护神经细胞[15]、防止肝纤维素化[16]、抗病毒[17]等多种生物活性的植物源活性物质。已有研究表明,原儿茶醛能够对阪崎克罗诺肠杆菌产生抑制作用,影响其正常生长,使细菌形态干瘪皱缩,出现畸形,破坏菌体细胞膜完整性,降低细菌胞内ATP浓度[18]。但目前原儿茶醛对阪崎克罗诺肠杆菌毒力因子的影响鲜有研究,作用机制也尚不明确。
本研究旨在探究原儿茶醛对阪崎克罗诺肠杆菌毒力因子的抑制作用及其可能的作用机制。首先测定原儿茶醛对阪崎克罗诺肠杆菌的最小抑菌浓度(minimal inhibitory concentrations,MIC)和最小杀菌浓度(minimal bactericidal concentrations,MBC),并确定亚抑制浓度(sub-inhibitory concentration,SIC);其次,使用SIC的原儿茶醛处理阪崎克罗诺肠杆菌,检测原儿茶醛对菌体泳动运动性、生物被膜形成能力和黏附及侵入Caco-2细胞能力的影响;最后,通过反转录实时荧光定量聚合酶链式反应(reverse transcription quantitative realtime polymerase chain reaction,RT-qPCR)技术检测原儿茶醛对阪崎克罗诺肠杆菌毒力基因转录过程的影响。研究旨在为原儿茶醛能够成为降低阪崎肠杆菌致病风险的抗感染物质提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
阪崎克罗诺肠杆菌标准菌株ATCC29544和ATCC29004购买于美国模式培养物寄存库;阪崎克罗诺肠杆菌菌株6-16(1)、18-24(2)、11-18(2)和12-13(2)由Li Zhen等[19]从市面销售的婴幼儿配方奶粉及米粉中分离得到。Caco-2细胞(人克隆结肠腺癌上皮细胞)购于武汉大学细胞保藏中心。
原儿茶醛(高效液相色谱级,纯度99.88%) 成都曼思特生物技术有限公司;氯化钠、氯化钾、磷酸二氢钾、二水合磷酸氢二钠、结晶紫、二甲基亚砜(dimethyl sulfoxide,DMSO) 天津科密欧化学试剂有限公司;RNA提取试剂盒 北京天根生物科技有限公司;反转录试剂盒、SYBR®Premix Ex TaqTMII 宝日医生物技术(北京)有限公司;细胞培养液DMEM 美国Gibco公司;青霉素、链霉素 上海碧云天生物技术公司;庆大霉素 美国Sigma公司;胎牛血清(fetal bovine serum,FBS) 美国HyClone公司。

表1 RT-qPCR所用的引物信息Table 1 Information on primers used for reverse transcription quantitative real-time polymerase chain reaction
选取ESA_04030作为内参基因[20]及与阪崎克罗诺肠杆菌运动性、生物被膜及黏附与侵入肠上皮细胞有关的9 种毒力基因[20-21]进行RT-qPCR,基因引物及功能见表1。
1.2 仪器与设备
5840R高速冷冻离心机 德国Eppendorf公司;Model 680酶标仪、iQ5 qPCR仪 美国Bio-Rad公司;GHX-9050B-2细菌培养箱 上海福玛实验设备有限公司;HF90细胞培养箱 上海力申科学仪器有限公司;JS680B凝胶成像系统 上海培清科技有限公司;Nano-200超微量核酸分析仪 杭州奥盛仪器有限公司;KB-900脱色摇床 海门市其林贝尔仪器制造有限公司;微生物全自动生长曲线分析仪 芬兰Bioscreen公司。
1.3 方法
1.3.1 阪崎克罗诺肠杆菌菌悬液制备
将冻存于-80 ℃冰箱中的阪崎克罗诺肠杆菌于胰蛋白胨大豆琼脂(tryptone soya agar,TSA)平板上活化(37 ℃、12 h),随后挑取单菌落于胰蛋白胨大豆肉汤(tryptone soya broth,TSB)培养液中并置于恒温摇床中培养8 h(130 r/min),使菌体处于对数生长期。使用pH 7.2磷酸盐缓冲溶液(phosphate buffered solution,PBS)清洗并悬浮菌体,最后使用TSB调整菌悬液,使菌体浓度约为108CFU/mL,备用。
1.3.2 原儿茶醛对阪崎克罗诺肠杆菌MIC和MBC的测定
MIC的测定参照Wiegand等[22]采用的液体稀释法,并略有修改。具体如下:利用等倍稀释法配制原儿茶醛质量浓度分别为0、0.125、0.25、0.5、1、2、4 mg/mL的TSB溶液,并将其按照质量浓度梯度从高到低的顺序加入至96 孔板中(每孔100 µL)。将1.3.1节中菌悬液稀释400 倍至菌体浓度为5×105CFU/mL,随后加入100 µL至各小孔中混匀(最终菌体浓度为2.5×105CFU/mL),实验设置TSB含质量分数1%,DMSO作为空白对照组用以校正溶剂光密度。随即将96 孔板放入酶标仪中测定630 nm波长处光密度,于37 ℃培养24 h后取出再次测定。经过24 h培养后,光密度变化小于0.05所对应的原儿茶醛的最小质量浓度即为MIC。将高于或等于MIC且能够使菌体浓度降低3 个对数值的原儿茶醛的最小质量浓度定为MBC[23]。
1.3.3 原儿茶醛对阪崎克罗诺肠杆菌SIC的测定
实验选用阪崎克罗诺肠杆菌ATCC29544进行后续研究。参照Li Guanghui等[24]的方法,将1.3.1节中制备的菌悬液加入至百孔蜂窝板中(每孔125 µL)。随后,每孔加入125 µL使用TSB(含质量分数1% DMSO)溶解的原儿茶醛溶液,使原儿茶醛质量浓度分别为MIC、1/2、1/4、1/5、1/10、1/20、1/40、1/50、1/100 MIC和1/200 MIC。实验设置不含原儿茶醛的菌悬液(含质量分数1% DMSO)作为阴性对照组,设置TSB肉汤(含质量分数1% DMSO)作为空白对照组,每组设置4 个平行。同时,于百孔蜂窝板周围加入无菌水以保证样品湿度。最后,将样品置于全自动生长曲线分析仪,于37 ℃条件下每隔1 h测定24 h内各孔光密度值并绘制生长曲线,最终选择低于MIC且对细菌生长无明显抑制作用的原儿茶醛质量浓度为SIC。
1.3.4 原儿茶醛对阪崎克罗诺肠杆菌泳动运动能力的影响
泳动实验参照Di Bonaventura等[25]采用的软琼脂平板法。首先,按照营养配方制备泳动营养平板,具体如下:质量分数0.3%琼脂、25 g/L的LB肉汤加水溶解后于121 ℃下高压蒸汽灭菌。待培养基温度降至50 ℃左右时加入原儿茶醛使其质量浓度分别为1/50、1/100 MIC和1/200 MIC,同时设置不含原儿茶醛组进行对照。泳动营养平板冷却30 min后,取5 µL 1.3.1节中制备的菌液于平板中央,37 ℃培养10 h后取出平板。使用凝胶成像系统进行拍照,并计算泳动圈直径。
1.3.5 原儿茶醛对阪崎克罗诺肠杆菌生物被膜形成能力的影响
原儿茶醛对阪崎克罗诺肠杆菌生物被膜形成能力影响的测定参照Du Wenfang等[26]的方法,具体方法如下:按照前述1.3.1节中方法制备菌悬液并调整OD600nm=1(菌悬液浓度约为109CFU/mL)。随后,配制质量浓度分别为0、1/50、1/100、1/200 MIC的原儿茶醛-菌液混合液,设置不含菌液和原儿茶醛的TSB为空白对照组(每孔250 µL),并于12 ℃和25 ℃下分别培养24、48、72 h。在24、48、72 h后测定各孔在630 nm波长处的光密度,吸出菌液后使用无菌水漂洗一次,烘干后依次使用1 g/100 mL结晶紫溶液染色、无菌水漂洗及体积分数33%冰乙酸溶解生物被膜-结晶紫复合体。最后,测定每孔在570 nm波长处光密度,使用生物被膜形成指数(specific biofilm formation,SBF)表征不同质量浓度原儿茶醛作用下的生物被膜形成能力,SBF按下式计算。
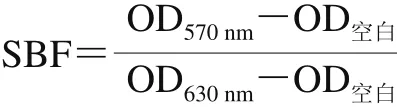
1.3.6 原儿茶醛对阪崎克罗诺肠杆菌黏附及侵入Caco-2细胞影响的测定
本实验参照Shi Chao等[27]方法,并略有修改。首先,将浓度为1×105cells/mL并处于对数生长期的Caco-2细胞接种于24 孔细胞培养板中恒温培养18 h,使用无菌PBS轻柔清洗3 次。取1.3.1节中菌悬液,并添加原儿茶醛溶液,使原儿茶醛的质量浓度分别为0、1/50、1/100、1/200 MIC,将样品置于37 ℃恒温摇床(100 r/min)培养6 h。取出样品进行离心(5 000×g、5 min、4 ℃),使用10% FBS的DMEM培养液稀释菌体浓度至106CFU/mL。向预先培养的细胞中每孔分别加入1 mL菌悬液后离心(600×g、5 min),随后将样品放入37 ℃、5% CO2细胞培养箱中恒温培养1 h。
在黏附实验中,于1 h后取出样品并吸取孔板内液体,使用无菌PBS清洗细胞3 次。向每孔中加入质量分数0.1% Triton X-100,置于4 ℃下处理20 min后使细胞裂解,使用无菌PBS以10 倍梯度稀释后进行涂布,于37 ℃培养24 h后计算黏附Caco-2细胞的菌体数量,以各质量浓度原儿茶醛作用菌体黏附细胞的细菌总数/对照组细菌总数进行数据分析。
在侵入实验中,于1 h后取出样品并吸取孔内液体,使用无菌PBS清洗细胞一次。向每孔中加入1 mL含有100 µL/mL庆大霉素的1% FBS的DMEM培养液,于37 ℃、5% CO2环境下培养30 min。随后吸取孔中液体使用无菌PBS清洗3 次,向每孔中加入0.1% Triton X-100并置于4 ℃下作用20 min以裂解细胞。最后,使用无菌PBS以10 倍梯度稀释进行涂布,37 ℃下培养24 h后计算侵入Caco-2细胞的菌体数量,以各质量浓度原儿茶醛作用菌体侵入细胞的细菌总数/对照组细菌总数进行数据分析。
1.3.7 原儿茶醛对阪崎克罗诺肠杆菌毒力基因转录的影响
本实验参照韩淇安等[28]方法,并略有修改。按照前述1.3.1节中方法制备菌悬液。相同体积菌悬液中分别加入不同质量浓度的原儿茶醛溶液使原儿茶醛终质量浓度为1/50 MIC和1/100 MIC,将样品于37 ℃下摇床(130 r/min)培养8 h后进行细菌RNA的提取。分别取1 mL原儿茶醛作用后的菌悬液于1.5 mL无酶离心管中离心(12 000 r/min、2 min),重复两次,弃上清液,依据细菌RNA提取试剂盒Bacteria Kit RNAprep Pure说明书操作进行细菌RNA的提取。使用PrimeScriptTMRT Master Mix(Perfect Real Time)反转录试剂盒将菌体RNA反转录为cDNA并于-20 ℃下保存备用。按照荧光定量试剂盒配制PCR体系,反应总体积为25 µL:SYBR®Premix Ex TaqTMII 12.5 µL、cDNA 2.0 µL、灭菌水8.5 µL,上、下游引物(10 µmol)各1.0 µL。扩增条件为95 ℃ 30 s,1 个循环;95 ℃ 5 s,60 ℃ 30 s,40 个循环;95 ℃ 15 s,60 ℃ 30 s,71 个循环。采用2-ΔΔCt法进行数据处理[29],评估相关毒力基因的转录量。
1.4 数据处理与分析
实验均进行3 次重复,实验数据处理使用SPSS软件。数据以平均值±标准差(n=3),采用Duncan's ANOVA对结果间的显著性进行比较。平均值间差异若达到P≤0.05则认为显著,P≤0.01则认为极显著。
2 结果与分析
2.1 原儿茶醛对阪崎克罗诺肠杆菌MIC及MBC的测定结果
实验选取两株标准菌株及4 株婴幼儿配方米粉和奶粉中的分离菌用于测定原儿茶醛对阪崎克罗诺肠杆菌MIC和MBC。实验结果表明(表2),原儿茶醛对阪崎克罗诺肠杆菌有着良好的抑菌和杀菌效果,对6 株实验菌株的MIC和MBC均为2 mg/mL。
阪崎克罗诺肠杆菌ATCC29544常用于菌体毒力因子的研究,且具有本研究所探究的毒力因子表型和基因学特征[27],因此选择ATCC29544作为后续研究对象。

表2 原儿茶醛对阪崎克罗诺肠杆菌的MIC和MBCTable 2 MIC and MBC of PA against C. sakazakii
2.2 原儿茶醛对阪崎克罗诺肠杆菌SIC的测定结果
本研究通过测定原儿茶醛对阪崎克罗诺肠杆菌生长曲线的影响确定SIC,结果如图1所示,原儿茶醛质量浓度为MIC时,菌体生长完全受到抑制;原儿茶醛质量浓度为1/2 MIC和1/4 MIC时,细菌延滞期明显增长,并呈现浓度依赖性;原儿茶醛质量浓度为1/50 、1/100、1/200 MIC时,菌体生长状况与对照组几乎无明显差异,该质量浓度下细菌可正常生长和繁殖。因此,选择1/50、1/100 MIC和1/200 MIC为研究所用的SIC。
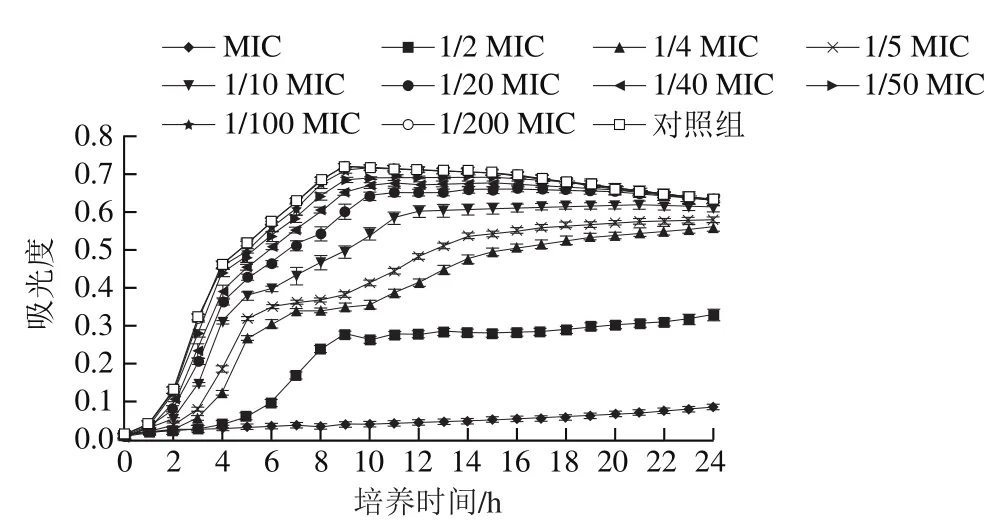
图1 不同质量浓度原儿茶醛对阪崎克罗诺肠杆菌ATCC29544生长曲线的影响Fig. 1 Effect of PA on the growth curve of C. sakazakii ATCC29544
2.3 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544泳动能力的影响
由图2可知,阪崎克罗诺肠杆菌具有较强的泳动能力,但在泳动琼脂平板中添加1/100 MIC和1/50 MIC的原儿茶醛后,阪崎克罗诺肠杆菌的泳动能力极显著降低(P<0.01),泳动圈直径分别为对照组的88.2%和83.8%。对照组的泳动圈面积为36.32 cm2,经质量浓度为1/100 MIC和1/50 MIC原儿茶醛处理的阪崎克罗诺肠杆菌的泳动圈面积分别为28.27 cm2和25.52 cm2;而1/200 MIC原儿茶醛能显著降低阪崎克罗诺肠杆菌的泳动圈直径至对照组的92.6%(P<0.05),其泳动圈的面积为31.17 cm2。因此,综合分析SIC的原儿茶醛对阪崎克罗诺肠杆菌ATCC29544的泳动能力有明显的抑制作用。
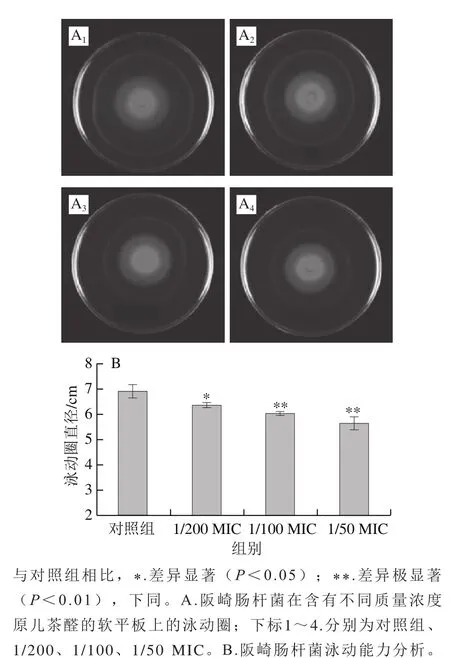
图2 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544泳动能力的抑制作用Fig. 2 PA inhibited swimming motility of C. sakazakii ATCC29544
2.4 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544生物被膜形成能力的影响
原儿茶醛对阪崎克罗诺肠杆菌ATCC29544在12 ℃和25 ℃下不同时间段(24、48 h和72 h)形成生物被膜能力的影响如图3所示。结果表明,在25 ℃下培养24 h后阪崎克罗诺肠杆菌的生物被膜形成能力最强。与对照组相比,不同质量浓度的原儿茶醛对阪崎克罗诺肠杆菌ATCC29544的生物被膜形成能力均有显著的抑制作用(P<0.05),并且抑制效果呈现浓度依赖性:例如在72 h时,未经原儿茶醛作用的阪崎肠杆菌生物被膜SBF为0.87±0.05,经1/200、1/100 MIC和1/50 MIC的原儿茶醛处理的阪崎肠杆菌生物被膜SBF分别降低至0.54±0.05、0.52±0.09和0.46±0.03。
2)阿卡狄亚式,即通过追溯艺术的黄金年代——古代与盛期文艺复兴时期,往现代城市中添加历史化的能唤起人乌托邦式想象的尺度。
12 ℃下阪崎肠杆菌生物被膜形成能力的最佳时间仍为24 h。原儿茶醛对阪崎肠杆菌的生物被膜形成能力有着显著的抑制作用(P<0.05),并随着质量浓度的升高抑制效果增强。在72 h时,未经原儿茶醛作用的阪崎肠杆菌生物被膜SBF为1.18±0.06。而经1/200、1/100 MIC和1/50 MIC的原儿茶醛处理后SBF分别降低至0.92±0.12、0.78±0.12和0.67±0.06。
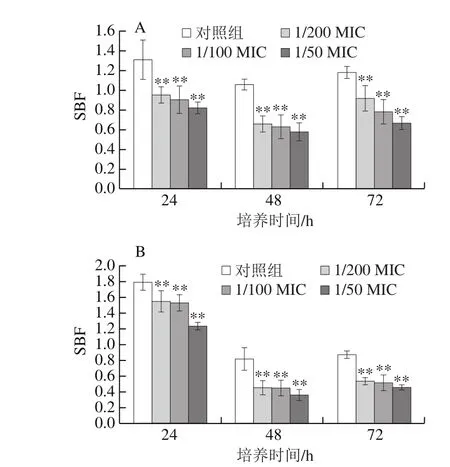
图3 原儿茶醛在12 ℃(A)和25 ℃(B)对阪崎克罗诺肠杆菌ATCC29544生物被膜形成能力的影响Fig. 3 Inhibitory effect of PA on biofilm formation of C. sakazakii ATCC29544 at 12 (A) and 25 (B) ℃
2.5 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544黏附及侵入Caco-2细胞的影响

图4 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544黏附(A)及侵入(B)Caco-2细胞的影响Fig. 4 Effect of PA on adhesion (A) and invasion (B) to Caco-2 cells of C. sakazakii ATCC29544
由图4A可知,原儿茶醛能够显著降低细菌黏附率(P<0.05),并且呈现浓度依赖性。当原儿茶醛质量浓度为1/200 MIC时,黏附阪崎肠杆菌总量相比对照组降低了1.9%;当原儿茶醛质量浓度为1/100 MIC及1/50 MIC时,细菌黏附率分别下降了76.7%和88.9%,并与对照组呈现极显著差异(P<0.01)。
由图4B可知,原儿茶醛对细菌侵入Caco-2细胞的能力具有明显的抑制作用,并随着质量浓度的增加抑制效果加强。与对照组相比,当原儿茶醛质量浓度为1/200 MIC和1/100 MIC时,阪崎克罗诺肠杆菌侵入率分别降低至60.6%和50.0%,并与对照组呈现显著差异(P<0.05);当原儿茶醛浓度为1/50 MIC时,细菌侵入率降低至27.3%,与对照组呈现极显著差异(P<0.01)。
2.6 原儿茶醛对阪崎克罗诺肠杆菌ATCC29544毒力基因转录的影响
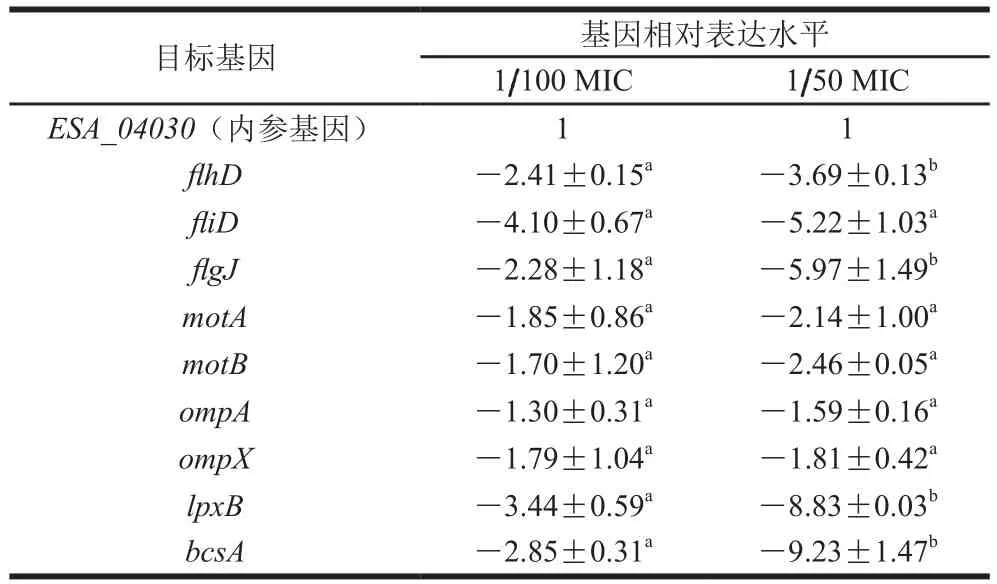
表3 原儿茶醛对阪崎克罗诺肠杆菌相关毒力基因表达的影响Table 3 Effect of PA on the expression of virulence genes in C. sakazakii
由表3可知,当原儿茶醛质量浓度为1/50 MIC和1/100 MIC时能够下调与阪崎肠杆菌泳动运动性(flhD、fliD、flgJ、motA、motB)、生物被膜(bcsA)、黏附及侵入宿主细胞能力(ompA、ompX)和内毒素(lpxB)相关毒力基因的转录量。原儿茶醛质量浓度在1/50 MIC时对相关毒力基因转录量的抑制作用比质量浓度在1/100 MIC时更加明显。编码阪崎克罗诺肠杆菌内毒素基因(lpxB)和生物被膜基因(bcsA),及部分鞭毛合成基因(flgJ、fliD)相比于实验中其他致病基因,转录过程受原儿茶醛影响更加明显。
3 讨 论
本研究首先通过测定MIC和MBC初步评价了原儿茶醛对阪崎克罗诺肠杆菌的抑杀效果,并选择1/50、1/100 MIC和1/200 MIC为实验所用SIC。随后选取了原儿茶醛处理后亚抑制态的菌体进行毒力因子抑制机理的研究。结果表明,原儿茶醛对本研究中使用的阪崎肠杆菌的MIC和MBC均为2 mg/mL,可见该天然产物抑菌作用良好。已有学者探究了其他植物源活性物质对阪崎肠杆菌的抑菌效果:马兰提取物丁香酸及乌蕨叶提取物质原儿茶酸对阪崎肠杆菌ATCC29544的MIC为5 mg/mL[2,30],阿魏茎根提取物阿魏酸对阪崎肠杆菌ATCC29544的MIC为2.5 mg/mL[31]。因此,在诸多植物源化合物中原儿茶醛对阪崎肠杆菌的抑制效果良好。
细菌的运动能力有助于菌体生物被膜的形成及菌体与宿主的相互作用,从而增强菌体的致病能力[32]。本实验结果表明,原儿茶醛能够显著或极显著减小阪崎肠杆菌的泳动圈直径,能够有效抑制其运动性,同时,实验发现与阪崎肠杆菌鞭毛合成或运动功能相关的基因(motA、motB、fliD、flgJ、flhD等)转录量显著下调。类似地,Inamuco等[33]证明香芹酚能够使沙门氏菌蛋白合成受阻从而降低致病菌的运动能力;Amalaradjou等[20]也证明肉桂醛能够影响多种与运动相关基因的表达而使其运动区域面积显著降低。本实验中下调基因motA和motB是鞭毛基本结构——基体组成蛋白的必需基因,另外flhD操纵子的表达水平在细菌的运动速度控制中起着“枢纽”的作用[34-35]。因此,猜测原儿茶醛通过影响编码鞭毛蛋白的基因表达或鞭毛功能从而降低阪崎肠杆菌的运动能力。
在生物被膜形成能力实验中,选取了对食品生产及生活具有指导意义的实验温度:12 ℃是欧洲议会和理事会于2004年制定的食品卫生规则条例中食品工业操作环境温度,25 ℃即普通环境下的室温。生物被膜在形成过程中会经历游离态、可逆黏附、不可逆黏附、被膜成熟及主动分散5 个阶段[36]。本研究结果表明,在实验温度下生物被膜形成能力24 h时达到最大,随后SBF显著降低,推测该结果可能是由于生物被膜培养一段时间后进入主动分散阶段。结果表明:在实验温度(12 ℃及25 ℃)下,原儿茶醛能够极显著降低阪崎肠杆菌生物被膜形成能力。类似地,Xu Yunfeng等[37]发现SIC 1/64、1/32 MIC下的安石榴苷能够使金黄色葡萄球菌生物被膜形成指数由3.7分别下降至1.9和0.4;Du Wenfang等[26]研究认为1/10 MIC浓度的表没食子儿茶素没食子酸酯可显著降低单增李斯特菌ATCC19114在15、30、37 ℃下的生物被膜形成量。在本研究中,原儿茶醛能够使与生物被膜形成的相关毒力基因下调,包括鞭毛合成基因(如motA、motB、fliD、flgJ、flhD等)以及生物被膜结构组成基因(如bcsA)。bcsA作为纤维素合酶催化亚基的编码基因,在纤维素合成及促进肠杆菌科胞外多糖生成中至关重要[38]。Amalaradjou等[20]实验结果显示750 µmol/L的反式肉桂醛使阪崎肠杆菌与鞭毛相关的基因fliD、flgJ、flhD转录量极显著下降。因此,推断原儿茶醛能够通过影响生物被膜形成相关基因的表达来实现对其毒力的调控。
黏附及侵入肠上皮细胞是阪崎克罗诺肠杆菌致病的关键步骤,由阪崎肠杆菌所引起的脑膜炎、菌血症等症状均与该毒力密切相关。本研究结果表明,原儿茶醛能够降低阪崎肠杆菌黏附及侵入Caco-2细胞的能力。多种天然物质具有抑制致病菌黏附或/和侵入宿主细胞的功能:Li Guanghui等[24]的研究结果表明安石榴苷可有效降低沙门氏菌黏附Caco-2细胞的能力;Fan Qiuxia等[39]研究显示1/32 MIC和1/16 MIC下的辅酶Q0使李斯特菌CMCC54004黏附及侵入Caco-2细胞能力下降,并且相关毒力基因actA、inlA、inlB、plcA、plcB转录水平也呈现下降趋势。OmpA和OmpX是阪崎肠杆菌黏附及侵入宿主过程中的重要功能膜蛋白,OmpA作为细胞外膜极其重要的结构蛋白质,通过维持细胞菌体形态和亲水化合物的跨膜传递,从而影响菌体黏附宿主的过程[40],OmpX的生物学功能尚不清楚,但有研究者认为它能与肠杆菌科细胞表面的外来蛋白结合,从而引起细胞的防御机制,这种结合亲和力用于实现细胞黏附和侵袭[41]。研究显示,原儿茶醛可下调ompA和ompX等相关毒力基因转录水平,因此,猜测原儿茶醛能够通过影响ompA和ompX的转录量从而干扰阪崎肠杆菌对肠上皮细胞的黏附和侵入。
4 结 论
本研究以原儿茶醛为对象,以阪崎克罗诺肠杆菌为作用主体,探究了原儿茶醛对阪崎克罗诺肠杆菌多种毒力因子的抑制作用。首先测定原儿茶醛对阪崎克罗诺肠杆菌的MIC和MBC,并确定了SIC;随后探究了原儿茶醛对菌体泳动运动能力、生物被膜形成、黏附及侵入Caco-2细胞的影响;最后利用RT-qPCR技术检测了原儿茶醛对菌体毒力相关基因的转录量的影响。结果表明原儿茶醛对本研究中6 株阪崎克罗诺肠杆菌的MIC和MBC均为2 mg/mL,SIC的原儿茶醛能够显著抑制菌体泳动运动能力,减弱菌体在12 ℃和25 ℃下生物被膜的形成能力,并能够降低菌体黏附及侵入Caco-2细胞的能力,同时能够下调9 个相关毒力基因的转录量。本研究结果表明,原儿茶醛对阪崎克罗诺肠杆菌的毒力因子有着良好的抑制作用,有潜力作为抗生素补充剂或抗毒性物质,从而达到预防及控制阪崎克罗诺肠杆菌感染性疾病的目的。
