磁性载体蛋白抗体阻断剂制备及性能测定
2020-01-07
(上海交通大学生命科学技术学院, 上海200240)
人体外诊断(IVD)免疫检测方法在临床疾病诊断检测中已经被广泛应用。由于人群存在着基础生理状态的个体差异和疾病阶段、状态的差异,因此待测临床体液样品中往往存在多种干扰检测准确性的因子, 如嗜异性抗体(HA),或者能与患者自身免疫球蛋白(Ig)反应的类风湿因子(RF),均可能与动物Ig发生交叉反应,而免疫测定通常使用动物源抗体特异识别疾病相关标志物,结果导致误诊[1]。此外,在疫苗新药研发中需要进行免疫反应强度检测和保护效果评估,对靶标表位的免疫检测具有重要意义。由于半抗原(如细菌荚膜多糖)或多肽表位自身免疫原性较弱,需要与大分子量的载体蛋白化学偶联,因此要求载体蛋白具有促进半抗原的识别、递呈、抗原特异免疫反应等免疫增强作用。疫苗常用载体蛋白有白喉毒素(DT)、白喉毒素突变株(CRM197)、破伤风类毒素、 霍乱毒素B链(CTB)等。 在肿瘤自体抗原疫苗设计中,使用载体蛋白可以帮助突破免疫耐受和增强自体抗原的免疫原性。近几年研究表明,白喉毒素跨膜结构域(DTT)是一个很好的载体蛋白,其三维结构全部由α螺旋和转折构成,因而具有很高的稳定性[2],可以作为表位肽移植骨架帮助维持表位肽空间构象[3]。DTT还可以促进重组蛋白在大肠杆菌中可溶性表达,简化了疫苗重组蛋白的制造工艺,显著降低成本。基于DTT的重组抗原如DTT -血管内皮生长因子(VEGF)[4]和DTT -肿瘤坏死因子第119位的酪氨酸突变为天冬酰胺(hTNFY119N)(DTT-hTNFmut)分别在肿瘤和关节炎小鼠模型研究中有非常好的疗效。载体蛋白不仅能激活T辅助细胞,还能激活B细胞产生载体蛋白特异性抗体,这些抗体的数量通常是多糖的几十到几百倍[5]。DTT本身产生的抗体往往比肿瘤坏死因子(TNF)表位抗体滴度也多一个数量级以上,常干扰靶标抗原的抗体检测[6],因此,在分析血清抗体的酶联免疫吸附检测(ELISA)时需要用高纯度的特异抗原。特异抗原纯度与制备纯化成本成正比,而DTT作为多种疫苗共有的载体,可以在多种疫苗研发检测中使用,具有更广的用途。为此,本文中试图采用基于磁珠的DTT亲和吸附特性去除血清中的DTT抗体,简化去除操作步骤,缩短操作时间,提高特异抗原抗体免疫检测的精准度。
葡聚糖纳米磁珠是一种很好的磁力辅助分离材料,比表面积大[7]和分散度高的特点使其能结合捕获较多的待测物,利用外加磁场实现快速分离。纳米磁珠与抗体或抗原偶联后,可从临床样品中快速富集抗原或抗体,用于疾病快速检测和诊断,比经典的ELISA检测和普通斑点荧光检测更灵敏[8]。
本文中利用高温多元醇法[9-10]合成葡聚糖纳米磁珠,经溴化氰活化后[11-12],共价偶联载体蛋白DTT,制备纳米磁珠(MP)-DTT抗体阻断剂;与小鼠抗血清分别在4、 37 ℃动态孵育,血清中的DTT抗体与MP-DTT特异结合而被去除;通过ELISA检测血清中剩余的DTT抗体含量。
1 材料与方法
1.1 实验材料
主要材料包括:pGEX-6P-1-DTT、 pET-28a-hTNFmut重组质粒, 上海交通大学生物制造实验室构建;DH5α、BL21 (或DE3)感受态,天根生化科技(北京)有限公司;谷胱甘肽巯基转移酶 -镍(GST-Ni)亲和层析柱,美国GE公司;异丙基硫代半乳糖苷(IPTG), 美国Sigma公司; 聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂盒, 上海翊圣生物科技有限公司; 3,3′,5,5′-四甲基联苯胺(TMB)显色液, 天根生化科技(北京)有限公司; 辣根过氧化物酶(HRP)标记的羊抗人IgG抗体,上海中科英沐生物有限公司;品系为C57BL/6的小鼠(6~8周龄,雌性,无特定病原体(SPF)级),上海斯莱克实验动物有限公司;免疫过DTT-VEGF或DTT-hTNFmut的小鼠抗血清,上海交通大学生物制造实验室制备。
1.2 包裹葡聚糖的四氧化三铁纳米磁珠合成与活化
合成包裹有葡聚糖反应臂的四氧化三铁纳米磁珠。分别称取5.41 g六水合三氯化铁、 1.99 g四水合氯化亚铁(两者物质的量比为2 ∶1), 将5 g分子量为40 000的葡聚糖溶解于200 mL一缩二乙二醇(DEG)中, 在210 ℃条件下充分搅拌反应30 min后,用蠕动泵以18 mL/min的速率加入20 mL浓度为50 mmol/L氢氧化钠反应液(溶解于DEG溶剂),在210 ℃条件下反应2 h。 待反应产物冷却后, 先后用乙酸乙酯和质量分数为95%的乙醇(体积比为1 ∶1)的混合溶液、质量分数为95%的乙醇和去离子水(体积比为1 ∶1)的混合溶液清洗磁珠,除去未反应物和DEG,最后将终产物分散在去离子水中。在通风橱中,乙腈清洗磁珠,向3 mL磁珠(风干后的质量为294 mg)中边摇晃边逐滴加入3 mL浓度为1 mol/L的溴化氰溶液,反应1 min后逐滴加入3 mL浓度为1.5 mol/L的三乙胺终止液, 终止反应3 min。反应结束后立即将溶液倒入冰浴的清洗液(乙腈和浓度为0.1 mol/L的盐酸,体积比为1 ∶1),用磁铁在底部吸附磁珠,弃上清。 依次用乙腈、 冰水、 偶联缓冲液(浓度为0.1 mol/L的碳酸氢钠和浓度为0.5 mol/L的氯化钠的混合溶液,pH=8.5)清洗磁珠,以供后续与蛋白进行偶联。
1.3 蛋白表达纯化与鉴定
分别将pGEX-6p-1-DTT、pET-28a-hTNFmut转化DH5α感受态细胞,涂平板后于37 ℃培养,待菌落长至适当大小后挑选单克隆摇菌提质粒,确认序列正确后,转化至大肠杆菌BL21感受态,挑选10个单克隆小批量诱导,通过电泳结果选择目的蛋白表达量最高的菌。将高表达菌液发酵至吸光度(OD)值达到0.6后,加入一定浓度为1 mol/L的IPTG溶液至最终浓度为1 mmol/L,16 ℃诱导表达24 h后离心收集菌体,经超声破碎,高速离心分离收集上清,分别过GST-Ni亲和层析柱进行纯化获得目的蛋白。收集洗脱峰,用切割蛋白酶(PSP)或小泛素相关修饰物(SUMO)酶切除谷胱甘肽巯基转移酶 -组氨酸(GST-His)标签后再次过GST-Ni亲和层析柱,收集流穿液进行十二烷基硫酸钠 -聚丙烯酰胺凝胶电泳(SDS-PAGE)和BCA蛋白浓度测定后,冻存于-80 ℃备用。
1.4 DTT蛋白与纳米磁珠偶联
用截留分子量为3 ku的超滤管将DTT体系置换到偶联缓冲液中,与2.4 mL活化后的磁珠混匀,在4 ℃冰柜中旋转孵育20 h后取出上清,BCA法测定偶联前、 后的蛋白浓度,差减法计算偶联到磁珠上的DTT蛋白含量。
1.5 ELISA检测
用包被液稀释DTT、 hTNFmut至质量浓度为1 mg/L, 每孔100 μL,4 ℃孵育过夜。用300 μL封闭液,在37 ℃封闭1 h。 稀释液梯度稀释被测血清, 每孔100 μL, 37 ℃孵育1 h。每孔加100 μL稀释5 000倍HRP标记的羊抗鼠IgG, 37 ℃孵育1 h。底物TMB 37 ℃显色反应10 min。利用浓度为2 mol/L的硫酸终止后, 酶标仪测定波长为450 nm时的吸光值。利用Graphpad Prism 5.0软件,分析实验组与对照组在波长为450 nm条件下的吸光值之比不小于2.1时的最大稀释倍数作为抗血清的效价。
2 结果与分析
2.1 四氧化三铁纳米磁珠的磁响应性
将0.5 mL磁珠混匀在10 mL去离子水中,放置在磁场强度为1.5×106A/m的竖直磁场下,在不同时间点于大约1/2液体高度处取样,测定在波长为600 nm时的透光率,如图1所示。由图可知,1 min之后90%以上的纳米磁珠能够被吸附到试管底,磁响应性较好。

图1 四氧化三铁纳米磁珠的磁响应性
2.2 重组蛋白的表达纯化与鉴定
GST-DTT和His-SUMO-hTNFmut重组质粒的表达菌株经小量试表达筛选得到高表达单克隆后,进行发酵规模表达。通过GST或镍 -金属鳌合亲和层析介质(Ni-IDA)亲和层析纯化以及PSP或SUMO蛋白酶切除标签后,分别获得DTT和hTNFmut蛋白。SDS-PAGE结果显示纯化获得的蛋白分子量符合预期理论值,DTT分子量为20 ku ,hTNFmut分子量为17 ku,分别如图2(a)、(b)所示。灰度分析表明蛋白纯度均在95%以上。BCA法测得DTT、hTNFmut的蛋白质量浓度分别为3.0、 2.1 g/L。

图2 白喉毒素跨膜结构域(DTT)、肿瘤坏死因子第119位的酪氨酸突变为天冬酰胺(hTNFmut)蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测
2.3 纳米磁珠活化以及与DTT供价偶联
纳米磁珠经溴化氰活化反应臂后与DTT蛋白孵育(条件为4 ℃、 16 h),BCA法测定偶联前、 后的蛋白浓度,计算出磁珠上偶联的DTT的蛋白密度,结果如表1所示。图3所示为偶联前、 后的上清液经SDS-PAGE检测的结果,与BCA蛋白定量结果一致,计算可得DTT的偶联效率高达98%。

表1 四氧化三铁纳米磁珠与白喉毒素跨膜结构域(DTT)偶联前、后的蛋白量的变化

泳道1、 2、 3—蛋白分子量标准(蛋白Marker)、偶联前DTT、偶联后DTT。图3 白喉毒素跨膜结构域(DTT)与磁珠偶联前、后上清十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测
2.4 血清学检测
0.2 mL的MP-DTT与3 μL的DTT-VEGF抗血清在4 ℃下旋转孵育16 h, 血清吸附前、后ELISA检测结果如图4(a)所示, 血清中的DTT抗体效价由1 ∶35 840降至0。 图4(b)、 (c)所示为DTT-hTNFmut抗血清在37 ℃条件下与MP-DTT旋转孵育不同时间后的血清ELISA检测结果。从图中可以看出,孵育1 h后的血清稀释3 200倍的条件下,DTT抗体去除率为55.5%,效果最好;但由于血清中DTT抗体水平太高,而磁珠用量又不足,因此血清中DTT抗体去除不彻底。
3 讨论
对于多糖不完全抗原、构象表位或者容易产生免疫耐受的自身抗原,可以通过与载体蛋白交联、或者移植重组来提高其免疫原性。由于载体蛋白本身具有很强免疫原性,产生的抗体滴度是半抗原和靶表位的几十到几百倍,因此会严重干扰疫苗靶抗原抗体检测。本文中建立了利用载体蛋白纳米磁珠作为亲和介质,从血清中去除针对载体抗体的方法,有效地减弱了酶联免疫检测中载体对靶抗原抗体的交叉反应。本文中探究了不同温度和时间对DTT抗体去除效果的影响,结果表明:4 ℃动态孵育16 h能去除90%以上的DTT抗体;37 ℃旋转孵育时间只需1 h。 此外,蛋白偶联量、磁珠用量、血清用量均会影响抗体的去除效果。
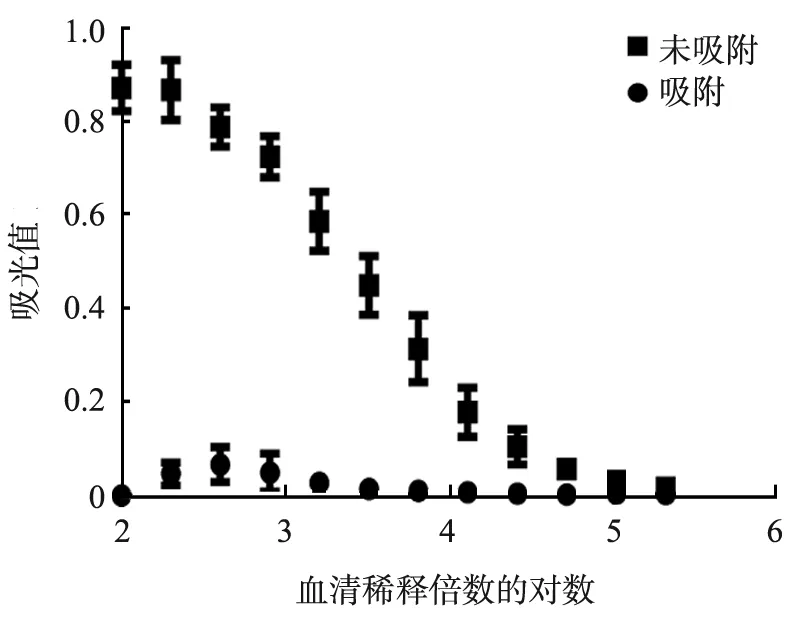
(a)白喉毒素跨膜结构域 -血管内皮生长因子(DTT-VEGF)抗血清经磁性载体 -白喉毒素跨膜结构域(MP-DTT)于37 ℃时吸附前、 后的DTT抗体水平
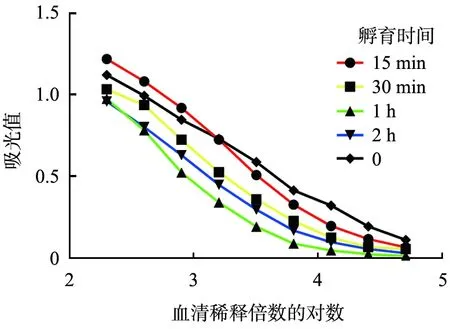
(b)白喉毒素跨膜结构域 -肿瘤坏死因子第119位的酪氨酸突变为天冬酰胺(DTT-hTNFmut)抗血清经MP-DTT于4 ℃时吸附前、 后的hTNFmut抗体水平

(c)DTT-hTNFmut抗血清经MP-DTT于4 ℃时吸附前、 后的DTT抗体水平图4 四氧化三铁纳米磁珠吸附前、 后血清在波长为450 nm条件下的酶联免疫吸附检测(ELISA)
常规的免疫吸附法只适用于能够通过离心沉淀的大颗粒抗原物质,例如菌体抗原抗体的纯化,使用范围有限[13-14]。本文中基于免疫吸附法的原理,制备的磁性载体蛋白抗体阻断剂是一种比表面积较大的磁性载体,在动态的旋转孵育中,给抗原抗体的结合提供了更多的机会,通过磁力克服了大颗粒抗原物质和颗粒吸附剂的分离难题,能充分将血清中的杂抗体去除干净,并实现了快速分离。
临床上利用夹心法进行免疫检测时会面临HA、 RF的干扰, 目前市场上有多款能够降低免疫检测中非特异性结合的抗体阻断剂, 包括美国Meridian Life Science公司开发的一种名为TRU BlockTM的阻断剂。IgM抗体检测是早期和近期感染的重要诊断指标之一,然而IgM抗体丰度较低而IgG丰度高,为了确保检测的精准度,需要阻断含量丰富的IgG抗体和其他非特异性蛋白质。未来可以将纳米磁珠作为固相载体与阻断剂结合,不仅能够有效去除多种干扰,还能够重复利用、 降低成本。
