腺相关病毒标记神经细胞的三光子显微成像
2020-01-06刘鸿吉
仝 申,刘鸿吉,王 科
深圳大学物理与光电工程学院,教育部光电子器件与系统/广东省重点实验室,广东深圳518060
神经细胞是神经系统的重要组成部分,具有感受刺激和传导兴奋的功能,大脑通过神经细胞实现信息的存储和传递.多光子显微成像(multi-photon microscopy, MPM)作为一种非线性光学成像技术[1],广泛用于活体小鼠脑部神经细胞的形态和功能研究[2-8],并且为活体生物的病理学[5, 9](如阿尔兹海默症)和活体生物神经细胞的钙动力学[10-11]研究提供宝贵的观测工具.HORTON等[12-14]演示的1 700 nm波段三光子显微成像技术同时支持三次谐波(third-harmonic generation, THG)和三光子激发荧光(three-photon excited fluorescence, 3PEF)成像两种成像模态,均为神经细胞的形态信息和结构信息获取提供先进的成像方法.
1 700 nm波段三光子显微成像可以进行光学切片(焦点处采集信号,避免焦点外的荧光标记漂白)[15],因此,可实现普通小鼠皮层到白质的完整三维成像.激发光波长越长(近红外),在高度散射的脑组织内散射越小,到达焦点处的激发光信号越强,从而获得更大的成像深度.与之相比,单光子荧光成像需要采用短波长(可见光)激发,受组织散射影响大,无法获得大的成像深度.此外,相比于其他成像技术,如共聚焦显微成像技术[16]、光声成像技术[17]、相干层析成像技术[18]以及核磁共振成像技术[19]等,三光子成像具有亚微米量级的分辨能力和毫米量级的深层组织穿透能力,在普通小鼠脑成像方面具有独特的应用优势.
三光子显微成像中的三次谐波可以匹配脑组织细胞水平的特定几何结构和脂质含量,通过部分相位匹配[7],实现普通小鼠脑组织无标记成像[12],避免荧光成像时染料可能会对细胞产生毒性等问题.三光子显微成像作为一种可视化手段,特别适合普通小鼠脑组织的深层成像[13].然而在普通小鼠脑成像中,白质以下由于受到脑组织散射和水吸收的影响,无法实现普通小鼠海马体三次谐波成像.为此,本文结合脑部注射技术同步研究普通小鼠急性脑切片(在小鼠死后马上进行切片)[20]海马体神经细胞的形态和结构.脑部注射腺相关病毒(AAV9-hSyn-NES-jRGECO1a-WPRE),在特定启动子控制下,实现普通小鼠大脑中星形胶质细胞、少突胶质细胞及神经细胞的长期、稳定表达.
脑部注射技术是活体生物脑科学研究的一种重要手段,已有研究多集中在通过共聚焦显微镜观察脑片中腺相关病毒(adeno-associated virus, AAV)病毒标记细胞的成像上,对于普通小鼠脑片在1 700 nm波段三光子显微成像的研究较少.本研究利用脑部注射AAV9-hSyn-NES-jRGECO1a-WPRE病毒,结合1 700 nm波段的三光子显微成像技术,实现普通小鼠的脑片灰质、海马体神经细胞三光子荧光成像,及脑片的灰质、白质和海马体的三次谐波成像,讨论三光子荧光成像和三次谐波成像的相互关系.本研究提出的多光子显微成像技术为脑科学研究提供一种有效的成像方法.
1 实验装置和方法
1.1 成像实验装置图
成像的实验装置如图1.重复频率为1 MHz、脉宽为500 fs及输出波长为1 550 nm的光纤激光器(FLCPA-02CSZU, Calmar Laser)作为泵浦激光器,其输出光经过聚焦透镜(AC254-100-C-ML, Thorlabs)后,被耦合进入长度为44 cm、纤芯直径为100 μm的棒状光子晶体光纤(PC rod, SC-1500/100-Si-ROD, NKT Photonics)中,通过孤子自频移效应产生峰值波长为1 665 nm的高能孤子.光纤输出端通过透镜(AC254-125-ML, Thorlabs)准直.使用1 635 nm长波通滤光片(1635lpf, Omega Optical)得到干净的1 665 nm孤子.随后激发光经过扫描振镜反射后,经过C-coating扫描透镜(AC254-040-C-ML, Thorlabs)和套筒透镜实现1∶4的扩束.通过965 nm双色镜(T965lpxxrxt-UF1, Chorma)进入工作距离为2 mm、数值孔径为1.05的定制镀膜物镜(XLPLN25XWMP2-SP1700, Olympus),该物镜在1 700 nm波段具有高透过率(~76%),将激发光聚焦到样品上产生三光子信号,三光子信号经定制镀膜物镜收集后通过双色镜反射到不同型号的光电倍增管,实现三次谐波和三光子荧光信号双通道同步检测.装有558/20 nm带通滤光片(FF01-558/20-25, Semrock)的砷化镓光电倍增管(H7422p-50, Hamamatsu)用于检测三次谐波信号,装有593 nm长波通滤光片(FF01-593/LP-25, Semrock)和630/92 nm带通滤光片(FF01-630/92-25, Semrock)的镓砷磷光电倍增管(H7422p-40, Hamamatsu)用于检测外源性荧光标记物的三光子荧光信号.整个显微系统通过ScanImage(Vidrio Technoligies)软件控制,图像采集速率为2 s/幅,图像大小为512×512像素.采用ImageJ(NIH)软件处理获取的图像.
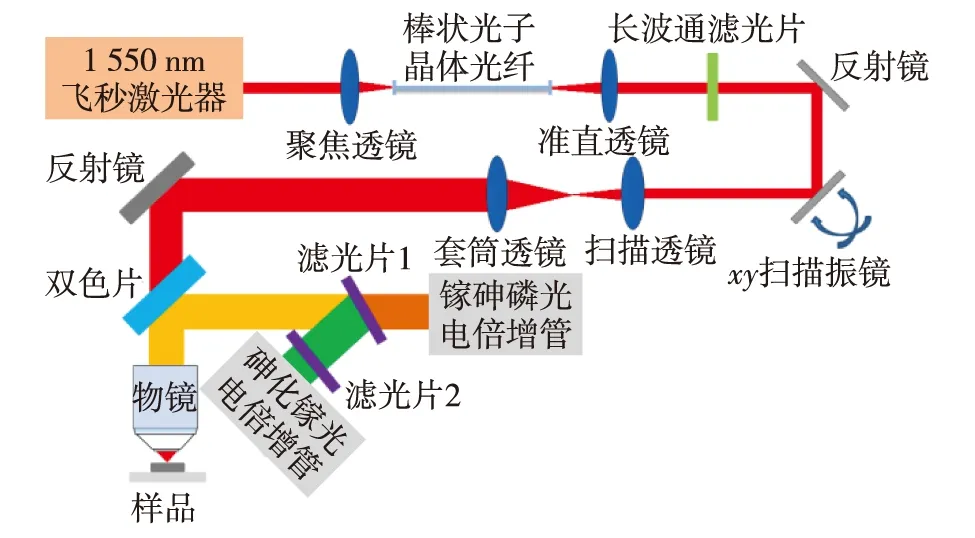
图1 实验装置图
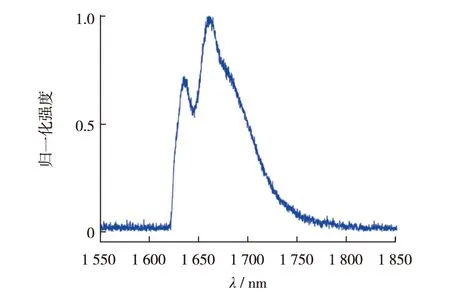
图2 光纤输出端的孤子光谱
图2为光纤输出端的1 665 nm孤子光谱.采用自建的干涉自相关仪定量测量孤子脉宽为79 fs.孤子平均功率为110 mW.
1.2 成年小鼠的立体定向注射及脑片制备
本实验所有研究过程经由深圳大学实验动物伦理委员会同意.本研究使用的BALB/c小鼠由广东省医学实验动物中心提供,选择6周雄性普通小鼠注射,立体定向注射装置如图3.
首先,使用麻醉机(5101IP, RWD Life Science)对小鼠进行麻醉;然后,将小鼠固定在自行搭建的脑固定仪上,通过体温维持系统(ALC-HTP, RWD Life Science)维持小鼠体温(温度设置36 ℃),手术前将小鼠眼睛涂上白凡士林,防止眼睛脱水失明.用手术刀将头皮切开约10 mm,去掉骨膜.使用颅钻(STRONG204, STRONG)和直径0.5 mm的钻头,在颅点侧后方2 mm处钻一个直径500~700 μm的小孔.
利用微电极拉制仪(P-97 Pipette Puller, Sutter Instrument Co.)将硼硅酸玻璃微管(BF120-69-10, Sutter Instrument)拉制成为注射用微针,微针外径1.2 mm,内径0.69 mm,长度10 cm,玻璃微针尖端直径20~25 μm,玻璃微管的ramp值为504,参数设置为:heat: ramp+25; pull: 0; velocity: 150; time: 0; pressure: 200.通过角度台调整小鼠大脑的角度使微针方向垂直于小鼠大脑(图3).利用微量注射仪(PICOSPRITZER III, Parker)和三维位移台(MP285, Sutter Instrument Co.)在小鼠大脑的不同深度(1 500、1 200、900、600及300 μm)注射,注射压力为41.37~55.16 kPa.微针在300 μm位置处停留2 min后离开大脑表面,缝合伤口,并涂上莫匹罗星软膏预防感染.AAV9-hSyn-NES-jRGECO1a-WPRE病毒滴度不低于2.00×1013vg/mL,每个位置注射量为80~100 nL.其中,hSyn为成熟神经元特异性启动子;jRGECO1[21]为红色荧光蛋白钙指示剂;单光子激发波长为540~580 nm.因此,实验注射在普通小鼠大脑皮层和海马体的病毒,能够促使小鼠神经细胞的特异性标记.

图3 立体定位注射装置
3周后,将注射的普通小鼠麻醉并处死,取出小鼠大脑后用磷酸缓冲盐溶液(phosphate buffer saline, PBS)清洗,放入脑模具(0.5 mm 40~75 g,瑞沃德)中,在注射位置对大脑进行常温下切片.
2 脑片的三光子显微成像
采用上述实验装置对普通小鼠脑片无标记三次谐波成像结果如图4(a)—(c).由于神经细胞体含有小的细胞器,其结构在20~100 nm尺度,这些较小的结构不会产生明显的三次谐波信号[7],因此,在图4(a)的P1位置无法观察到神经细胞的三次谐波图像,即神经细胞位置对应的三次谐波图像呈现出“黑洞”形态.这一实验结果与文献[7]的报道一致.
图4(d)—(f)对应同步采集的三光子荧光图像.图4(d)中P2位置的三光子荧光成像结果可以清楚显示标记的神经细胞.因此,实验证明通过AAV9-hSyn-NES-jRGECO1a-WPRE病毒,可对普通小鼠脑中的神经细胞进行标记.结合1 700 nm波段三光子激发,可在该波段实现神经细胞的三光子荧光成像,如图4(d)—(f).由成像结果可知,腺相关病毒(AAV9-hSyn-NES-jRGECO1a-WPRE)主要对神经细胞的细胞质进行标记.
三光子荧光成像结果还表明,该腺相关病毒(AAV9-hSyn-NES-jRGECO1a-WPRE)主要对细胞质进行标记(细胞核无荧光信号).该成像结果存在荧光信号亮度较低的问题,认为是AAV病毒标记效率较低所导致.
以下分析三次谐波与三光子荧光成像结果的相互关系.图4(a)和(d)中P1和P2对应位置的三次谐波和三光子荧光图像互补.图4(b)为灰质和白质交界处的三次谐波成像结果.白质处的髓鞘细胞膜[22],由于髓鞘拥有类脂质结构可以产生三次谐波信号.图4(e)是图4(b)位置处的三光子荧光成像.通过对比图4(b)与图4(e)可见,该标记物只能标记神经细胞,无法标记髓鞘,因为髓鞘是寡突细胞而非神经细胞的附属结构.图4(c)和(f)是海马体CA1层的三次谐波成像和三光子荧光成像.在脑片中可以清楚看到海马体丝状结构(神经纤维)的三次谐波成像.以上结果表明,三次谐波对结构敏感,能够实现普通小鼠脑片灰质、白质和海马体等结构成像;三光子荧光能够实现脑片灰质和海马体神经细胞成像.
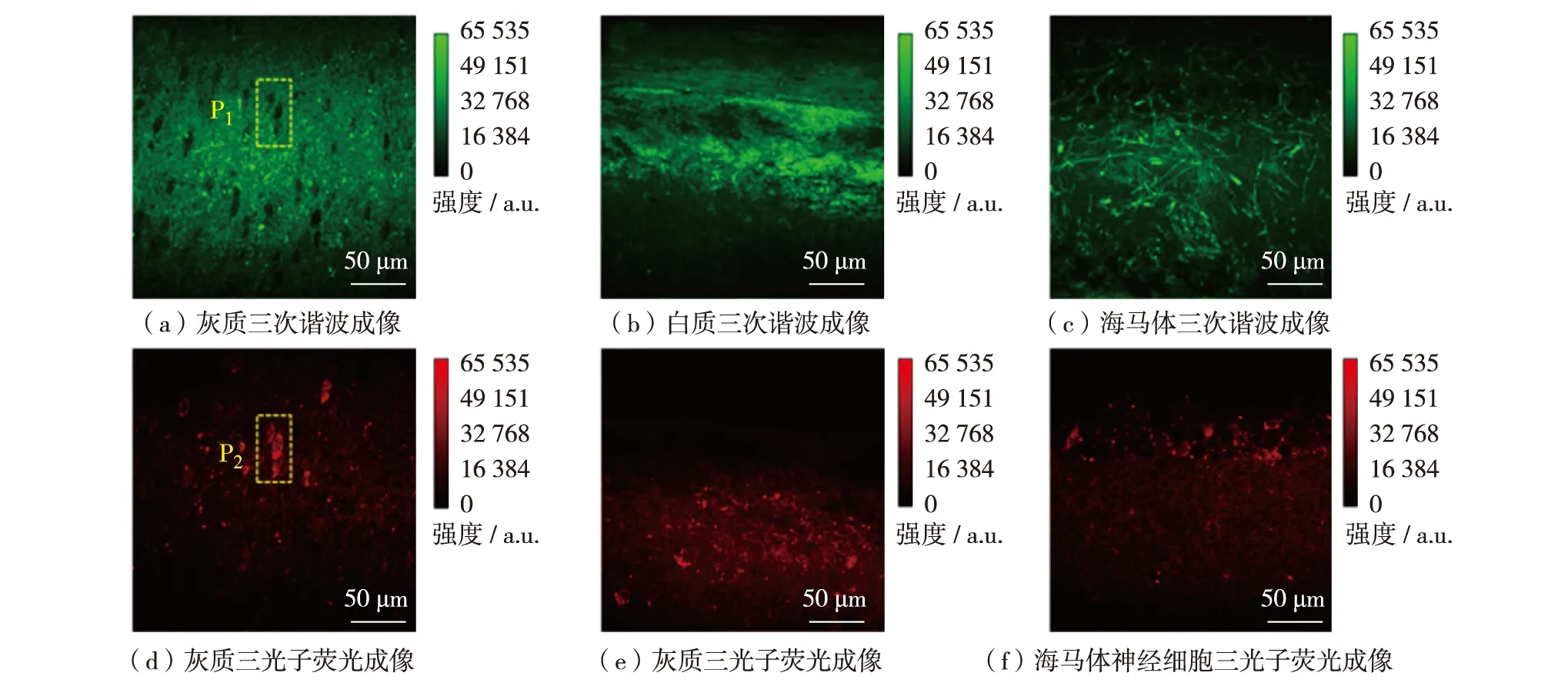
图4 脑片三光子成像
结 语
通过1 700 nm波段三光子显微成像技术,结合脑部注射技术, 实现AAV9-hSyn-NES-jRGECO1a-WPRE病毒对小鼠大脑灰质和海马体的神经细胞特异性标记,在普通小鼠急性脑切片中实现从灰质到海马体的三光子荧光和三次谐波双通道同时成像.对小鼠大脑注射腺相关病毒标记神经细胞,相应三光子荧光成像揭示了细胞结构,采集的三次谐波成像可以提供互补的定位信息.研究成果为神经脑科学,特别是神经细胞研究提供一种新颖的可视化技术.今后将开展活体普通小鼠脑部神经细胞成像的相关实验研究.
