海水胁迫下藜麦根系形态发育及生理响应
2019-12-24梁晓艳顾寅钰李萌付娆张海洋郭新兵王向誉郭洪恩
梁晓艳 顾寅钰 李萌 付娆 张海洋 郭新兵 王向誉 郭洪恩

摘要:篩选和培育耐盐植物是开发利用滨海盐渍土的重要途径。本试验在砂培条件下,研究不同稀释配比的海水(0、20%、30%、40%、50%、60%和70%)对藜麦植株生长、根系形态结构及生理特性的影响。结果表明:低于30%海水胁迫下,藜麦地上部生长受影响较小,株高和叶面积有所降低,茎粗和地上部生物量并没有受到显著影响,而根系总根长、最大根长、根表面积、根体积、根系平均直径及根尖数均表现出降低趋势;随着海水浓度的进一步增加,地上部和地下部生长均受到不同程度的抑制,其中对地下部的抑制作用大于地上部,根冠比逐渐降低。与根系形态发育相比,藜麦根系生理活性的变化在耐盐过程中起着更为重要的作用,根系活力随海水浓度的增加依次升高,尤其在高浓度海水胁迫下,表现出较强的根系活力。根系超氧化物歧化酶(SOD)和过氧化物酶(POD)活性随着海水浓度的增加先升高后降低,分别在30%和40%浓度下达到最大值;过氧化氢酶(CAT)活性呈逐渐升高的趋势;丙二醛(MDA)含量在0~40%海水浓度下较为稳定,大于50%时显著上升。盐胁迫下藜麦根系渗透调节物质含量发生显著变化,可溶性蛋白含量随海水浓度的增加呈先升后降趋势,40%海水浓度下达到最大值;根系脯氨酸含量呈逐渐升高的趋势。
关键词:海水胁迫;藜麦;根系形态;根系生理;生理响应
中图分类号:S512.9 文献标识号:A 文章编号:1001-4942(2019)11-0028-07
Morphological Development and Physiological
Response of Quinoa Roots under Seawater Stress
Liang Xiaoyan, Gu Yinyu, Li Meng, Fu Rao, Zhang Haiyang, Guo Xinbing, Wang Xiangyu, Guo Hongen
(Sericultural Research Institute of Shandong Province, Yantai 264002, China)
Abstract Selection and cultivation of salt-tolerant plants is an important way to develop and utilize coastal saline soil. In this study, the effects of different dilution ratio of seawater (0, 20%, 30%, 40%, 50%, 60%, 70%) on the growth, morphological structure and physiological characteristics of the root system of quinoa were studied under the condition of sand culture. The results showed that under seawater stress of less than 30%, the above-ground growth of quinoa was less affected, plant height and leaf area decreased, stem diameter and above-ground biomass were not significantly affected, while the total root length, maximum root length, root surface area, root volume, average root diameter and root tip numbers showed a decreasing trend. With the further increase of seawater concentration, the growth of above-ground and under-ground parts were inhibited to varying degrees, among which,the inhibition to under-ground parts was greater than that of above-ground parts, and the root-shoot ratio decreased gradually. Compared with the development of root morphology, the change of physiological activity of quinoa root system played a more important role in salt tolerance. The root activity increased with the increase of seawater concentration, especially under high seawater stress. The activity of superoxide dismutase (SOD) and peroxidase (POD) in roots first increased and then decreased with the increase of seawater concentration, reaching the maximum value at 30% and 40% concentration, respectively. The activity of catalase (CAT) increased gradually, and the content of malondialdehyde (MDA) in roots was stable at 0 ~ 40% seawater concentration, but increased significantly when it was higher than 50%. The content of osmoregulation substance in quinoa root system changed significantly under salt stress. The content of soluble protein increased firstly and then decreased with the increase of seawater concentration and reached the maximum value under 40% seawater concentration. The content of proline in root system increased gradually.
Keywords Seawater stress; Quinoa; Root morphology; Root physiology; Physiological response
盐渍土是地球上广泛分布的一种土壤类型,约占陆地总面积的25%,总计约10×108 hm2,分布在世界各大洲,主要集中在欧亚大陆、非洲和北美西部。我国各类盐渍土面积约3 600×104 hm2,主要分布在东北、华北、西北内陆地区及长江以北沿海地带[1]。滨海盐土在我国盐渍化土壤中占有很大比例。黄河三角洲是我国三大河口三角洲之一,土壤主要以滨海盐土为主,具有巨大的土地开发利用潜力。而滨海盐土中较高的含盐量是农作物产量提高的重要限制因子,因此,筛选和培育能够耐受高盐环境并有较高产量和优良品质的作物品种是提高滨海地区作物产量和效益的重要途径[2]。
藜麦(Chenopodium quinoa)是苋科藜亚科藜属一年生双子叶草本植物,起源于南美洲安第斯山脉,距今已有7 000多年历史,是古代印第安人的传统食物,被印加民族称为“粮食之母” [3]。藜麦籽粒营养丰富,富含蛋白质、氨基酸、维生素、矿物质,是唯一一种单体植物即可满足人体基本营养需求的食物,被联合国正式推荐为最适宜人类的完美全营养食品[4]。藜麦是一种兼性盐生植物,不仅营养价值高,而且抗逆性强,具有耐寒、耐旱、耐盐碱、耐瘠薄等特性[5,6]。因此,开展藜麦的耐盐性鉴定,探索其耐盐阈值及对盐渍环境的适应性机理,对滨海盐土地区藜麦的引种栽培具有重要意义。目前,关于盐胁迫对藜麦萌发及幼苗生长影响的研究已有不少报道[7-9],但大多集中于对地上部分的研究,而关于盐渍逆境下藜麦根系的形态及生理响应仍缺乏深入研究;另外,以往研究也多采用单盐NaCl处理来模拟盐胁迫,不能切实反映滨海盐渍土的盐分组成,因为其盐分组成与海水一致。因此,本研究从植株地上部生长、根系形态结构及生理响应几个方面来探讨藜麦对海水胁迫的耐受性及适应性,以期为滨海盐土地区藜麦的引种栽培提供理论依据。
1 材料与方法
1.1 试验材料
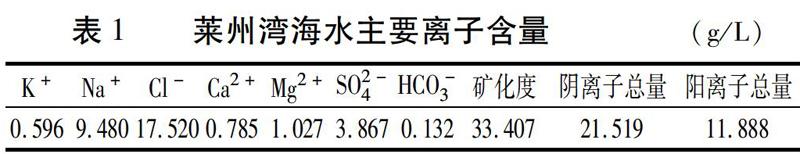
试验所用藜麦种子由山东省农业科学院种质资源中心提供。所用海水由固体海盐溶解而成,固体海盐由莱州湾天然海水(100%)蒸发所得,基本理化性质见表1。
1.2 试验方法
选取颗粒饱满、大小相近的藜麦种子在75%酒精中消毒5 min,清水冲洗干净后播种于装有石英砂且下部有孔的塑料盆中,种子出苗后用1/2 Hoagland营养液浇灌。藜麦幼苗长至二叶期进行疏苗,每盆保留1株。四叶期分别进行不同浓度海水胁迫处理,共设6个浓度梯度,即全海水浓度的20%、30%、40%、50%、60%和70%,每个处理20盆。用固体海盐溶解所得的不同浓度海水作溶剂溶解配制1/2 Hoagland培养液,以淡水配制的1/2 Hoagland营养液为空白对照(CK)。各处理统一培养25天后测定藜麦植株生长发育、根系形态结构及生理特性等相关指标。整个培养过程在自然通风良好的防雨棚内进行,白天温度(25±3)℃,夜間(20±3)℃。
1.3 测定指标及方法
1.3.1 根系形态结构相关指标的测定 将根系从塑料盆内完整取出,清水冲洗干净后用Epson V850 Prophoto 扫描仪对根系进行扫描。扫描时将根系放入特制的透明托盘内,加入1/2的水,用镊子将根系分散开,避免根系分支的互相缠绕。扫描后保存图像,采用WinRHIZO PRO 2017 根系分析系统软件(Regent Instruments Inc8,Canada)分析根系表面积、根系体积、总根长、根系平均直径、根尖数等形态参数,最大根长用直尺测量。
1.3.2 植株生长发育指标的测定 分别将植株根、茎与叶装于牛皮纸袋中,于105℃杀青1 h,80℃烘干48 h 至恒重,称得干重。根冠比=根系干重/地上部干重。藜麦株高和茎粗分别采用直尺和游标卡尺直接测定。植株叶面积采用打孔法进行测定。
1.3.3 根系生理特性的测定 根系活力采用TTC 法;超氧化物歧化酶(SOD)活性采用氮蓝四唑法;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性测定参照张志良等[10]的方法;丙二醛(MDA)含量采用硫代巴比妥酸法测定[10];可溶性蛋白含量测定采用考马斯亮蓝比色法;脯氨酸含量采用酸性茚三酮法测定[10]。
1.4 数据处理
用Microsoft Excel 2003和SPSS 17.0进行数据统计分析与作图,结果以“平均值±标准差”表示,采用LSD 法进行差异显著性检验(α=0.05)。
2 结果与分析
2.1 不同浓度海水胁迫对藜麦植株生长发育及生物量分配的影响
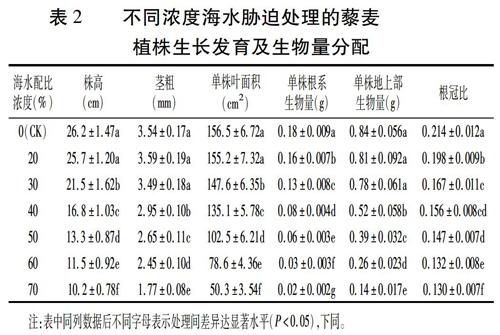
由表2可以看出,在不同浓度海水胁迫处理下,藜麦植株生长发育及生物量分配表现出明显差异。20%和30%海水胁迫对藜麦地上部生长影响相对较小,株高和叶面积有所降低,但茎粗和生物量并没有显著下降;与地上部相比,藜麦根系对盐胁迫响应较为敏感,根系生物量表现出不同程度的降低,根冠比下降,且达显著水平。40%海水胁迫下,藜麦地上部和地下部生长均受到不同程度的抑制,其中,地上部生物量与对照相比降低38.1%,而根系生物量与对照相比降低55.6%。随着海水浓度的进一步增加,地上部和地下部生长受抑制程度加重,对根系的抑制作用大于对地上部的抑制,根冠比逐渐降低。由此可以看出,在低于30%海水浓度条件下,藜麦植株地上部生长基本不受影响,随着海水浓度的升高其地上部和地下部生长均受到抑制,形态结构发生改变,根冠比降低。
2.2 不同浓度海水胁迫对藜麦根系形态发育的影响
由表3可以看出,不同浓度海水处理对藜麦根系形态发育均有不同程度的抑制作用,根系形态结构发生改变。与对照相比,20%海水浓度下,根系总长、最大根长和根系平均直径分别降低5.8%、8.8%和4.4%,根系表面积、根系体积及根尖数分别降低15.6%、22.2%、23.2%;30%海水浓度下,根系总长、最大根长及根系直径分别下降13.0%、17.7%、16.7%,根系表面积、根系体积及根尖数分别降低28.0%、40.3%、39.6%;随着海水浓度的进一步增加,根系生长的抑制程度加剧,70%海水胁迫下,根系总根长、最大根长、根系表面积、根系体积、根系平均直径及根尖数降幅分别为:68.9%、56.6%、78.8%、85.5%、31.4%和76.0%,其中,根系体积降幅最大,其次是根系表面积,根系平均直径降幅最小。这说明盐胁迫会抑制藜麦根系的伸长与扩大,改变根系的形态结构,减少根系的生物量。
2.3 不同浓度海水胁迫对藜麦根系活力的影响
由图1可以看出,随海水浓度增加,藜麦根系活力呈逐渐上升趋势。20%海水胁迫下,根系活力变化较小,与对照无显著差异;30%海水胁迫下,藜麦根系活力显著升高,增幅52.4%;30%~50%海水浓度之间藜麦根系活力变幅较小,处理之间差异不显著;随着海水浓度的进一步增加,根系活力继续提升:60%海水浓度下藜麦根系活力显著升高,70%海水胁迫下根系活力达到最大值,与对照相比提高90.3%。这说明高浓度海水胁迫下藜麦根系活力大幅度提高,可能是高盐浓度下藜麦的一种生理适应性反应,即通过调节使根系活力显著提高,以此来保证藜麦对矿质养分的吸收。
不同字母表示处理间差异达显著水平(P<0.05),下同。
2.4 不同浓度海水胁迫对藜麦根系抗氧化酶活性及MDA含量的影响
2.4.1 对藜麦根系SOD、POD、CAT活性的影响 图2显示,不同浓度海水胁迫下,藜麦根系SOD、POD、CAT活性变化表现出不同规律。由图2A可见,对照根系SOD活性最低,随着海水浓度的增加,根系SOD活性呈先升高后降低再升高的波浪形变化趋势,即30%浓度海水胁迫下根系SOD活性最高,30%~60%海水浓度范围内SOD活性逐渐降低,海水浓度70%时又急剧升高。由图2B可以看出,藜麦根系POD活性随海水浓度的增加呈先升后降再升的波浪形变化趋势,40%浓度海水胁迫下根系POD活性达到最大值。由图2C可以看出,藜麦根系CAT活性随海水浓度增加呈逐渐升高趋势,超过40%浓度的海水胁迫CAT活性显著提升。这说明在浓度逐渐增加的海水胁迫条件下,根系CAT对盐胁迫响应较为敏感,可能在根系抗氧化过程中发挥着更重要的作用。
2.4.2 对藜麦根系MDA含量的影响[HTSS]图3显示,不同浓度海水胁迫下,藜麦根系MDA含量表现不同。较低海水浓度(20%、30%)胁迫下,根系MDA含量与对照无显著差异;随海水浓度的进一步增加,根系MDA含量呈逐渐上升趋势,40%~70%海水浓度范围内MDA含量均显著高于对照;60%和70%海水浓度胁迫下,MDA含量大幅增加,分别比对照高94.0%和120.8%。这说明低浓度海水胁迫下,根系MDA积累量较少,膜脂过氧化程度较低,大于50%的海水胁迫藜麦根系MDA含量显著升高,膜脂过氧化程度加剧。
2.5 不同浓度海水胁迫对藜麦根系渗透调节物质的影响
2.5.1 对藜麦根系可溶性蛋白含量的影响 如图4所示,随海水浓度增加藜麦根系可溶性蛋白含量呈先升高后降低趋势。20%、30%和40%浓度海水胁迫下藜麦根系可溶性蛋白含量与对照相比分别提高5.25%、14.8%和15.4%,之后随着海水浓度的进一步增加,根系可溶性蛋白含量呈下降趋势,50%和60%浓度海水胁迫下根系可溶性蛋白含量略有下降,但差異不显著,70%浓度海水胁迫下根系可溶性蛋白显著下降。这说明低浓度海水胁迫下,根系可溶性蛋白含量增加,有利于根系的渗透调节作用;海水浓度超过一定限度,可溶性蛋白含量降低,可能与高浓度盐胁迫下蛋白合成受阻有关。
2.5.2 对藜麦根系脯氨酸含量的影响 图5显示,不同浓度海水处理下,藜麦根系脯氨酸含量随海水浓度增加呈逐渐升高趋势。淡水(CK)条件下,藜麦根系脯氨酸含量最低;20%浓度海水胁迫下比对照增加39.4%,差异显著;30%、40%、50%、60%、70%浓度海水条件下,根系脯氨酸含量分别比对照高1.00、1.25、1.75、1.89、2.50倍。由此可见,藜麦根系中脯氨酸对不同浓度海水胁迫反应较为敏感,高浓度海水胁迫下根系较高的脯氨酸含量有利于缓解盐胁迫对根系造成的伤害。
3 讨论与结论
3.1 海水胁迫对藜麦植株生长发育及生物量分配的影响
对于非盐生植物而言,生长抑制是植物在盐渍逆境下的综合表现,一方面,植物通过减缓生长、改变形态特征、重新构建生物量分配格局来维持其在逆境下的存活;另一方面,植物应对盐渍逆境(如排Na+、合成渗透调节物质等)消耗更多的能量,使其用于生长的能量相应减少[11-14]。本研究中,在小于或等于30%浓度海水条件下,藜麦地上部生长受影响较小,株高和叶面积有所降低,茎粗和地上部生物量并没有受到显著影响,这说明30%海水浓度是保证藜麦地上部正常生长的一个临界值;随着海水浓度的进一步增加,地上部和地下部生长均受到不同程度的抑制,对根系的抑制程度大于地上部,根冠比逐渐降低。根冠比反映了植物在逆境条件下的生物量分配策略,植物不同部位对盐分的敏感性不同,其生物量的分配也发生改变[15,16];根冠比降低说明藜麦在海水胁迫下根系的敏感度要高于地上部,这与滨海盐生植物碱蓬和盐角草的研究结果相似[17]。这说明藜麦对盐渍的适应策略可能与盐生植物更有相似之处,但是二者对盐离子吸收、转运方面的差异还有待进一步研究。
3.2 海水胁迫对藜麦根系形态特征的影响
根系是吸收养分和水分的重要器官,也是最早感受逆境胁迫信号和最直接的受害部位[18]。根系形态在土壤中的生长具有可塑性,在逆境下能够通过改变其形态与分布(即根系构型)来适应不利环境[19]。因此,根系的生长发育状况及对盐胁迫的耐受程度对植物整体的耐盐能力至关重要。根长、根表面积等形态学参数可以反映根系吸收水分和养分的强度和范围[20]。有研究表明,盐胁迫可以抑制根系的伸长和侧根发育,使根系总长、根表面积、根体积等参数有所下降[20,21],但也有研究显示盐胁迫能够刺激侧根的发生[17,22]。本研究结果表明,不同浓度(20%~70%)海水胁迫对藜麦根系形态发育均表现出不同程度的抑制作用,其中根长、根表面积、根体积、根尖数及根系平均直径均显著降低,且随着海水浓度的增加降幅加大。这说明藜麦根系形态结构对海水胁迫的反应较为敏感,海水胁迫抑制根系的伸长与扩大,降低根系的吸收能力。根系形态结构的改变也是藜麦对盐渍逆境的一种适应性反应,尤其是在高盐环境下,藜麦根尖数及根系表面积的下降可以限制盐离子的过分吸收,同时也减少盐分向地上部的运输,从而避免地上部受盐分的伤害,本结论与在芦苇上的研究结果相似[23]。
3.3 海水胁迫对藜麦根系活力的影响
根系活力是衡量根系新陈代谢活动强弱的重要指标,也是判断植物对逆境适应能力的重要指标[24]。研究表明,干旱、盐及盐碱胁迫均能引起根系活力的增加,根系活力增加、呼吸速率加快可以认为是植物对逆境适应过程中发生的反应[25]。盐胁迫下盐生植物根系活力增加具有两个方面的意义,一则这是盐生植物耐盐性响应的积极表现;二则是以降低生长为代价,增强抵抗盐胁迫的能力[26]。本研究结果表明,随着海水浓度的增加,藜麦根系活力依次升高,70%浓度海水胁迫下藜麦根系活力达到最大值。由此可見,藜麦根系的耐盐生理机制更接近于盐生植物,在高浓度海水胁迫下代谢活动不但没有降低,反而显著增强。藜麦根系活力的提高有利于保证养分的吸收,以此来维持正常的生理代谢需求。
3.4 海水胁迫对藜麦根系抗氧化酶活性及渗透调节物质的影响
植物正常生长条件下,其体内自由基的产生和清除处于动态平衡,当植物遭受逆境胁迫时,这种平衡被打破,往往发生膜脂过氧化作用,积累大量的过氧化产物[27]。MDA 是主要的膜脂过氧化产物,其含量的积累会对生物膜造成伤害[28]。SOD 是植物体内消除O·-2的关键酶,POD 可清除线粒体或胞浆中产生的H2O2,CAT主要分布在过氧化物酶体中,胁迫条件下可将高浓度的H2O2清除[29]。本研究结果表明,根系SOD、POD活性在20%~60%浓度海水范围内,均随着海水浓度的增加呈先升高后降低趋势,但二者活性均在70%浓度海水下又出现上升趋势,而根系CAT活性随着海水浓度的增加呈逐渐上升趋势,不同浓度处理之间差异多达显著水平;根系SOD和CAT活性随着海水浓度的增加变幅较大,可见,这两者在根系活性氧清除过程中发挥着主要作用。本结论与其它研究结果有所不同[3,30],可能与不同植物保护酶代谢差异有关。从根系MDA含量来看,低浓度海水胁迫下,MDA含量较稳定,说明自由基的产生和清除处于动态平衡;随着海水浓度的增加MDA含量逐渐上升,超过40%的海水胁迫藜麦根系MDA含量显著增加。这说明超过40%的海水胁迫会给藜麦根系生物膜造成严重伤害,因此这也是藜麦对海水胁迫耐受性的一个生理临界值。
渗透调节是植物在盐渍逆境下,降低渗透势和维持一定膨压,继而抵御盐胁迫的重要生理适应性反应,其渗透调节能力的提高是植物耐盐性增强的重要机制。可溶性蛋白质是植物的渗透调节物质之一[31]。本研究结果表明,随着海水浓度的增加,藜麦根系可溶性蛋白含量呈先升高后降低趋势,30%浓度海水胁迫下达到最大值,30%~60%海水浓度范围内含量变化较小,70%海水浓度下显著降低。这说明低浓度海水胁迫藜麦根系可溶性蛋白的增加有利于根系渗透压的调节,而高浓度海水胁迫下根系蛋白合成受阻、结构遭到破坏、含量降低,对根系的渗透调节作用减弱。脯氨酸是植物适应盐胁迫的重要渗透调节物质,有研究认为脯氨酸积累的快慢能体现植物对盐胁迫反应的敏感程度,脯氨酸含量的增加,有利于维持细胞的膨压,同时可以保护酶和膜系统免受毒害[31,32]。本研究结果表明,正常条件下,藜麦根系脯氨酸含量处于较低水平,随着海水浓度的增加,脯氨酸含量呈逐渐上升趋势,各处理间差异均达到显著水平。这说明根系脯氨酸对海水胁迫的响应非常敏感,它对藜麦根系渗透压的调节起主要作用,这与其它作物的研究结果基本一致[32,33]。因此,根部作为最先遭受盐胁迫的部位,其脯氨酸含量可以作为判断植物耐盐性的一个重要指标。
参 考 文 献:
[1]李建国,濮励杰,朱明,等. 土壤盐渍化研究现状及未来研究热点[J]. 地理学报,2012,67(9):1233-1245.
[2]杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报,2008,45(5):837-845.
[3]杨发荣,刘文瑜,黄杰,等. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价[J]. 草业学报,2017,26(12):77-88.
[4]Repo-carrasco-Valencia R,Espinoza C,Jacobsen Sven-Eric. Nutritional value and use of the Andean crops quinoa (Chenopodium quinoa) and Kaiwa (Chenopodium pallidicaule)[J]. Food Reviews International,2003,19(1/2):179-189.
[5]肖正春,张广伦. 藜麦及其资源开发利用[J]. 中国野生植物资源,2014,33(2):62-66.
[6]李丽丽,姜奇彦,牛风娟,等. 藜麦耐盐机制研究进展[J]. 中国农业科技导报,2016, 18(2):31-40.
[7]Koyro Hans-Werner,Eisa S S. Effect of salinity on composition,viability and germination of seeds of Chenopodium quinoa Willd[J]. Plant Soil,2008,302(1/2):79-90.
[8]Hariadi Y,Marandon K,Tian Y. Ionic and osmotic relations in quinoa (Chenopodium quinoa Willd. ) plants grown at various salinity levels[J]. Journal of Experimental Botany,2011,62(1):185-193.
[9]杨宏伟,刘文瑜,沈宝云,等. NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响[J]. 草业学报,2017,26(8):146-153.
[10]张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 北京:高等教育出版社,2009: 100-228.
[11]Alaoui-Soosé B,Sehmer L,Barnola P,et al. Effect of NaCl salinity on growth and mineral partitioning in Quercus robur L.,a rhythmically growing species[J]. Trees,1998,12(7):424-430.
[12]Grotkopp E,Rejmáne k M,Rost T L. Toward a causal explanation of plant invasiveness:seedling growth and life-history strategies of 29 pine (Pinus) species[J]. American Naturalist,2002,159(4):396-419.
[13]Grundmann O,Nakajima Jun-lchiro,Seo S,et al. Anti-anxiety effects of Apocynum venetum L. in the elevated plus maze test[J]. Journal of Ethnopharmacology,2007,110(3):406-411.
[14]Liu Z X,Zhang H X,Yang S,et al. Effects of NaCl stress on growth and photosynthetic characteristics of Elaeagnus angustifolia seedlings[J]. Scientia Silvae Sinicae,2014,50(1):32-40.
[15]Bernstein N,Meiri A,Zilberstaine M. Root growth of avocado is more sensitive to salinity than shoot growth[J]. Journal of the American Society for Horticultural Science,2004,129(2):188-192.
[16]王樹凤,胡韵雪,孙海菁,等. 盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].生态学报,2014,34(4):1021-1029.
[17]弋良朋,王祖伟. 盐胁迫下3种滨海盐生植物的根系生长和分布[J]. 生态学报,2011, 31(5):1195-1202.
[18]Cramer G R,Luchli A,Epstein E. Effects of NaCl and CaC12 on ion activities in complex nutrient solutions and root growth of cotton[J]. Plant Physiology,1986,81(3):792-797.
[19]Jia Y B,Yang X,Feng Y,et al. Differential response of root morphology to potassium deficient stress among rice genotypes varying in potassium efficiency[J]. Journal of Zhejiang University B,2008,9(5):427-434.
[20]Srinivasrao C H,Benzuibi A,Eshel A,et al. Effects of salinity on root morphology and nutrient and acquisition by Faba Beans (Vicia faba L.)[J]. Journal of the Indian Society Science,2004,52(2):184-191.
[21]姚静,施卫明. 盐胁迫对番茄根形态和幼苗生长的影响[J]. 土壤,2008,40(2): 279-282.
[22]He X J,Mu R L,Cao W H,et al. AtNAC2,a transcription factor downstream of ethylene and auxin signaling pathways,is involved in salt stress response and lateral root development[J]. The Plant Journal,2005,44(6):903-916.
[23]Mauchamp A,Mesléard F. Salt tolerance in Phragmites australis populations from coastal Mediterranean marshes[J]. Aquatic Botany,2001,70(1):39-52.
[24]李鲁华,李世清,翟军海,等. 小麦根系与土壤水分胁迫关系的研究进展[J]. 西北植物学报,2001,21(1):1-7.
[25]斯琴巴特尔,吴红英. 不同逆境对玉米幼苗根系活力及硝酸还原酶活性的影响[J]. 干旱地区农业研究,2001,19(2):67-70.
[26]弋良朋,马健,李彦. 盐胁迫对 3 种荒漠盐生植物苗期根系特征及活力的影响[J]. 中国科学D辑,2006,36 (Z2):86-94.
[27]张怀山,赵桂琴,栗孟飞,等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答[J]. 草业学报,2014,23(2):180-188.
[28]张晓晓,张钰,徐浩杰,等. 河西走廊三大内陆河流域出山径流变化特征及其影响因素分析[J]. 干旱区资源与环境,2014,28(4):66-72.
[29]张边江,唐宁,华春,等. 海水胁迫下马齿苋光合及抗氧化生理特性研究[J]. 草地学报,2015,23(4):878-882.
[30]周丽,郎多勇,张文晋,等. NaCl胁迫对银柴胡生长及生理生化特性的影响[J]. 中草药,2014,45(19):2829-2833.
[31]姚佳,刘信宝,崔鑫,等. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响[J]. 草业学报,2015,24(5):91-99.
[32]李源,刘贵波,高洪文,等. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应[J]. 草业学报,2010,19(4):79-86.
[33]张永锋,梁正伟,隋丽,等. 盐碱胁迫对苗期紫花苜蓿生理特性的影响[J]. 草业学报, 2009,18(4):230-235.
收稿日期:2019-07-23
基金项目:山东省农业科学院农业科技创新工程项目(CXGC2016B10,CXGC2018F6);山东省农业重大应用技术创新项目(201706);中央引导地方科技发展专项资金项目(201708);烟台市科技计划项目(2018ZHGY081)
作者简介:梁晓艳(1984—),女,博士,助理研究员,主要研究方向为植物逆境生理与生态。E-mail:Liangxiaoyan1001@163.com
