甘薯贮藏根淀粉代谢相关基因表达分析
2019-12-24秦桢李爱贤侯夫云董顺旭王庆美
秦桢 李爱贤 侯夫云 董顺旭 王庆美
摘要:甘薯淀粉含量高,是一种重要的粮食作物和工业原料。然而,甘薯贮藏根发育过程中淀粉代谢途径相关基因昼夜周期变化规律尚不完全清楚。为探讨甘薯贮藏根发育过程中淀粉代谢相关基因昼夜周期变化规律,本研究以4个不同淀粉含量的甘薯品种为试验材料,采用qRT-PCR法对淀粉代谢相关基因全天的表达模式进行分析。结果表明:IbAGPa、IbSS、IbGBSSⅠ、IbSBEⅠ、IbSBEⅡ、Ibα-amylase基因的表达均呈现先升高后降低的趋势。淀粉合成相关基因(IbAGPa、IbSS、IbGBSSⅠ、IbSBEⅠ、IbSBEⅡ)的表达高峰出现在12时到15时,淀粉降解相关基因(Ibα-amylase)的表达高峰出现在15时之后。在不同淀粉含量的甘薯品种中,淀粉代谢相关基因的表达在整个昼夜周期内都发生周期性的变化,且表达趋势相似。本研究进一步丰富了我们对甘薯贮藏根淀粉代谢调控机制的认识。
关键词:甘薯;贮藏根;淀粉代谢相关基因;qRT-PCR;昼夜周期变化
中图分类号:S531:S786文献标识号:A文章编号:1001-4942(2019)11-0008-05
Expression of Starch Metabolism Related
Genes in Storage Roots of Sweet Potato
Qin Zhen, Li Aixian*, Hou Fuyun, Dong Shuxu, Wang Qingmei
(Crop Research Institute, Shandong Academy of Agricultural Sciences/Scientific Observing and
Experimental Station of Tuber and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture, Jinan 250100, China)
Abstract Sweet potato is an important food crop and industrial raw material because of its high starch content. In order to explore the diurnal cycle of genes related to starch metabolism pathway in the development of storage roots of sweet potato, four cultivars with different starch content were selected as experimental materials. The expression patterns of starch metabolism related genes were analyzed by qRT-PCR. The results showed that genes of IbAGPa, IbSS, IbGBSSⅠ, IbSBEⅠ, IbSBEⅢ and Ibα-amylase had an increased expression followed by a decreasing trend. The expression peak of the genes related to starch synthesis (IbAGPa, IbSS, IbGBSSⅠ, IbSBEⅠ and IbSBEⅡ) appeared at 12 noon to 3 pm, and the expression peak of the starch degradation-related gene (Ibα-amylase) appeared after 3 pm. The results showed that the expression of starch metabolism related genes changed periodically throughout the diurnal cycle and that of the expression was similar in sweet potato cultivars with different starch contents. This study further enriched our understanding of the regulation mechanism of starch metabolism in the storage roots of sweet potato.
Keywords Sweet potato; Storage roots; Genes related to starch metabolism; qRT-PCR; Diurnal cycle change
甘薯是重要的農作物和工业原料。甘薯薯块中淀粉含量高,主要由直链淀粉和支链淀粉组成[1]。在高等植物中,淀粉的生物合成发生在质体中,需要一系列生物合成酶的配合,包括腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、淀粉合成酶(SS)、颗粒淀粉合成酶(GBSS)、淀粉分支酶(SBE)、淀粉去分支酶(DBE)[2]。淀粉代谢相关基因在植物中得到了广泛的研究[3,4]。转基因玉米植株中ZmAGPase基因的过表达可以改善玉米的籽粒性状[5];在马铃薯[6]和剑兰[7]块茎中,通过RNAi技术完全抑制AGPase基因的表达,可以使淀粉不能形成。利用RNAi技术抑制IbGBSSI基因表达,可产生无直链淀粉转基因甘薯[8]。通过调控甘薯中IbGBSS基因的表达,可以得到直链淀粉-支链淀粉比例不同的淀粉[9]。Miao等从香蕉果实中克隆了6个MaGBSS基因,它们分别在不同发育阶段对淀粉积累起促进作用[10]。Chen等发现CmSBEs基因表达量在板栗子叶发育过程中显著增加,且淀粉总量的增加主要是支链淀粉的合成[11]。马铃薯块茎中淀粉分支酶Ⅱ(StSBEⅡ)的过表达可增加支链淀粉的短链分支[12]。Schwall等通过RNAi技术同时抑制StSBEⅠ和StSBEⅡ基因的表达,成功地开发了一种生产直链淀粉含量高的淀粉的方法[13]。
植物中淀粉的生物合成和降解受到多重调控。Smith利用基因芯片技术分析了拟南芥叶片全天的转录组,表明淀粉代谢相关基因的表达受到昼夜周期的影响[14]。基因表达分析显示,籽粒苋AcSS基因在种子成熟过程中呈现组成型表达[15]。在拟南芥叶片中,AtGBSSⅠ基因表达受Myb型转录因子CCA1和LHY的调控,在昼夜周期中呈现节律振荡[16]。然而,关于甘薯贮藏根中淀粉代谢相关基因昼夜周期变化规律的研究尚未见报道。因此,我们选择4个淀粉含量不同的甘薯品种,研究淀粉代谢相关基因的昼夜周期变化规律。
1 材料与方法
1.1 试验材料
本试验选用4个甘薯品种(济薯25,淀粉含量22.6%;漯徐薯8号,淀粉含量为25.2%;郑薯20,淀粉含量12.6%;红香蕉,淀粉含量13.5%),在山东省泰安市山东果树研究所金牛山实验站栽培。幼苗移栽后第106 d为贮藏根膨大阶段,每3 h(6时至21时)收集发育的贮藏根。对每个品种从10个甘薯贮藏根中选择中间大小的3个样品,以减少取样误差。甘薯贮藏根用蒸馏水冲洗,切成小块(直径0.5 cm),冷冻于液氮中,-80℃保存备用。
1.2 RNA提取
用天根生化科技有限公司的多糖多酚RNA提取试剂盒,按照说明书操作,提取RNA。
1.3 qRT-PCR验证
用Primer Premier软件设计qRT-PCR引物(表1)。用罗氏LightCycler? 480II仪器进行定量分析。定量PCR分析程序为95℃变性15 s;然后是95℃ 15 s,55℃ 15 s,72℃ 15 s进行40个循环。用IbActin作为内参基因。用2-ΔΔCT对定量数据进行分析。
2 结果与分析
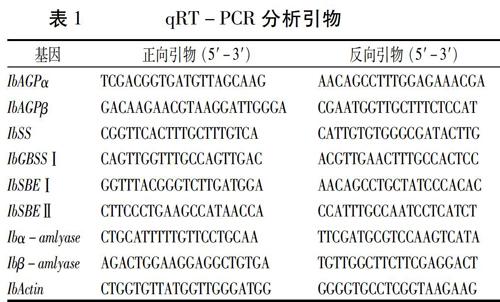
2.1 IbAGPα和IbAGPβ基因的表达分析
腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)催化葡萄糖-1-磷酸和ATP生成腺苷二磷酸葡萄糖,是高等植物淀粉生物合成的前体。AGPase是由两个大亚基和两个小亚基构成的异源四聚体,大亚基是酶的调节中心,小亚基是酶的催化中心。本研究发现,4个甘薯品种贮藏根中IbAGPase大亚基(IbAGPα)的表达在昼夜周期中呈现先升高后降低的趋势,在12时至15时达到表达的高峰(图1A)。IbAGPase小亚基(IbAGPβ)在昼夜周期中表达量变化不明显(图1B)。Smith在拟南芥中的研究发现AtAGPase大亚基在昼夜周期中呈现先升高后降低的趋势[14],这与我们的研究结果一致;拟南芥叶片AtAGPase小亚基的转录水平也呈现周期变化不明显的趋势,然而,其表达量明显低于甘薯。
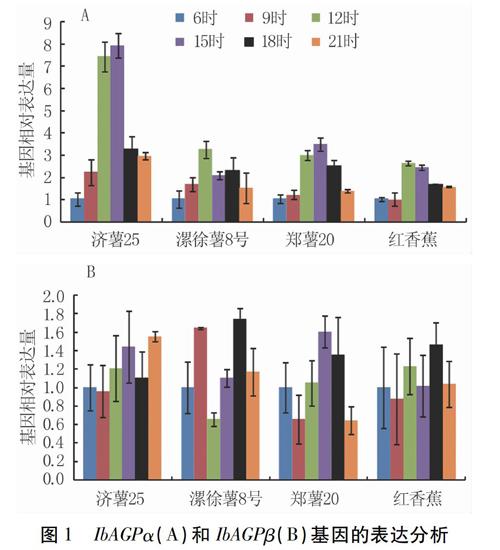
2.2 IbSS和IbGBSSⅠ基因的表达分析
在高等植物中,有两种不同功能和定位的淀粉合成酶:淀粉合酶(SS)和颗粒结合淀粉合酶(GBSS)。淀粉合酶主要存在于质体基质中,在支链淀粉的合成中起作用。颗粒结合淀粉合酶与淀粉颗粒紧密结合,负责直链淀粉的合成。颗粒结合淀粉合酶Ⅰ(GBSSⅠ)是将葡萄糖基从腺苷二磷酸葡萄糖转移到葡聚糖生成直链淀粉的关键酶之一[17]。本研究发现,四个甘薯品种贮藏根中IbSS和IbGBSSⅠ基因的表达在昼夜周期中呈周期性变化。从6时到12时,IbSS基因的表达逐渐升高,并在中午12时达到高峰。然后,从12时到21时,IbSS基因的表达逐渐降低(图2A)。IbGBSSⅠ基因与IbSS基因呈现相似的趋势(图2B)。且IbGBSSⅠ基因表达量的增幅明显低于IbSS基因。Smith等发现拟南芥叶片AtSS和AtGBSS基因的表达在白天先升高后降低[14]。我们的结果中也观察到同样的趋势,但是IbSS基因的上调相对于拟南芥发生在较晚的阶段。这可能与光合产物从叶子到根的运输有关。AtGBSS基因的上调表达高于AtSS基因,这与我们的结果相反。这可能因为这两种植物的淀粉成分不同有关。Zeeman发现拟南芥淀粉含量的增加与叶片直链淀粉含量的增加有关[18],而甘薯贮藏根淀粉的主要成分是支链淀粉[19]。
2.3 IbSBEⅠ和IbSBEⅡ基因的表达分析
淀粉分支酶(SBE)是淀粉生物合成的关键酶,通过在葡聚糖上产生α-1,6-糖苷键从而产生分支。IbSBEⅠ基因在甘薯块根中有较强的表达,其在甘薯发育的贮藏根的淀粉合成中起着重要作用[20]。本研究发现,IbSBEⅠ和IbSBEⅡ在4个甘薯品种发育的贮藏根中的表达在整个昼夜周期中呈周期性变化。从6时到15时,IbSBEⅠ基因的表达逐渐升高,并在15时达到高峰,然后,从15时到21时,IbSBEⅠ基因的表达逐渐降低(图3A)。IbSBE Ⅱ基因与IbSBE Ⅰ基因表现出相似的趋势(图3B)。但IbSBE Ⅱ基因的上调幅度明显高于IbSBE Ⅰ基因。我们的结果表明,IbSBE Ⅰ和IbSBE Ⅱ基因的表达在整个昼夜循环中呈先升高后降低的趋势,这與Smith等[14]的研究结果一致。
2.4 Ibα-amylase和Ibβ-amylase基因的表达分析
淀粉的水解依赖α-淀粉酶(α-amylase)、β-淀粉酶(β-amylase)、去分支酶和α-葡萄糖苷酶的共同作用。α-淀粉酶直接攻击淀粉粒,水解释放可溶性亚基,然后在其他三个酶的作用下水解成麦芽糖和葡萄糖[21]。β-淀粉酶催化淀粉粒非还原末端α-1,4糖苷键的水解,产生麦芽糖。本研究发现,Ibα-amylase基因的表达在4个甘薯品种发育的贮藏根中随着昼夜周期呈现规律性变化。从6时到18时,Ibα-amylase基因的表达逐渐升高,在15时至18时达到高峰。然后,从18时到21时,Ibα-amylase基因的表达逐渐降低(图4A)。Smith研究发现在拟南芥叶Atα-amylase基因的表达呈现先升高后降低的趋势,Atα-amylase基因表达的高峰显著早于甘薯中的结果。Ibβ-amylase基因的表达在4个甘薯品种发育的贮藏根中随昼夜周期没有明显变化(图4B)。
3 討论与结论
已有的研究表明,淀粉合成酶可在转录水平、蛋白质水平调控淀粉的合成。在植物体非光合贮藏器官中,AGPase在淀粉合成中的作用主要是通过转录水平来调控。在小麦种子灌浆期,AGPase的含量和淀粉合成速率与AGPase基因表达水平呈正相关[22]。马铃薯块茎形成时,AGPase对淀粉合成的调控主要体现在转录水平上[23]。我们的研究发现甘薯中IbAGPα基因的表达还受到昼夜周期的调控,说明昼夜周期是影响甘薯贮藏根淀粉合成的一个因素。GBSSⅠ酶能够合成颗粒淀粉,在暗周期中会降解,在光照周期中会迅速合成[14],GBSSⅠ酶的变化规律与甘薯中IbGBSSⅠ基因的表达水平一致,这表明GBSS酶活性也受到转录水平的调控。SS主要在支链淀粉的合成中起作用,GBSS主要在直链淀粉合成中起作用。Ulrka等[24]研究发现,马铃薯SBEⅠ以直链淀粉为底物,而SBEⅡ以支链淀粉为底物,我们的研究发现IbSS和IbSBEⅡ基因的表达在昼夜周期中上调的水平明显高于IbGBSS和IbSBEⅠ基因,这与甘薯贮藏根淀粉的主要成分是支链淀粉相对应[19]。
本研究对4个淀粉含量不同的甘薯品种发育的贮藏根中淀粉代谢相关基因的表达分析显示,其在昼夜周期中从6时到21时呈现先升高后降低的趋势,淀粉合成相关基因的表达高峰出现在12时到15时,淀粉降解相关基因的表达高峰出现在15时之后,不同淀粉含量甘薯品种淀粉代谢相关基因表达趋势相似,揭示了淀粉代谢相关基因在整个昼夜循环中的表达变化。本研究进一步丰富了我们对甘薯贮藏根淀粉代谢调控机制的认识。
参 考 文 献:
[1]Himada T,Otani M,Hamada T,et al. Increase of amylose content of sweetpotato starch by RNA interference of the starch branching enzymeⅡgene (IbSBEⅡ) [J]. Plant Biotechnology,2006,23(1):85-90.
[2]Jeon J S,Ryoo N,Hahn T R,et al. Starch biosynthesis in cereal endosperm [J]. Plant Physiol. Biochem.,2010,48(6):383-392.
[3]刘美,张凤,杨翠翠,等. 小麦种子萌发早期淀粉降解关键酶活性及基因表达量研究[J]. 山东农业科学,2014,46(9):39-45.
[4]Mitsui T,Itoh K,Hori H,et al. Biosynthesis and degradation of starch [J]. Bulletin of the Faculty of Agriculture Niigata University,2009,33(4):431-454.
[5]Li N,Zhang S,Zhao Y,et al. Over-expression of AGPase genes enhances seed weight and starch content in transgenic maize [J]. Planta,2011,233(2):241-250.
[6]Müllerrber B,Sonnewald U,Willmitzer L. Inhibition of the ADP-glucose pyrophosphorylase in transgenic potatoes leads to sugar-storing tubers and influences tuber formation and expression of tuber storage protein genes [J]. EMBO Journal,1992,11(4):1229-1238.
[7]Seng S S,Wu J,Sui J J,et al. ADP-glucose pyrophosphorylase gene plays a key role in the quality of corm and yield of cormels in gladiolus [J]. Biochemical & Biophysical Research Communications,2016,474(1):206-212.
[8]Otani M,Hamada T,Katayama K,et al. Inhibition of the gene expression for granule-bound starch synthase I by RNA interference in sweet potato plants [J]. Plant Cell Rep.,2007,26(10):1801-1807.
[9]Kimura T,Saito A. Heterogeneity of poly(A) sites in the granule-bound starch synthaseⅠgene in sweet potato (Ipomoea batatas (L.) Lam.) [J]. Biosci. Biotechnol. Biochem.,2010,74(3):667-669.
[10]Miao H,Sun P,Liu W,et al. Identification of genes encoding granule-bound starch synthase involved in amylose metabolism in banana fruit[J]. PLoS ONE,2014,9(2):e88077.
[11]Chen L,Lu D,Wang T,et al. Identification and expression analysis of starch branching enzymes involved in starch synthesis during the development of chestnut (Castanea mollissima Blume) cotyledons [J]. PLoS ONE,2017,12(5):e0177792.
[12]Brummell D A,Watson L M,Zhou J,et al. Overexpression of STARCH BRANCHING ENZYMEⅡincreases short-chain branching of amylopectin and alters the physicochemical properties of starch from potato tuber [J]. BMC Biotechnology,2015,15(1):28.
[13]Schwall G P,Safford R,Westcott R J,et al. Production of very-high-amylose potato starch by inhibition of SBE A and B [J]. Nature Biotechnology,2000,18(5):551-554.
[14]Smith S M,Fulton D C,Chia T,et al. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in Arabidopsis leaves [J]. Plant Physiology,2004,136(1):2687-2699.
[15]Park Y J,Nishikawa T,Tomooka N,et al. Molecular cloning and expression analysis of a gene encoding soluble starch synthaseⅠfrom grain amaranth (Amaranthus cruentus L.) [J]. Molecular Breeding,2012,30(2):1065-1076.
[16]Tenorio G,Orea A,Romero J M,et al. Oscillation of mRNA level and activity of granule-bound starch synthaseⅠin Arabidopsis leaves during the day/night cycle [J]. Plant Mol. Biol.,2003,51(6):949-958.
[17]Zeeman S C,Kossmann J,Smith A M. Starch: its metabolism,evolution and biotechnological modification in plants [J]. Annual Review of Plant Biology,2010,61(1):209-234.
[18]Zeeman S C,Tiessen A,Pilling E,et al. Starch synthesis in Arabidopsis: granule synthesis,composition and structure [J]. Plant Physiology,2002,129(2):516.
[19]史春余,姚海蘭,张立明,等. 不同类型甘薯品种块根淀粉粒粒度的分布特征[J]. 中国农业科学,2011,44(21):4537-4543.
[20]Hamada T,Kim S H,Shimada T. Starch-branching enzyme I gene (IbSBEI) from sweet potato (Ipomoea batatas), molecular cloning and expression analysis [J]. Biotechnology Letters,2006,28(16):1255-1261.
[21]Sarikaya E,Higasa T,Adachi M,et al. Comparison of degradation abilities of α- and β-amylases on raw starch granules [J]. Process Biochemistry,2000,35(7):711-715.
[22]Anderson J M, Larsen R, Laudencia D, et al. Molecular characterization of the gene encoding a rice endosperm-specific ADP-glucose pyrophosphorylase subunit and its developmental pattern of transcription [J]. Gene,1991,97(2):199-205.
[23]Smith-White B J, Preiss J. Comparison of proteins of ADP-glucose pyrophosphorylase from diverse sources [J]. J. Mol. Evol.,1992,34(5):449-464.
[24]Ulrka R, Lena A, Roger A. Comparion of starch branching enzyme Ⅲ from potato [J]. European Journal of Biochemistry,2001,268:6140-6145.
收稿日期:2019-08-13
基金项目:国家重点研发计划项目(2018YFD1000705-8);国家甘薯产业技术体系项目(CARS-10-B07);山东省现代农业产业技术体系薯类创新团队建设项目(SDAIT-16-04);山东省农业科学院作物研究所学科团队建设项目(CXGC2018E01)
作者简介:秦桢(1979—),男,助理研究员,博士,主要从事甘薯分子育种工作。E-mail:qinzhenbio@163.com
*同为第一作者。
通讯作者:王庆美(1964—),女,研究员,博士,主要从事甘薯育种工作。E-mail:wang-qm@163.com
