三取代靛红衍生物的合成及其对肿瘤细胞增殖、凋亡和细胞周期的影响
2019-12-21赵连波萨旭仁贵韩开林
赵连波,张 倩,付 颖,郝 磊,萨旭仁贵,韩开林,刘 振
(天津科技大学生物工程学院,天津 300457)
靛红又名吲哚二酮(isatin,见图1),是一种广泛存在于自然界中的氮杂环类生物碱,具有良好的生物活性.近年来研究[1-4]发现,靛红作为天然治疗癌症的先导化合物对多种肿瘤细胞的生长有抑制作用,同时其对正常细胞不产生作用,这有效降低了抗肿瘤药物的毒副作用.靛红衍生物不仅具有靛红的生物学特性,而且既传承了传统中药的优点又克服了现有抗癌药物损害正常细胞的缺点,其中一些衍生物已经成功用于治疗癌症.
本课题组前期研究[5-7]发现了靛红1 位、5 位是关键活性位点,为了研究三取代靛红衍生物对活性的影响,本研究以4-溴吲哚二酮、6-溴吲哚二酮、7-溴吲哚二酮为起始原料,通过NBS 溴代、铃木偶联反应(Suzuki-Coupling)、N-烷基化三步反应制备合成了3 种新型三取代靛红衍生物,利用核磁共振方法确定了产物的结构,并利用MTT 法和流式细胞仪检测了目标化合物对肿瘤细胞增殖、凋亡和细胞周期的影响.
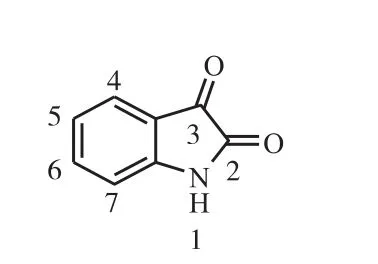
图1 靛红母核结构式 Fig. 1 Structure of isatin
1 材料与方法
1.1 试剂与仪器
4-溴吲哚二酮、6-溴吲哚二酮、7-溴吲哚二酮、4-甲氧基苯硼酸等试剂,化学纯,百灵威科技有限公司;N-溴代丁二酰亚胺、4-甲氧基氯化苄、[1,1′-双(二苯基膦基)二茂铁]二氯化钯、乙酸钾、碳酸钾等试剂,化学纯,国药化学试剂有限公司;喜树碱(CPT),北京偶合科技有限公司;甲醇、石油醚、二氯甲烷、N,N-二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)及1,4-二氧六环等溶剂,分析纯,北京化学试剂公司.
TX323L 型电子分析天平,岛津国际贸易有限公司;超净工作台,苏州净化设备有限公司;循环水式真空泵,河南予华仪器有限公司;集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;低温恒温反应浴,巩义市京华仪器有限责任公司;Av-400 MHz 型核磁共振仪,瑞士Bruker 公司.
1.2 合成路线
以4-溴吲哚二酮、6-溴吲哚二酮、7-溴吲哚二酮为起始原料,通过NBS 溴代、铃木偶联反应、N-烷基化三步反应制备目标化合物,具体合成路线如图2 所示.
1.2.1 化合物a 的合成
将4-溴吲哚二酮1.0 g(4.42 mmol)、N-溴代丁二酰亚胺0.83 g(4.64 mmol)溶解于DMF(3 mL)中,室 温反应24 h.TLC 检测反应完全后,将其倒入冰水中,产生红色固体.过滤收集沉淀,沉淀用甲醇重结晶,得到4,5-二溴吲哚二酮1.11 g,产率为83%(未经纯化直接进行下步反应).
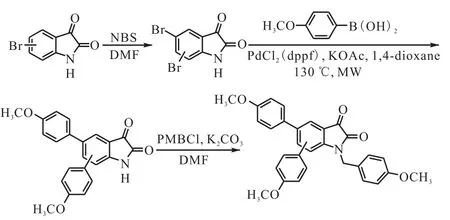
图2 1,4,5、1,5,6、1,5,7-三取代靛红衍生物合成路线 Fig. 2 Synthesis route of 1,4,5,1,5,6,1,5,7-trisubstituted isatin derivatives
将4,5-二溴吲哚二酮0.50 g(1.64 mmol)、4-甲氧基苯硼酸 0.30 g(1.97 mmol)、PdCl2(dppf)0.06 g (0.08 mmol)、CH3COOK 0.32 g(3.28 mmol)溶解于1,4-二氧六环(5 mL)中,氩气保护下,微波辅助135 ℃反应30 min.TLC 检测反应完全后,将其倒入50 mL 水中,反应液用二氯甲烷萃取(100 mL)3 次,合并有机相.有机相用饱和NaCl 水洗,无水硫酸钠干燥,旋转蒸发,得到固体产物4,5-二(4-甲氧基苯基)吲哚二酮0.27 g,产率为45%(未经纯化直接进行下步反应).
将 4,5-二(4-甲氧基苯基)吲哚二酮 0.10 g (0.28 mmol)、无水碳酸钾0.12 g(0.84 mmol)、4-甲氧基苄氯0.05 g(0.36 mmol)室温下溶解于DMF(2 mL)中,室温反应12 h.TLC 检测反应完全后,将其倒入冰水中,反应液用二氯甲烷萃取(50 mL)3 次,合并有机相.有机相用无水硫酸钠干燥,旋转蒸发.粗产品用洗脱剂洗脱(V石油醚﹕V乙酸乙酯=10﹕1~1﹕1),200~300 目硅胶柱层析纯化.得到固体化合物a,产率为80%.
1.2.2 化合物b 的合成
化合物b 的合成方法同化合物a.以6-溴吲哚二酮1.0 g(4.42 mmol)为起始原料,依次通过溴化、铃木偶联反应和烷基化反应获得化合物 b,产率为91%.
1.2.3 化合物c 的合成
化合物c 的合成方法同化合物a.以7-溴吲哚二酮1.0 g(4.42 mmol)为起始原料,依次通过溴化、铃木偶联反应和烷基化反应获得化合物 c,产率为92%.
1.3 体外抗肿瘤活性测试
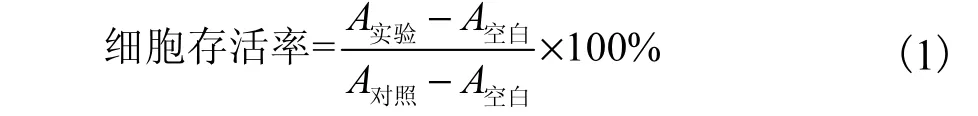
分别取对数生长期的人慢性髓原白血病细胞K562、人肝癌细胞HepG2 和人结肠癌细胞HT-29,用0.25%胰蛋白酶消化(贴壁细胞),以5×104mL-1细胞密度接种于96 孔培养板,每孔100 μL,置于37 ℃、5%CO2培养箱孵育一定时间(悬浮细胞孵育2 h,贴壁细胞孵育24 h).每组设3 个平行孔,每孔加入不同浓度化合物0.5 μL.同时设置等体积DMSO 溶剂对照组和喜树碱阳性对照组.37 ℃、5%CO2培养箱孵育48 h 后,每孔加入5 mg/mL MTT 20 μL,继续孵育4 h 终止培养.贴壁细胞小心吸弃孔内培养基上清液,每孔加入100 μL DMSO;悬浮细胞每孔继续加入100 μL 盐酸-异丙醇溶液后反复吹打混匀.置于37 ℃、5%CO2培养箱10 min, 臜甲结晶充分溶解后,用酶标仪(贴壁细胞选择492、630 nm,悬浮细胞选择578、630 nm)测定吸光度(A).按式(1)计算细胞存活率[8],并计算半数有效抑制浓度IC50值.
1.4 化合物c对K562细胞增殖的作用
取处于对数生长期的K562 细胞,按5×104mL-1细胞密度接种于 96 孔板,每孔加入细胞悬液100 μL,37 ℃、5%CO2培养箱中培养2 h,分别加入终浓度为0.01、0.1、1、10、100 μmol/L 的化合物c,对照孔仅加入DMSO 溶剂.将孔板置于37 ℃、5%CO2恒温培养箱中,孵育48 h,每孔加入5 mg/mL 的MTT 20 μL 继续孵育4 h,加入100 μL 盐酸-异丙醇溶液后反复吹打混匀.再将孔板置于37 ℃、5%CO2培养箱10 min,使用酶标仪测定吸光度,并采用GraphPad Prism 5 进行数据分析.
1.5 Annexin-V/PI 双染法检测化合物c 对K562 细胞凋亡的影响
取处于对数生长期的K562 细胞,以5×104mL-1接种于6 孔培养板中,每孔2 mL,置于37 ℃、5% CO2的培养箱中培养2 h,分别加入0.2 μmol/L 和2 μmol/L 化合物c,24 h 和48 h 后,1 000 r/min 离心5 min.除去培养基上清液,用预冷的1×PBS 将细胞吹悬,2500 r/min 离心5 min,除去上清液,冰浴.加入一定量的1×Binding Buffer 到离心管中重悬细胞,转移至EP 管中进行染色,轻轻振荡混匀,25 ℃避光孵育10 min;补加400 μL 1×Binding Buffer 后使用流式细胞仪进行测试[9].
1.6 PI染色检测化合物c对K562细胞周期的影响
取处于对数生长期的K562 细胞,以5×104mL-1细胞密度接种于6 孔培养板中,每孔2 mL,37 ℃、5%CO2培养箱中培养2 h,分别加入0.2 μmol/L 和2 μmol/L 化合物c,24 h 和48 h 后,将细胞分别收集至EP管中,2 500 r/min 离心5 min.弃去上清液,加PBS 缓冲液将细胞吹悬,2 500 r/min 离心5 min,弃去上清液,重复1 次;加入1 mL 75%乙醇于4 ℃固定过夜.1 000 r/min 离心5min,弃固定液.用1 mL PBS缓冲液洗涤1次,1000 r/min 离心5 min,弃去上清液.用 500 μL PBS(含有 50 μg/mL PI、100 μg/mL RNase A、0.2% TritonX-100)4 ℃避光染色30 min,使用流式细胞仪检测,FlowJo 7.6 软件分析PI荧光强度图.
2 结果与讨论
2.1 化合物光谱数据
化合物a:1H NMR(400 MHz,CDCl3)δ 3.74(s,3H),3.79(s,6H),4.91(s,2H),6.69~6.71(d,2H, J=8.4 Hz),6.76~6.81(m,3H),6.85~6.90(m,4H), 6.97~6.99(d,2H,J=8.0 Hz),7.31~7.33(d,2H,J=8.4 Hz),7.43 ~7.45(d,1H,J =8.0 Hz).13C NMR (100 MHz,CDCl3)δ 43.4,55.1,55.1,55.3,109.5,113.2,113.2,113.4,113.4,114.4,114.4,115.1,126.7,126.7,129.0,129.0,130.7,130.7,131.3,131.3,131.8,137.6,139.2,141.1,150.1,158.0,158.4,159.3,159.4,182.2. ESI-MS 480.1 [M+H]+.
化合物b:1H NMR(400 MHz,CDCl3)δ 3.77(s,3H),3.79(s,3H),3.79(s,3H),4.89(s,2H),6.73~6.77(m,4H),6.81(s,1H),6.87 ~6.97(m,6H),7.29~7.31(d,2H,J=8.4 Hz),7.61(s,1H).13C NMR (100 MHz,CDCl3)δ 43.5,55.2,55.2,55.3,112.6,113.7,113.7,113.7,113.7,114.4,114.4,116.3,126.7,127.4,129.0,129.0,130.6,130.6,130.6,130.6,132.0,132.5,136.1,149.4,150.2,158.6,158.8,159.4,159.4,182.9. ESI-MS 480.2 [M+H]+.
化合物c:1H NMR(400 MHz,CDCl3)δ 3.73(s,3H),3.83(s,3H),3.87(s,3H),4.68(s,2H),6.53~6.55(d,2H,J =7.8 Hz),6.64 ~6.66(d,2H,J =8.4 Hz),6.83~6.85(d,2H,J=8.0 Hz),6.93~6.95 (d,2 H,J=7.8 Hz),7.03~7.05(d,2 H,J=8.0 Hz),7.44~7.46(d,2H,J=8.0 Hz),7.47(s,1H),7.83(s,1 H).13C NMR(100 MHz,CDCl3)δ 43.5,55.2,55.2,55.3,110.3,113.4,113.4,113.6,113.6,114.4,114.4,116.7,126.4,126.8,129.1,129.1,130.3,130.3,131.6,131.6,132.0,133.6,136.9,143.8,150.1,158.7,159.0,159.4,159.4,182.8. ESI-MS 480.2 [M+H]+.
2.2 三取代吲哚二酮衍生物对肿瘤细胞生长的影响
化合物a、b 和c 在1,4,5 位、1,5,6 位和1,5,7 位引入3 个4-甲氧基苯基取代基,其生物学活性与母核靛红相比,化合物a、b 和c 对K562 细胞增殖的抑制活性显著提升,化合物c 对HepG2 和HT-29 细胞具有明显的细胞毒性作用(表1).

表1 三取代吲哚二酮衍生物对肿瘤细胞生长的影响 Tab. 1 Effect of tri-substituted isatin derivatives on tumor cells
分析原因可能是在4,5 位和5,6 位引入相邻两个4-甲氧基苯基取代造成空间太挤,从而影响其生物学活性,5,7 位引入的两个4-甲氧基苯基避免了空间拥挤的问题,从而使活性得到提升.综上所述,空间位阻较小的三取代靛红衍生物体外抑制肿瘤细胞增殖活性较靛红母核显著提高.综上,1,5,7 位引 入的3 个4-甲氧基苯基的化合物c 抗肿瘤活性显著优于化合物a 和b.
2.2.1 化合物c 对K562 细胞的抑制作用
不同浓度化合物c 对K562 细胞增殖的抑制作用如图3 所示.由图3 可知:化合物c 能显著抑制K562 细胞存活率,呈现浓度依赖性;当化合物c 浓度为0.01、10、100 μmol/L 时,K562 细胞存活率分别为为97.06%、9.41%、2.84%.
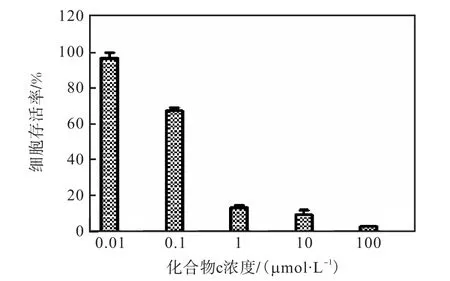
图3 不同浓度化合物c对K562细胞增殖的抑制作用 Fig. 3 Inhibitory effect of different concentrations of compound c on K562 cell’s proliferation
显微镜下观察K562 细胞生长情况,结果如图4所示.正常对照DMSO 组细胞呈圆形,而加入不同浓度化合物c 的测试组细胞形态发生较明显的变化,部分呈现不规则梭形细胞及凋亡小体,且凋亡细胞数量与化合物c 的浓度及作用时间呈正相关.
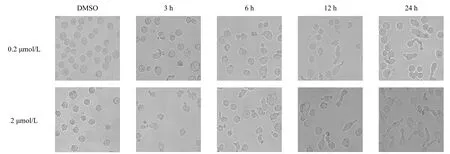
图4 化合物c对K562细胞形态学的影响 Fig. 4 Influence of compound c on K562 cell’s morphology
2.2.2 化合物c 诱导K562 细胞凋亡的作用
细胞形态学提示化合物c 对K562 细胞具有诱导细胞凋亡的作用,因此采用Annexin-V/PI 双染法检测化合物c 对K562 细胞凋亡的作用,如图5 所示.空白对照组细胞凋亡率为4.2%,0.2 μmol/L 化合物c 处理24 h 时,细胞凋亡率为11.3%;处理48 h时,细胞凋亡率增加至19.2%.2 μmol/L 化合物c 处理24 h 时,细胞凋亡率为18.1%,处理48 h 时,细胞凋亡率增加至49.4%.这说明化合物c 能够明显诱导K562 细胞的凋亡,这有可能是它抑制细胞增殖的作用机制之一.
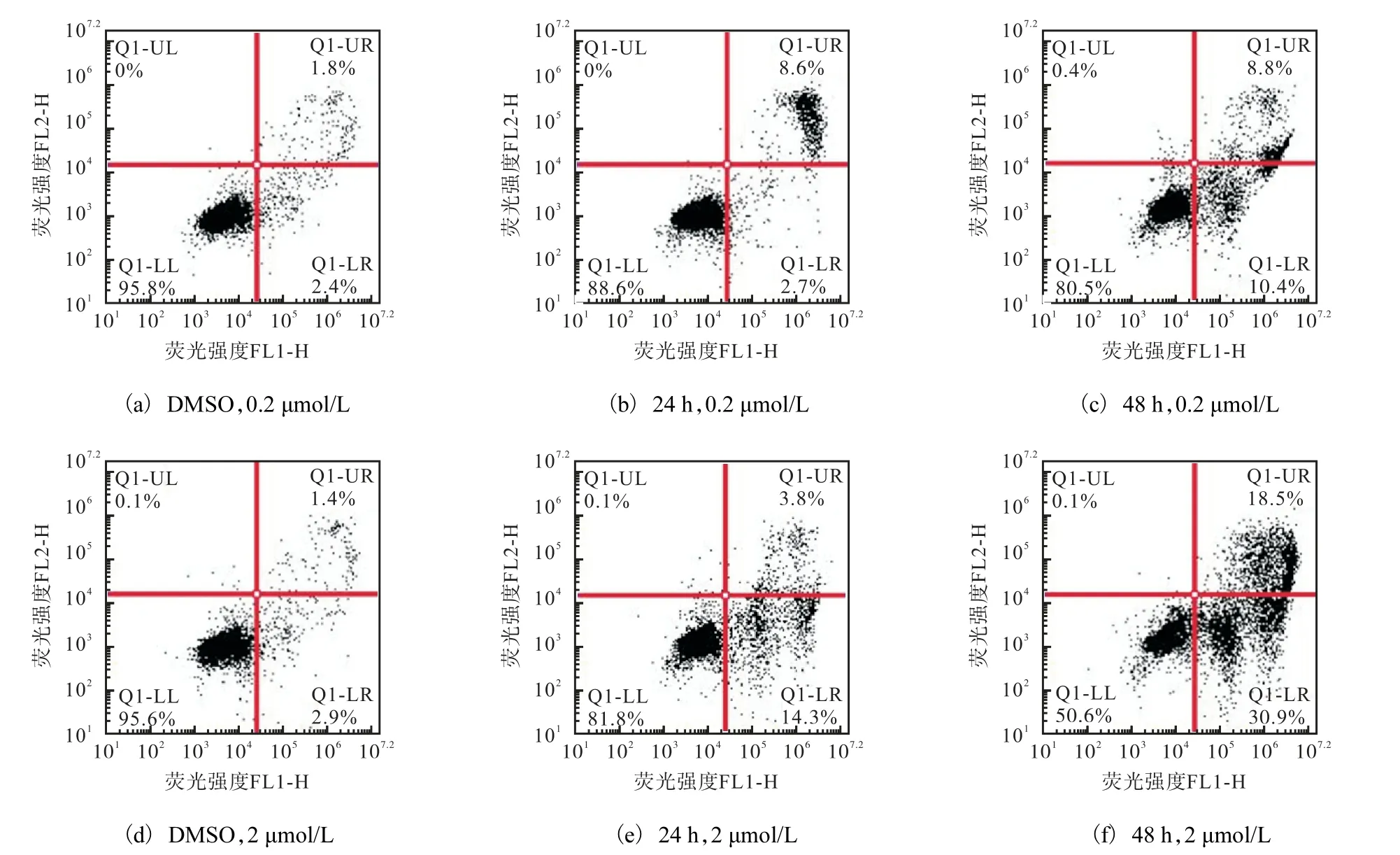
图5 化合物c对K562细胞凋亡的影响 Fig. 5 Effect of compound c on K562 cell’s apopotosis
2.2.3 化合物c 对K562 细胞周期的影响
前期细胞形态学结果能够明显观察到K562 细胞形态变长、呈棒状的现象[10],因此,研究化合物c抑制K562 细胞生长是否与其细胞周期阻滞有关.化合物c 对K562 细胞周期的影响如图6 所示.0.2、2 μmol/L 化合物c 处理K562 细胞处理3、6、12、24 h 后,G2/M 期出现阻滞,呈现时间和浓度依赖性. 0.2 μmol/L 化合物c 作用K562 细胞6 h 和24 h 时,G2/M 期所占比例分别为14.20%、27.84%.2 μmol/L化合物c 作用K562 细胞6 h 和24 h 时,G2/M 期所占比例分别为25.80%、84.67%.这表明化合物c 抑制K562 细胞生长与细胞周期阻滞作用相关.

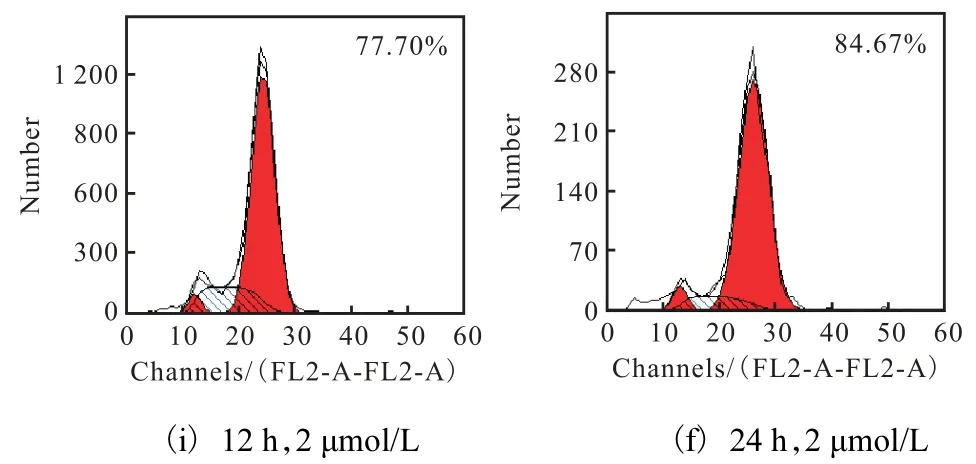
图6 化合物c对K562细胞周期的影响 Fig. 6 Effect of compound c on K562 cell’s cycle
3 结 论
本文合成了3 种三取代靛红衍生物,利用MTT法和流式细胞仪检测了目标化合物对肿瘤细胞增殖、凋亡和细胞周期的影响.MTT 测试结果表明:在1,4,5 位(化合物a)、1,5,6 位(化合物b)引入3 个4-甲氧基苯基取代基造成空间太挤,其生物学活性未有改善;1,5,7 位引入3 个4-甲氧基苯基(化合物c)避免了空间拥挤的问题,从而使活性得到显著提高.流式细胞仪检测化合物c 的活性时发现,化合物c 能显著诱导白血病K562 细胞的凋亡和G2/M 期阻滞,并与化合物浓度和处理时间成正相关.这表明空间位阻较小的三取代靛红衍生物体外抑制肿瘤细胞增殖活性较靛红母核显著提高,以此为该类化合物的进一步衍生化和构效关系研究提供了基础数据.
