炎症预激活间充质干细胞条件培养基调控坏死性小肠结肠炎小肠炎性反应的作用研究
2019-12-16朱小波马发鑫冯琳郑跃沙卫红陈浩
朱小波,马发鑫,冯琳,郑跃,沙卫红,陈浩
新生儿坏死性小肠结肠炎(NEC)是新生儿,特别是早产儿最为常见的消化系统急危重症,其病死率可高达30%,严重地危害了患儿生命[1-2]。NEC的发病机制尚未明确,一般文献报道有以下几种危险因素:(1)肠上皮细胞的缺血缺氧性损伤;(2)肠道发育不成熟;(3)肠道微生物群的异常定植;(4)配方奶喂养等[2-5]。病理特征主要以回肠末端的损害最为严重,并且病情发展快,目前临床无有效的治疗措施,存活者中仍有约半数存留营养不良、肠狭窄、短肠综合征等后遗症[6-7]。故当前亟需针对其发病机制寻找更有效的防治方法。
间充质干细胞(MSCs)是一类在特定条件下具有多向分化潜能的干细胞,其对组织损伤的修复作用已在心脏、肝脏、肺及小肠等器官被证实。除此之外,MSCs还具有强大的免疫调节和抗炎能力,可调控放射性小肠炎、炎症性肠病、骨髓移植等疾病的炎性反应[8-11]。近年研究表明,在NEC发病过程中,Toll样
受体炎症信号通路被激活,从而启动炎症级联反应,诱发多种促炎因子包括白介素(IL)-1β、IL-6、IL-8和肿瘤坏死因子α(TNF-α)的升高,参与肠道损伤和炎性反应;而过量上皮细胞的凋亡和炎性因子的释放可能造成肠道局部缺血坏死,进而导致消化道炎症的发生,加重NEC的病情[12-13]。本课题组前期研究发现不同状态间充质干细胞条件培养基(MSC-CM)能下调多种小肠损伤炎性反应,对肠道起到保护作用[14],但对NEC炎性反应的作用和机制尚未明确,故本研究旨在探讨炎症激活前后不同状态MSC-CM对NEC炎性反应调控作用的差异及其机制,为探索NEC新的治疗手段提供理论基础和实验依据。
1 材料与方法
1.1 实验时间与地点 2018年7月—2019年4月,在广东省人民医院(广东省医学科学院)中心实验室、中山大学中心实验室、华南理工实验动物中心完成本实验。
1.2 实验动物 清洁级新生Sprague-Dawley(SD)孕鼠,用于获得早产新生大鼠,早产新生大鼠雌雄不限,用于建立NEC模型。雌性SD大鼠,3~4周龄,体质量60~80 g,SPF级,用于获取骨髓MSCs。均由中山大学北校区实验中心、华南理工实验动物中心提供,所有动物经检疫符合实验动物标准,实验方法符合医学伦理学要求。
1.3 实验试剂与材料 Similac配方奶粉(美国Abbott公司);保育箱和缺氧箱(中山大学北校区实验中心);DMEM-F12培养基(美国Hycolne公司);酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司);胎牛血清(美国Hycolne公司);TrypLEExpress胰酶代替物(美国Invirogen公司);抗大鼠CD29-FITC、CD34-FITC、CD44-FITC、CD45-FITC单克隆抗体(美国Biolegend公司);CD4和Foxp3单克隆抗体(美国eBiosciences公司)。
1.4 实验方法
1.4.1 骨髓MSCs的分离、培养和鉴定 参照课题组既往文献的实验方法[15],经原代分离、培养、传代后使用流式细胞仪对细胞表型CD29、CD34、CD44、CD45进行鉴定。
1.4.2 MSC-CM的制备 参照课题组既往文献的实验方法[15],在MSCs培养基中同时添加外源性TNF-α(6 ng/ml,美国加利福尼亚州eBiosciences公司)、IL-1β(3 ng/ml,美国加利福尼亚州eBiosciences公司)、一氧化氮(NO)供体(硝普钠,sodium nitroprusside;200 μmol/L)模拟炎症刺激环境,24 h后弃去培养基,更换2 ml新鲜无血清培养基继续培养48 h后收集该培养液,此为TNF-α、IL-1β和一氧化氮(NO)联合培养诱导的炎症预激活间充质干细胞条件培养基(MSCCMTNF-α+IL-1β+NO)。采用类似方法,收集未加入外源性TNF-α、IL-1β和NO激活的培养液,此为正常间充质干细胞条件培养基(MSC-CMNOR)。随后用5 kDa的离心超滤管,3 000 r/min(离心半径 5 cm)离心 20 min;此时培养基浓缩约50倍,0.22 μmol/L滤器过滤灭菌,于-20 ℃冰箱储存备用。
1.4.3 新生大鼠NEC模型建立 根据文献方法[16-17],于母鼠妊娠21 d时采用剖宫术获得早产新生大鼠,置于新生鼠保育箱内进行人工喂养。缺氧和冷刺激:密闭缺氧箱上充入氮气,调整环境为95%氮气+5%氧气,10 min后打开箱盖取出新生大鼠;随后将新生大鼠置于4 ℃低温冰箱,维持10 min后取出新生大鼠,如此缺氧联合冷刺激处理2次/d,间隔12 h,连续3 d。脂多糖(0.5 mg/ml)灌胃,1次/d,0.1 ml/次,处理2次,间隔12 h。经上述处理,距回盲部10~15 cm取出小肠约2 cm,磷酸缓冲盐溶液(PBS)冲洗肠腔,40 g/L多聚甲醛溶液固定,苏木素-伊红(HE)染色,光镜下观察小肠组织病理学改变,使用双盲法,由2位及以上病理科医师根据CAPLAN等[18]的评分标准独立对切片进行评分。分级标准:0级为肠黏膜绒毛完整,组织结构正常;1级为轻微黏膜下层和/或固有层分离;2级为中度黏膜下层和/或固有层分离,或者黏膜下层和肌层水肿;3级为严重黏膜下层和/或固有层分离,或者黏膜下层和肌层严重水肿,局部绒毛脱落;4级为肠绒毛消失伴肠壁全层坏死。病理学评分≥2分确诊为NEC。
1.4.4 给药方式 随机选取SD孕鼠早产的80只新生大鼠,根据处理方式分为对照组、单纯NEC损伤组、NEC损 伤 +MSC-CMNOR组、NEC损 伤 +MSCCMTNF-α+IL-1β+NO组,每组 20只。采用腹腔注射的方式,所有实验新生大鼠出生即按照分组分别注射等量的0.9%氯化钠溶液(对照组)、DMEM-F12培养基(单纯NEC损伤组)、MSC-CMNOR(NEC损伤+MSCCMNOR组 )及 MSC-CMTNF-α+IL-1β+NO(NEC 损 伤 +MSCCMTNF-α+IL-1β+NO组)。每只新生大鼠每天腹腔一次性注射给药 200 μl,连续注射 3 d。
1.4.5 小肠大体标本留取及病理学检查 各组在实验第4天,空腹12 h后断颈处死新生大鼠取材,开腹观察小肠大体标本,距回盲部10~15 cm取出小肠约2 cm,PBS冲洗肠腔,40 g/L多聚甲醛溶液固定,HE染色,光镜下观察小肠病理学改变;同时收集距回盲部5 cm的回肠组织约50 mg用于ELISA检测。各组新生大鼠均经心脏取血 1.0~1.5 ml,室温下静置 30 min,3 000 r/min(离心半径5 cm)离心10 min,收集血清,-20 ℃保存用于ELISA检测。
1.4.6 血清和小肠组织中促炎因子和抑炎因子水平的检测 从4组新生大鼠中各随机选取10只,取血清和小肠组织标本,将小肠组织在冰0.9%氯化钠溶液中漂洗,滤纸拭干,取10 mg小肠组织加入1 ml冰0.9%氯化钠溶液研磨,制备组织匀浆,4 ℃ 12 000 r/min(离心半径5 cm)离心20 min,取上清液。按照ELISA试剂盒说明书步骤分别检测血清中TNF-α、IL-1β、IL-6、IL-8、IL-10及IL-12水平,小肠组织匀浆上清液中TNF-α、IL-1β、IL-6及IL-10水平。
1.4.7 统计学方法 应用SPSS 19.0统计软件处理实验数据。计数资料以相对数表示,组间比较采用χ2检验。对小肠组织的病理学评分进行Kruskal-Wallis H检验分析;计量资料以(x±s)表示,各组间TNF-α、IL-1β、IL-6、IL-8、IL-12及IL-10水平比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组新生大鼠一般状况 对照组新生大鼠各项指标正常,活力良好。单纯NEC损伤组及NEC损伤+MSC-CMNOR组新生大鼠在造模成功24 h后出现食欲不振、腹胀、腹泻或排黏液血便;表现为嗜睡、活动量减少及反应迟钝,程度逐渐加重,体质量减轻。NEC损伤+MSC-CMTNF-α+IL-1β+NO组新生大鼠在造模成功 48 h 后出现轻度腹胀及排黄色黏液便症状,活动量减少,程度较单纯NEC损伤组新生大鼠明显减轻。
2.2 肠道组织病理学改变
2.2.1 各组小肠大体标本变化 对照组新生大鼠小肠色泽红润,无充血,弹性好,有蠕动,未见肠壁积气或坏死。单纯NEC损伤组新生大鼠及NEC损伤+MSCCMNOR组新生大鼠肠道色泽呈暗红色,充血明显,可见肠壁积气、坏死,弹性差,肠管扩张。NEC损伤+MSC-CMTNF-α+IL-1β+NO组新生大鼠肠道轻度充血,未见肠壁积气或坏死,弹性尚可。
2.2.2 光镜下各组小肠组织病理学改变 对照组新生大鼠回肠绒毛完整,腺体结构排列规整,固有层血管无扩张,无炎性细胞浸润。单纯NEC损伤组新生大鼠及NEC损伤+MSC-CMNOR组新生大鼠可见绒毛有不同程度的脱落坏死,腺体排列紊乱,黏膜层及黏膜下层充血、水肿,肌层变薄或断裂。NEC损伤+MSC-CMTNF-α+IL-1β+NO组新生大鼠回肠绒毛尚完整,黏膜及黏膜下层轻度充血、水肿,未见肌层破坏(见图1)。
2.2.3 各组小肠组织病理学评分 对照组、单纯NEC损伤组、NEC损伤+MSC-CMNOR组、NEC损伤+MSCCMTNF-α+IL-1β+NO组病理学评分总分为16、51、43、16分,4组病理学评分比较,差异有统计学意义(H=41.70,P<0.01)。 其中单纯NEC损伤组、NEC损伤+MSCCMNOR组病理学评分高于对照组,差异均有统计学意义(Z=-5.07、-4.57,P<0.01),NEC 损 伤 +MSCCMTNF-α+IL-1β+NO组病理评分较单纯NEC损伤组降低,差异有统计学意义(Z=-4.50,P<0.01),NEC损伤+MSC-CMTNF-α+IL-1β+NO组与对照组病理学评分比较,差异无统计学意义(Z=-0.25,P>0.05)。对照组无NEC发生,单纯NEC损伤组、NEC损伤+MSC-CMNOR组、NEC 损 伤 +MSC-CMTNF-α+IL-1β+NO组 分 别 有 17、16、4只诊断为NEC(NEC发生率为85.0%、80.0%、20.0%);4组NEC发生率比较,差异有统计学意义(χ2=44.00,P<0.001)。
2.3 各组血清和小肠组织中促炎因子和抑炎因子水平对照组、单纯NEC损伤组、NEC损伤+MSC-CMNOR组、NEC 损 伤 +MSC-CMTNF-α+IL-1β+NO组 血 清 中 TNF-α、IL-1β、IL-6、IL-8、IL-10、IL-12 水平比较,差异均有统计学意义(P<0.05);小肠组织中TNF-α、IL-1β、IL-6、IL-10水平比较,差异均有统计学意义(P<0.05)。其中,与单纯NEC损伤组、NEC损伤+MSC-CMNOR组相比,NEC 损伤 +MSC-CMTNF-α+IL-1β+NO组血清中TNF-α、IL-1β、IL-6、IL-8、IL-12水平降低,IL-10水平升高,MSC-CMTNF-α+IL-1β+NO组小肠组织中TNF-α、IL-1β、IL-6水平降低,IL-10水平升高,差异有统计学意义(P<0.01,见表1~2)。
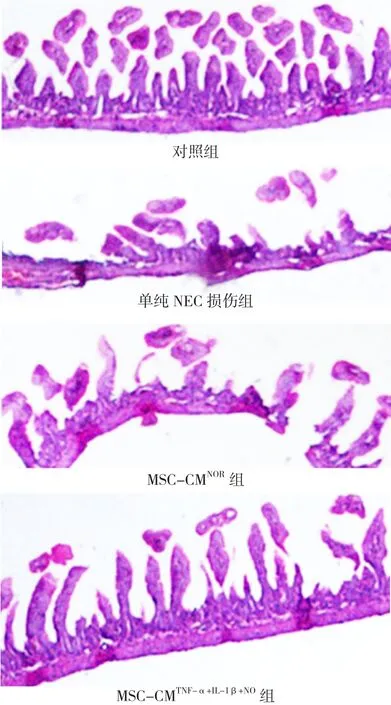
图1 NEC造模后第4天小肠组织病理学改变(苏木素-伊红染色,×100)Figure 1 Histological changes of intestine tissues on the 4th day after NEC modeling
3 讨论
近年来尽管危重新生儿的救治成功率有了很大的提高,但是对于NEC这一个新生儿常见危重症的发病机制尚未明确,对于NEC的预防和治疗亦缺乏有效的方案。随着早产儿出生增加,极低出生体质量儿增加,NEC发病率亦出现逐步增加的趋势,因此亟需探索NEC的发病机制及新的诊治手段。
本研究利用TNF-α、IL-1β和NO模拟肠道炎症环境,造模情况比较理想。首先,本研究结果显示NEC损伤造模成功的新生大鼠均有不同程度的腹胀、腹泻、反应迟钝、活动减少、体质量下降等表现,通过病理学检查可见肠壁出现不同程度的黏膜层和黏膜下层充血、水肿、绒毛坏死脱落,大量炎性细胞浸润。其次,本研究结果显示,与单纯NEC损伤组及NEC损伤+MSCCMNOR组相比,NEC 损伤 +MSC-CMTNF-α+IL-1β+NO组血清中促炎因子TNF-α、IL-1β、IL-6、IL-8、IL-12明显降低,抑炎因子IL-10明显升高,小肠组织中促炎因子TNF-α、IL-1β、IL-6、IL-8明显下降,抑炎因子IL-10明显升高。由此提示炎症预激活MSC-CM对NEC有修复黏膜的作用及抑制肠道炎症的作用。
炎症和氧化应激是NEC重要的发病机制。CARLISLE等[19]报道,NEC发展的早期肠道菌群通过微生物相关分子模式(MAMPs)识别受体如TLR4,激活转录因子核因子(NF)-κB,促进炎性因子和自由基的表达。有研究表明,在NEC患儿的肠道组织及血清中检测到炎性因子如TNF-α、IL-1β、IL-6、IL-8表达增高[20-23]。过度炎症进一步趋化了炎性细胞,如嗜中性粒细胞,诱导活性氧物质的产生,并对肠屏障造成进一步损害,导致细菌移位增加,肠上皮损伤,上皮细胞恢复受损,细胞凋亡和黏膜坏死。因此,严重NEC的恶性循环特征是由细菌侵入、免疫激活、不受控制的炎症产生活性氧和氮物质、肠屏障失效共同造成的[2,12,19,24]。研究证明 IL-12、IL-10 对 NEC 损伤新生大鼠具有保护作用[25-26]。在一些研究中已经显示抗TNF-α疗法能改善NEC[27-28]。MSCs在克罗恩病、放射性肠炎、移植物抗宿主病等诸多模型中均表现出明显的抗炎和免疫调节能力[8,10,29-30]。然而,既往文献及本研究前期研究发现间MSCs这种抗炎及免疫调节能力需要在炎症刺激、缺氧等条件下才得以产生[15,30]。综上所述,MSC-CMNOR对炎性反应的调节不明显,而炎症预激活MSC-CM可调控NEC小肠局部及系统性炎症状态,抑制肠道炎性反应。
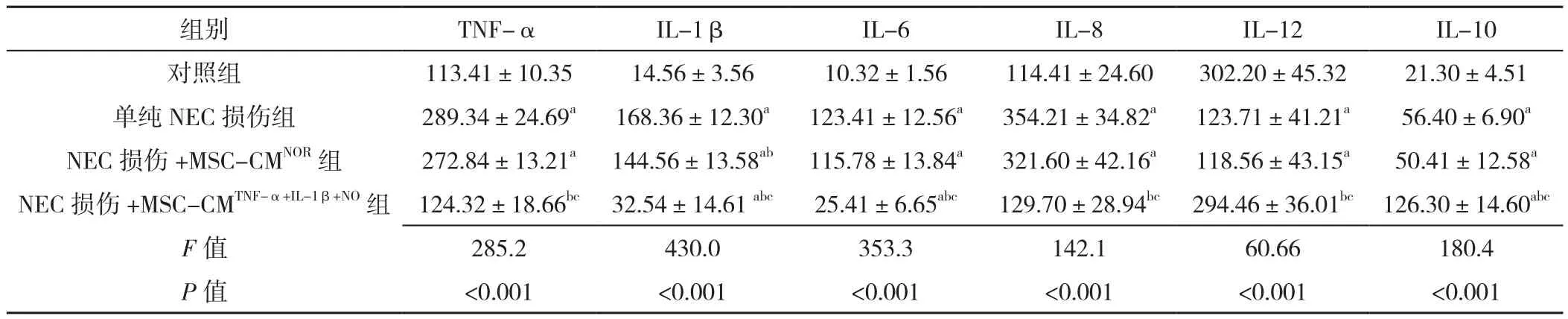
表1 对照组、单纯NEC损伤组、NEC损伤+MSC-CMNOR组、NEC损伤+MSC-CMTNF-α+IL-1β+NO组大鼠血清中促炎因子与抑炎因子水平比较(x ±s,pg/g,n=10)Table 1 Comparison of mean levels of pro-inflammatory and anti-inflammatory factors in rat serum samples from the control group,NEC injury group,NEC injury+MSC-CMNOR group and NEC injury+MSC-CMTNF-α+IL-1β+NO group

表2 对照组、单纯NEC损伤组、NEC损伤+MSC-CMNOR组、NEC损伤+MSC-CMTNF-α+IL-1β+NO组新生大鼠小肠组织中促炎因子与抑炎因子水平比较(x ±s,pg/g,n=10)Table 2 Comparison of mean levels of pro-inflammatory and anti-inflammatory factors in rat small intestine tissues from the control group,NEC injury group,NEC injury+MSC-CMNOR group and NEC injury+MSC-CMTNF-α+IL-1β+NO group
那么炎症预激活MSC-CM调控NEC炎性反应的作用机制如何?MSCs有很强的抗炎能力及可塑性,可通过本身对周围微环境做出应答,通过分泌抗炎因子、免疫抑制因子、生长调节因子等分子,直接参与炎性反应过程,从而促进组织损伤修复[8-10]。与此同时,MSCCM可通过免疫调节因子间接作用于宿主免疫细胞、促进肠道干细胞增殖、分化[8,31],可能也是其重要修复机制,但仍需进一步实验证实。综上所述,炎症预激活MSC-CM可通过调节炎症促进肠道黏膜的修复、改善NEC病情。下一步工作重点应着手于MSCs对肠道微生物菌群、免疫细胞、肠道干细胞的调节,争取为临床诊治NEC提供新的理论依据和途径。
作者贡献:朱小波进行文章的构思与设计,文章的可行性分析,文献/资料收集、整理,撰写论文;马发鑫、冯琳、郑跃进行论文的修订,英文的修订;沙卫红、陈浩负责文章的质量控制及审校,对文章整体负责。
在本课题研究和文章撰写过程中不存在利益冲突。
