反渗透海水淡化后浓盐水养殖卤虫过程中的生理学变化
2019-12-14许泽昊胡海燕唐思敏
许泽昊 胡海燕 唐思敏


摘要 研究了鹵虫在反渗透浓盐水培养条件下体长及生理学随时间的变化。利用反渗透浓盐水扩大培育杜氏盐藻,继而用杜氏盐藻作为饵料培育卤虫,利用体式显微镜测定和记录卤虫的体长和生理学变化。卤虫自出生起16 d内快速生长,1~4 d内,卤虫生长较为缓慢,在此期间卤虫生理学变化明显;4~16 d,卤虫生长快速,且在此期间卤虫完成了无节幼虫阶段到成虫阶段的生理学变化;16~54 d内,卤虫持续生长,最终体长为7.113 mm,在此期间,卤虫已经进入成虫阶段并无明显生理学变化。卤虫可以在反渗透浓盐水中正常生长发育,生理学变化明显。该研究为反渗透海水淡化工程的浓盐水处置利用提供了新思路新方法,并且可以为其创造额外的经济来源。
关键词 反渗透;浓盐水;卤虫;生理学
中图分类号 S917.4文献标识码 A
文章编号 0517-6611(2019)19-0048-05doi:10.3969/j.issn.0517-6611.2019.19.016
Abstract The changes of body growth and physiology of Artemia with time in reverse osmosis saline culture were studied.Dunaliella salina was expanded by reverse osmosis concentrated brine,and then was used as bait to cultivate Artemia.The growth and physiological changes of Artemia were measured and recorded by stereomicroscope.Artemia grew rapidly within 16 days from birth.Within 1 d to 4 d,Artemia grew slowly,but the physiological changes of Artemia were obvious.From 4 d to16 d,Artemia grew rapidly,and during this period Artemia completed physiological changes from the larval stage to the adult stage.From 16 d to 54 d,Artemia continued to grow,and the final body length was 7113 mm.During this period,Artemia had entered the adult stage without obvious physiological changes.The results provide new ideas and methods for the treatment and utilization of desalination brine for reverse osmosis seawater desalination plants.It is possible that a certain additional economic benefits could be achieved.
Key words Reverse osmosis;Concentrated brine;Artemia;Physiology
淡水资源是人类生存和经济发展的基本保障。环境污染问题减少了可利用的淡水资源,世界人口的不断增长使得水资源人均占有量越来越少。面对这种现状,人们开始思索开源节流的新方法。海洋占地表面积约70%,有着丰富的水资源储备,是全球最大的水库,然而海水的高盐度使其无法直接为人们所利用。海水淡化技术在此背景下得到了迅猛的发展,近年来成为缓解沿海地区淡水短缺问题的有效途径之一。随着海水淡化技术不断发展,所提供的淡水资源总量不断上升,供水趋于稳定,并且不受气候影响,价格也呈现下降趋势。海水淡化技术已成为供水市场非常重要的组成部分。随着全世界范围内大力推广海水淡化技术,海水淡化的规模和工程量也在飞速增长。在满足了人们淡水需求的同时,也造成了一系列的问题,其中最为突出的是浓缩高盐度废水的处置利用问题(简称“海水淡化后浓盐水”或“浓盐水”)。
目前,如何安全处置和利用海水淡化过程中产生的废水仍然是一个需要特别关注的问题,在技术方面和经济领域都面临着挑战[1]。海水淡化的生产过程会产生基本与淡水产品等量的浓盐水。由于在工艺过程中需要添加一些化学药剂,因此浓盐水并不等同于浓缩的海水,其许多物理、化学性质都与普通海水不同,其中电导率、密度、盐度等都与普通海水有明显差异,其所含Na、Mg、K、Br等元素是普通海水的数倍之多[2]。现如今约有177个国家和地区共计15 906个海水淡化工程正在运行[3],大部分海水淡化厂对于浓盐水的处置都是将其直接排入附近海域,长期下来,对附近海域造成盐度冲击,进而影响生态环境[4]。如能找到合理利用浓盐水的途径,则有可能将问题转变为机遇。
卤虫(Artemia)是一种微型甲壳类动物,在地球上已经繁衍了4亿年[5],它在分类学上属于节肢动物门(Phylum Arthropoda),甲壳纲(Class Crustacea),鳃足亚纲(Subclass Branchiopoda),无甲目(Order Anostraca),盐水丰年虾科(Family Branchinectidae),卤虫属(Cenus Artemia)[6],广泛生活在世界范围内的天然咸水湖和盐田中。卤虫富含蛋白质和不饱和脂肪酸,是一种广泛应用于水产养殖幼体苗种育种的重要活体饲料[7]。近年来,卤虫已经成为一种广受欢迎的模型动物,主要用于研究水产养殖[8-10]、急性毒性[11-13]、分子生物学[14-16]等领域。
卤虫有孤雌生殖和两性生殖2种品系,具有生殖隔离和种间差异。为了应对生存环境的变化,卤虫进化出2种生殖方式:卵生和卵胎生。在环境适宜的条件下,卤虫进行卵胎生,产下无节幼虫,扩大种群优势。在环境恶劣的条件下,卤虫进行卵生,产下休眠卵,休眠卵中的细胞保持特别低的新陈代谢水平,其他合成物质过程完全停止,休眠时间可以达到相当长,以保护种群渡过困境,继续生存。休眠卵如果不经过外界环境刺激活化,不会孵化产生无节幼虫。卤虫正是拥有独一无二的繁殖方式[17],才使种群生生不息。
1831年,杜氏盐藻(Dunaliella salina Teodoresce)在欧洲地中海地区被第一次发现。杜氏盐藻是一种耐高盐(0.5~5.5 mol/L)的单细胞海洋微藻,没有细胞壁,在分类学上属于绿藻门,绿藻纲,团藻目,多毛藻科,杜氏藻属[18]。杜氏盐藻细胞内色素种类随着生活条件的差异而不同,同时合成的物质也不同。在胁迫条件下,可以积累大量天然色素,例如类胡萝卜素、蛋白质、维生素和脂类[19]。杜氏盐藻是一种公认的具有独特经济价值的微藻[20]。
通过对卤虫连续投喂杜氏盐藻,探究卤虫的生长、发育情况,利用Leica EZ4W体式显微镜定时观察卤虫,并拍照,记录下卤虫生理学变化,为卤虫的扩大培育提供理论依据。
1 材料与方法
1.1 材料
1.1.1 杜氏盐藻的扩大培养。
杜氏盐藻由中国海洋大学海洋污染生态化学实验室藻种室提供,所用培养基为f/2培养基,121 ℃,20 min,高压灭菌,接种比例为1∶9。光暗比12 h∶12 h,(25±1)℃,每天摇动2次,使沉在锥形瓶底部的杜氏盐藻重新悬浮。
1.1.2 浓盐水。
所使用浓盐水由浙江省舟山市岱山绿源海水淡化有限公司提供,海水淡化技术为反渗透海水淡化技术。
经测定,在25 ℃下,试验用浓盐水pH 7.63~7.66,DO 8.6~8.9 mg/L,盐度36.3~41.5,Cl- 21.655~22.147 g/L,Na+13.495~14.105 g/L,
Mg2+2.047~2.223 g/L,Ca2+0.554~0.568 g/L。CODMn、N、P均未检出。
1.1.3 卤虫。
孵化条件控制:室温,浓盐水,盐度40,24 h光照。孵化期间使用充气泵充气使卤虫卵充分悬浮。孵化后,收集无节幼虫进行第一代培育,投喂杜氏盐藻。将第一代成虫繁殖的无节幼虫取出,进行试验。
1.2 方法
将无节幼虫放入50 mL离心管中培育,每天投喂足量杜氏盐藻,每天换水,定时用Leica EZ4W体视显微镜测定卤虫体长和拍照。
1.3 数据处理
数据用IBM SPSS Statistics 24和origin 8.5分析处理。
2 结果与分析
2.1 卤虫体长变化 卤虫自出生起16 d内快速生长,1~4 d内,卤虫生长较为缓慢,在此期间卤虫生理学变化明显。4~16 d,卤虫生长快速,且在此期间卤虫完成了无节幼虫阶段到成虫阶段的生理学变化。16~54 d内,卤虫持续生长,最终体长为7.113 mm,在此期间,卤虫已经进入成虫阶段并无明显生理学变化(图1)。
2.2 卤虫生理学变化 如图2所示,卤虫的孵化期,显微镜倍数为35倍。由图2a可知,卤虫休眠卵呈棕色,颗粒大小似细砂粒,在经过收集、去杂质和干燥等一系列加工程序后,卤虫休眠卵呈凹陷的球形状。将卤虫休眠卵投放至盐度小于30的水中,卤虫休眠卵吸水呈充气皮球形状。将卤虫休眠卵置于浓盐水中,24 h光照,室温,并24 h曝气。此时休眠卵受到环境刺激,开始进行代谢活动,经过24~48 h后,卵的外壳开始破裂,无节幼体从其中破壳而出(图2b)。无节幼体因为孵化膜而无法完全与壳分离,经过几个小时后无节幼体才会完全与壳分离(图2c)。孵化后的卤虫呈土黄色,是因为无节幼虫早期体内含有大量的卵黄,体长为0.4~0.5 mm(图2d)。卤虫拥有1只单眼,3对附肢。3对附肢分别为具有感觉功能的第1触角;具有運动和摄食功能的第2触角;具有摄食功能的大颚。最为明显的是无节幼虫的胸部具有1对较大的叶片状胸肢,负责卤虫的主要运动功能。这个时期,无节幼虫消化系统和摄食系统并没有发育,因此无节幼虫的主要营养来源为自身的卵黄。经过几个小时后,卤虫消化系统和摄食系统逐渐发育成熟,开始摄食粒径50 μm以下的食物,开始快速生长并伴随明显的形态特征变化。
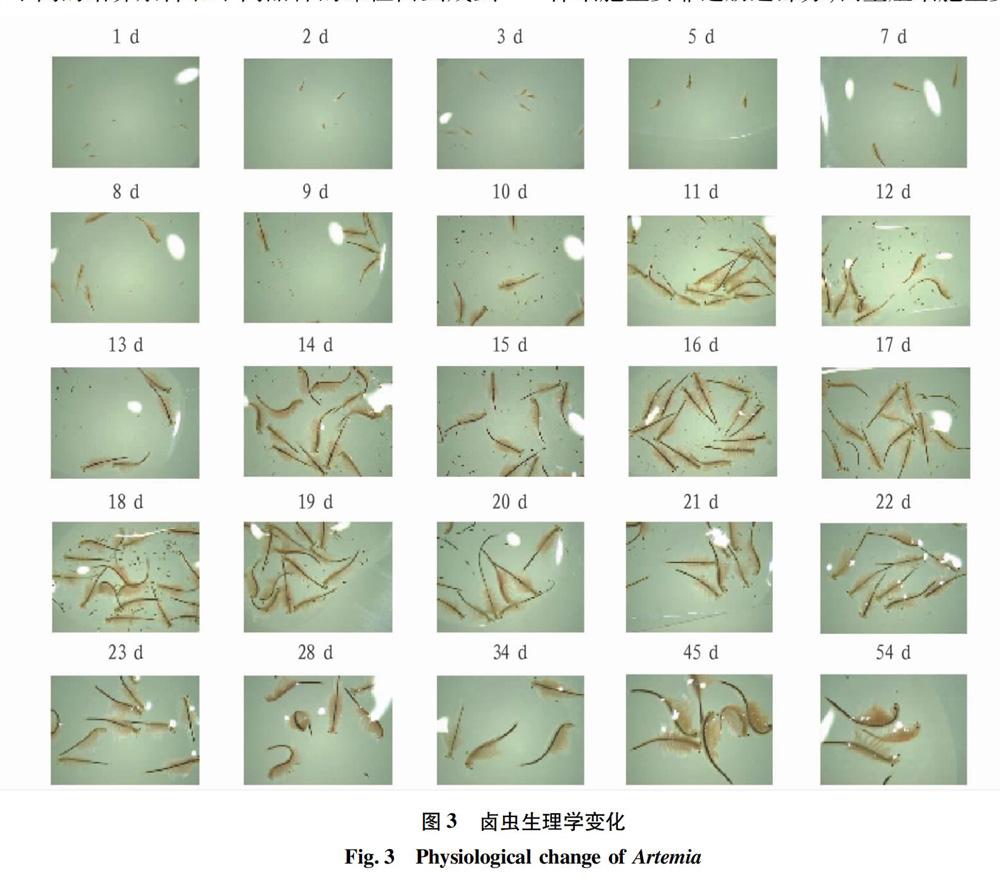
如图3所示,卤虫的生长期,显微镜倍数为8倍。1~3 d,卤虫无节幼体消耗自身卵黄,宽度减少,开始进行摄食,长度增加。卤虫无节幼体开始生长出额外附肢,同时胸部开始生长并形成第6胸节,第7胸节开始弯曲。胸部附肢的第1对附肢和第2对附肢开始分化出叶片状具有运动功能的小叶。第1触角分化出一些附属组织,使得卤虫无节幼体的感觉功能更加强大。卤虫无节幼体第2触角具有运功和阻挡大颗粒食物的功能,并将小颗粒的食物输送至叶片状胸肢下方,此时大颚可以收集粒径合适的食物。在这个阶段,叶片状胸肢是卤虫无节幼体的重要摄食工具。同时,最为明显的变化是卤虫无节幼体的1对复眼从头部单眼两侧开始突起并分化,使得卤虫视觉更加强大。卤虫无节幼体在此阶段运动能力、摄食能力和趋光性更加强大。卤虫无节幼体会向光源强烈聚集,该特性使得卤虫无节幼体的收集变得更加简便。卤虫粪便极少,颗粒较小。
4~5 d,卤虫无节幼体持续摄食杜氏盐藻,运动能力越强,摄食量越大,此期间卤虫体长开始快速增长。卤虫无节幼体从土黄色转变为暗灰色,食道因为摄食杜氏盐藻变为浅绿色。此期间,卤虫无节幼体第1触角分化完整的感知附属物触毛,单眼旁边的复眼分化完全并出现眼柄。卤虫无节幼体第2触角丧失运动能力,同时退化了辅助摄食能力,卤虫无节幼体雄性的第2触角分化出斧头状抱器,而卤虫无节幼体雌性的第2触角变成具有感觉器官的触角。锯齿状的磨齿由大颚分化而来,大颚和触角的须逐渐缩短,另外形成的2对小颚逐渐转变为成熟的卤虫成体的结构。位于卤虫无节幼体胸部的11对片叶状胸足开始发育和成熟,形成了具有运动能力,筛选食物粒径的能力和将食物转移至颊部的能力。这一时期的卤虫无节幼体已经与卤虫无节幼体前期有明显差异,运动能力和摄食能力因复眼的发育成熟和附肢数量增多,分化出独特功能而极大增强。同时卤虫无节幼体的趋光性并没有明显减弱,仍然可以利用趋光性便捷收集卤虫无节幼体,省去大量人工费用和时间成本。卤虫粪便增多,颗粒较小。
5~8 d,卤虫从无节幼体阶段到成虫阶段跨越。卤虫无节幼体持续摄食杜氏盐藻,由于附肢和复眼的发育成熟,运动能力增强,摄食量增大,此期间卤虫体长快速增长。在此期间,由于卤虫无节幼体开始发育成成虫,各个器官由于性别不同而分化成具有特异功能的组织和器官,为繁殖做好准备。卤虫整体呈橙红色,消化道由于摄食杜氏盐藻呈浅绿色。卤虫的头部占整体的1/4,胸部占整体的1/2,消化道贯穿胸部占整体的3/4。卤虫游泳姿态逐渐转变成仰泳。卤虫的体长和身宽以及性别不同而导致的辅助结构和形态特征逐渐成熟。雄性卤虫成虫分化出1对半阴茎、副腺和储存精子的精巢,第2触角变为1对执握器;雌性卤虫成虫分化出储存卵子的卵巢、输送卵子的输卵管、壳腺以及卵囊,卵囊逐渐变大并且慢慢宽于胸部上的腹节,卵囊上形成2对尖刺的锥刺。卤虫粪便明显增多,颗粒开始增大。
9~16 d,卤虫完成了从无节幼体阶段到成虫阶段跨越。卤虫成虫持续摄食杜氏盐藻,由于附肢和复眼的发育成熟,运动能力增强,摄食量增大,此期间卤虫体长快速增长。此期间,卤虫成虫的形态特性发育完全。卤虫整体呈橙红色,消化道由于摄食杜氏盐藻呈浅绿色。头部在运动过程中弯曲,身体在运动过程中是呈“S”状。卤虫的头部占整体的1/10,胸部占整体的1/2,消化道贯穿胸部占整体的9/10。卤虫成虫身体可明显分辨出是由3个部分组成,分别由5个体节、11个体节、8个体节组成。雄性卤虫成虫完全发育出具有抱握能力的抱持器,可以在繁殖期间紧抱雌性卤虫成虫进行繁殖,无特殊外界刺激时,几乎不会松开雌性卤虫成虫。雄性卤虫成虫成功将第1腹节和第2腹节退化形成的生殖节分化出半阴茎的基阴茎组织和末阴茎组织形成棘和突起。雌性卤虫成虫在第1腹节和第2腹节退化形成的生殖节形成卵囊,卵囊逐渐增加,并形成显微镜可清楚观察的卵母细胞,随着时间的推移卵母细胞逐渐进入卵囊附近的输卵管中,可以受精,也可以不受精,随后移动到卵囊中的子宫中,在雌性卤虫成虫的子宫内培育到4 000个细胞左右的原肠胚期。接下来,如果环境适宜,适合种群扩大繁殖,雌性卤虫成虫会卵胎生,产下数目众多的无节幼体;如果环境恶劣,不适合种群扩大繁殖,雌性卤虫成虫会卵生,产下数目众多、能够抗击外界环境的休眠卵。卤虫成虫趋光性明显减弱,利用趋光性收集卤虫不可行。卤虫粪便明显增多,颗粒开始增大。
16~21 d,卤虫体长增长变慢,基本生态特征与之前无明显改变。卤虫成虫趋光性明显减弱,利用趋光性收集卤虫不可行。卤虫粪便明显增多,颗粒开始增大。
21~54 d,卤虫体长增长明显变慢,基本生态特征与之前无明显改变。卤虫成虫趋光性明显减弱,利用趋光性收集卤虫不可行。卤虫粪便明显增多,颗粒开始增大。
雌性卤虫成虫的卵巢发育对卤虫种群的扩大和繁殖下一代具有重要影响。雌性卤虫成虫拥有1对卵巢,位于消化道的两侧,呈条带状分布,从胸部的第11体节贯穿生殖节(第1腹节和第2腹节退化形成)延伸至腹部。可以通过显微镜观察到卵巢的周期性变化。雌性卤虫成虫的卵巢中生殖细胞发育过程中形成卵黄从而引起雌性卤虫成虫卵巢的周期性变化。雌性卤虫成虫的卵巢发育周期可分为以下7个阶段:卵原细胞期、卵母细胞期(卵黄发生前)、卵黄发生的早期、卵黄发生的晚期、胚胎发育早期、胚胎发育中期、胚胎发育晚期[21]。不同的培养条件和不同品种的雌性卤虫成虫排卵周期不同,大致为140 h。在卵黄未出现之前,卵巢呈透明色。当卵黄开始产生后,卵巢开始产生少许棕色的小球。随着卵黄持续增加,卵巢上棕色的小球也开始增多,且逐渐变大。
通过显微镜观察可知,卵巢内由体细胞和生殖细胞2种细胞组成。生殖细胞分为卵原细胞,由卵原细胞分化而来的初级卵母细胞,滋养细胞,次级卵母细胞和成熟的卵细胞。体细胞主要靠近肠道部分,而生殖细胞主要靠近另一侧。
3 结论与讨论
杜氏鹽藻是一种无纤维质细胞壁且具有鞭毛的海洋微藻[22],长为18~28 μm,宽为9.5~14.0 μm,同时富含蛋白质、多糖、甘油、不饱和脂肪酸等利于卤虫生长的物质[20,23]。卤虫是滤食生物,对于食物没有偏好,只要粒径小于50 μm的颗粒物质都会被卤虫摄食。卤虫的生长发育主要取决于食物的粒径和食物所含营养物质的丰富度。为了满足养殖鱼类的赖氨酸需求,马静等[24]对卤虫进行了赖氨酸的营养强化,分别用赖氨酸、裂壶藻和赖氨酸混合裂壶藻作为试验对照组,其中裂壶藻试验组对卤虫的部分游离氨基酸有明显增长。张跃群等[25]采用湛江叉鞭金藻、亚心形扁藻以及小球藻3种微藻对卤虫无节幼体进行营养强化,以卤虫无节幼体体长、所含EPA和DHA的量和蛋白质作为监测指标,试验证明3种微藻对卤虫的营养强化各有不同。其中张跃群等[25]特别提到小球藻自身所含蛋白质等营养物质均高于其他微藻,但是由于小球藻细胞壁较厚,卤虫无节幼体无法消化,因此小球藻营养强化效果并不理想。黄旭雄等[26]选取小球藻、新月菱形藻、等鞭金藻、螺旋藻粉和其他强化剂对卤虫成虫进行营养强化,测定卤虫成虫体内必需脂肪酸变化。大量的卤虫营养强化试验证明,卤虫的营养强化成效与营养强化的饵料种类、营养强化方式、营养强化浓度、营养强化持续时间、营养强化的卤虫品系等因素有关。杜氏盐藻充分符合卤虫的摄食条件,因此投喂杜氏盐藻的卤虫能够顺利生长、发育和繁殖。该研究实现了利用反渗透浓盐水扩大培养杜氏盐藻,进而培育卤虫,且卤虫生长状况良好。试验结果为反渗透海水淡化工程的浓盐水处置利用提供了新思路新方法,若能推广实施,可为海水淡化厂创造一定的经济价值。
参考文献
[1]ROBERTS D A,JOHNSTON E L,KNOTT N A.Impacts of desalination plant discharges on the marine environment:A critical review of published studies[J].Water research,2010,44(18):5117-5128.
[2] AHMED M,SHAYYA W H,HOEY D,et al.Brine disposal from reverse osmosis desalination plants in Oman and the United Arab Emirates[J].Desalination,2001,133(2):135-147.
[3] SHAH M M R,LIANG Y M,CHENG J J,et al.Astaxanthin-producing green microalga Haematococcus pluvialis:From single cell to high value commercial products[J].Frontiers in plant science,2016,7:531.
[4] HASHIM A,HAJJAJ M.Impact of desalination plants fluid effluents on the integrity of seawater,with the Arabian Gulf in perspective[J].Desalination,2005,182(1/2/3):373-393.
[5] DATTILO A M,BRACCHINI L,CARLINI L,et al.Estimate of the effects of ultraviolet radiation on the mortality of Artemia franciscana in naupliar and adult stages[J].International journal of biometeorology,2005,49(6):388-395.
[6] LAVENS P,LGER P,SORGELOOS P.Manipulation of the fatty acid profile in Artemia offspring produced in intensive culture systems[J] Aquaculture-A biotechnology in progress,1989,1:731-739.
[7] SORGELOOS P,DHERT P,CANDREVA P.Use of the brine shrimp,Artemia spp.,in marine fish larviculture[J].Aquaculture,2001,200(1/2):147-159.
[8] ZHENG C Q,JESWIN J,SHEN K L,et al.Detrimental effect of CO2driven seawater acidification on a crustacean brine shrimp,Artemia sinica[J].Fish & shellfish immunology,2015,43(1):181-190.
[9] LOPESDOSSANTOS R M A,GROOT R,SUI L Y,et al.Halophilic bacteria as a food source for the brine shrimp Artemia[J].Aquaculture,2019,500:631-639.
[10] MAMONTOV E.Microscopic diffusion in hydrated encysted eggs of brine shrimp[J].Biochimica et biophysica acta (BBA)General subjects,2017,1861(9):2382-2390.
[11] AN H J,SARKHEIL M,PARK H S,et al.Comparative toxicity of silver nanoparticles (AgNPs) and silver nanowires (AgNWs) on saltwater microcrustacean,Artemia salina[J].Comparative biochemistry and physiology.Part C:Toxicology & pharmacology,2019,218:62-69.
[12] LACAVE J M,FANJUL ,BILBAO E,et al.Acute toxicity,bioaccumulation and effects of dietary transfer of silver from brine shrimp exposed to PVP/PEI-coated silver nanoparticles to zebrafish[J].Comparative biochemistry and physiology.Part C:Toxicology & pharmacology,2017,199:69-80.
[13] LAVTIZAR V,KIMURA D,ASAOKA S,et al.The influence of seawater properties on toxicity of copper pyrithione and its degradation product to brine shrimp Artemia salina[J].Ecotoxicology and environmental safety,2018,147:132-138.
[14] TANAMATAYARAT P.Antityrosinase,antioxidative activities,and brine shrimp lethality of ethanolic extracts from Protium serratum(Wall.ex Colebr.) Engl.[J].Asian Pacific journal of tropical biomedicine,2016,6(12):1050-1055.
[15] CHANG X J,ZHENG C Q,WANG Y W,et al.Differential protein expression using proteomics from a crustacean brine shrimp (Artemia sinica) under CO2-driven seawater acidification[J].Fish & shellfish immunology,2016,58:669-677.
[16] ROO J,HERNNDEZCRUZ C M,MESARODRIGUEZ A,et al.Effect of increasing n-3 HUFA content in enriched Artemia on growth,survival and skeleton anomalies occurrence of greater amberjack Seriola dumerili larvae[J].Aquaculture,2019,500:651-659.
[17] DAI L,CHEN D F,LIU Y L,et al.Extracellular matrix peptides of Artemia cyst shell participate in protecting encysted embryos from extreme environments[J].PLoS One,2011,6(6):1-9.
[18] ETTL H.Taxonomische bemerkungen zuden phytononadina[J].Nova hedvigia,1983,35:731-736.
[19] FIECHTER A.Advances in biochemical engineering[M].Berlin:Springer-Verlag,1980.
[20] 胡蓓娟,王雪青,黄丹虹,等.盐藻培养基的优化研究[J].食品科学,2006,27(12):384-388.
[21] 陈苏.卤虫卵黄蛋白原的分子特征及其在卤虫休眠过程中的功能研究[D].杭州:浙江大学,2011.
[22] BENAMOTZ A,AVRON M.The role of glycerol in the osmotic regulation of the halophilic alga Dunaliella parva[J].Plant physiology,1973,51(5):875-878.
[23] 凌娜,仲星,李紅秀,等.杜氏盐藻对不同价态铁的吸收机制研究[J].中国海洋药物,2015,34(3):29-34.
[24] 马静,邹安革,王新星,等.不同强化物质对卤虫体内游离氨基酸含量的影响[J].渔业科学进展,2012,33(1):102-108.
[25] 张跃群,陈爱华,张雨,等.微藻营养强化对卤虫生长和营养成分的影响[J].中国农业大学学报,2018,23(8):77-84.
[26] 黄旭雄,王瑞,吕耀平,等.不同强化饵料对卤虫必需脂肪酸组成的影响[J].水产科学,2005,24(10):1-4.
