水稻MYB-MYC基因家族的全基因组鉴定、系统进化和表达模式分析
2019-12-10陈守坤王成微李家伟李海峰
刘 玥,陈守坤,王成微,李家伟,李海峰
(旱区作物逆境生物学国家重点实验室,西北农林科技大学 农学院,陕西杨凌 712100)
转录因子在植物生长发育和逆境胁迫中起到了关键作用。MYB-MYC(R2R3-MYB and MYC transcription factors N-terminal)基因家族是一类植物特有的转录因子家族,其保守结构域通常由2个部分组成,在其N端含有1个R2R3-MYB结构域[1]和1个MYC结构域[2]。 迄今为止,在拟南芥和水稻中分别鉴定到5个AtMYB-MYC基因,如:AtMYC1[3]、AtMYC2[4]、AtMYC3、AtMYC4[5]和AtMYC5[6]以及2个OsMYB-MYC基因,如:OsMYC1[7]和OsMYC2[8]。这些基因广泛参与拟南芥和水稻的生长发育以及响应非生物胁迫[9]。但是MYB-MYC作为一个基因家族,在水稻基因组中仍然没有鉴定和深入研究。
水稻是世界上重要的粮食作物之一[10],作为禾本科模式植物,其基因组的组成比较简单。2002年水稻基因组测序的完成,为水稻基因组学的研究提供了基础[11]。水稻的基因组较小,易于进行遗传转化,并且对其他禾本科植物如:二岁短柄草和小麦有良好的基因组共线性关系,水稻的基因组研究可以为其他禾本科植物的进化关系提供理论依据[12]。鉴于此,本研究利用最新的水稻基因组数据库,通过生物信息学方法,对水稻MYB-MYC基因家族在全基因组水平上进行鉴定,并进一步分析其染色体分布、保守结构域、基因结构、启动子顺式作用元件、GO功能注释、蛋白质互作网络、基因复制及表达模式,以期更好地了解MYB-MYC基因特性、进化关系和基因功能,为研究MYB-MYC的基因功能提供有益信息。
1 材料与方法
1.1 水稻MYB-MYC家族成员的全基因组鉴定
首先在Ensembl Plants 数据库(http://plants.ensembl.org/index.thml)中下载水稻的全基因组数据。同时在Pfam数据库(http://pfam.xfam.org/)中下载MYB-MYC_N结构域(PF14215.6)作为搜索模型,利用HMM 3.0软件筛选水稻中含有该结构域的蛋白质序列。此外将水稻的全基因组蛋白质序列构建本地数据库,使用TAIR数据库(https://www.arabidopsis.org/)中拟南芥的MYB-MYC蛋白质序列进行BLASTP搜索。将上述2种方法筛选到的候选蛋白质序列合并,去除重复、测序不完全和没有完整编码框的蛋白质序列。利用Pfam和NCBI-CDD数据库对候选蛋白质进行检测,去掉不完整结构域的蛋白质序列,最终得到水稻MYB-MYC基因家族序列。利用ExPASy(http://web.expasy.org/protparam/)在线软件对水稻MYB-MYC蛋白质的分子质量、氨基酸长度和等电点进行分析;利用Cello软件进行亚细胞定位分析[13]。
1.2 系统发育树的构建、基因结构及保守结构域序列分析
将水稻与其他植物的MYB-MYC蛋白质整合,进行多重序列比对;使用MEGA7软件采用邻接法(NJ),Bootstrap值设置为1 000,构建系统发育树[14]。使用MEME工具(http://meme-suit/org/)预测水稻的MYB-MYC蛋白质序列中的保守序列位点。根据OsMYB-MYC基因的CDS序列和DNA基因组序列,利用在线软件GSDS 2.0(http://gsds.cbi.pku.cn/)分析其基因结构并进行可视化。
1.3 启动子顺式作用元件和GO注释分析
提取OsMYB-MYC基因上游1.5 kb的基因组序列,使用启动子预测数据库PlantCare(http://bioinformatice.psb.ugent.be/webtools/plantcare/html)进行顺式作用元件预测。将水稻MYB-MYC蛋白质序列提交到Plant Transcriptional Regulatory Map[15]和PLAZA数据库[16]中进行GO注释,整合得到的GO号,使用BGIWEGO进行可视化[17]。
1.4 染色体定位、基因复制事件和共线性分析
根据水稻的基因组注释信息(http://plants.ensembl.org/index.thml)获得OsMYB-MYC基因的染色体位置信息。利用MCScanX软件进行基因复制分析[18],最后使用Circos v 0.67软件对染色体定位和共线性基因对进行可视化[19]。使用KaKs_calculator软件[20]计算共线性基因对的Ka/Ks值,用于评估其进化选择情况。
1.5 蛋白互作网络分析
使用同源蛋白分析的方法,将OsMYB-MYC基因在拟南芥中进行比对,筛选出OsMYB-MYC在拟南芥中的直系同源基因,并提交到AraNetV2数据库[21]中,进一步得到蛋白质互作网络关系,利用Cytoscape软件[22]进行可视化。
1.6 表达模式分析
使用NCBI-SRA数据库(https://www.ncbi.nlm.nih.gov/sra/)下载水稻转录组数据:即水稻的根(SRR1618549)、花药(SRR1618546)、心皮(SRR1618547)和种子(SRR1618548)。使用TopHat和Cufflinks软件进行转录组分析[23],计算OsMYB-MYC基因在不同组织中的FPKM值[24]。使用GEO数据库(https://www.ncbi.nlm.nih.gov/gds/?term=)下载水稻在干旱胁迫和盐胁迫下的表达量数据,登录号为GSE60287[25]。使用GEOquery软件包分析OsMYB-MYC基因在干旱胁迫和盐胁迫下的表达量。使用R语言Pheatmap软件包对表达谱进行可视化。
2 结果与分析
2.1 水稻MYB-MYC家族成员的鉴定
利用HMM和BLAST 2种比对方法,从水稻基因组中共鉴定出21个MYB-MYC转录因子作为候选基因。之后使用Pfam、NCBI-CDD 2个数据库对得到的21条水稻MYB-MYC候选蛋白进行保守结构域完整性检测,其中发现有17条具有完整的MYB-MYC保守结构域,另外4条由于结构域残缺而被去除。最终得到的17条水稻MYB-MYC候选蛋白序列,占已注释的水稻基因组的0.046%,并按照其位于染色体上的物理位置进行命名(表1)。根据蛋白质序列长度分析发现,水稻MYB-MYC转录因子序列长度为180~904 aa,分子质量为20.26~97.39 ku,其中OsMYB-MYC03含有最长的氨基酸序列,长度为904 aa,OsMYB-MYC08含有最短的氨基酸序列,长度为180 aa。转录因子的亚细胞定位对于其功能具有借鉴作用。根据Cello在线软件的亚细胞定位结果显示,所有的水稻MYB-MYC转录因子都可以预测到亚细胞定位,其中11个定位于细胞核,4个定位于叶绿体,2个定位于细胞质,极少数定位于细胞质膜上。
2.2 系统发育树的构建、蛋白质保守结构域和基因结构分析
为了分析水稻MYB-MYC转录因子家族的进化关系,将22个拟南芥、10个二穗短柄草,49个小麦MYB-MYC转录因子进行合并,使用其全长蛋白质序列,利用MEGA 7软件中的NJ法,采用模型为泊松模型构建系统进化树。如图1所示,根据构建的系统进化树的分支和bootstrap值,笔者将水稻MYB-MYC转录因子家族分为Ⅰ、Ⅱ亚家族,每个亚家族可以分为若干个亚组。如:亚家族Ⅰ包括1、2、3亚组;亚家族Ⅱ包括了3、4、5亚组。根据系统进化树,MYB-MYC转录因子在水稻,拟南芥,小麦,二穗短柄草中的同源性很高,表明MYB-MYC转录因子物种分化过程中非常保守。同时,所有的MYB-MYC转录因子都在单子叶和双子叶植物中发现,即MYB-MYC转录因子在单子叶植物和双子叶植物中的聚类没有偏好性。这表明,MYB-MYC转录因子发生的进化时间要早于拟南芥、二穗短柄草、水稻和小麦的分化时间。

表1 水稻MYB-MYC基因家族基因的特征Table 1 Characterization of MYB-MYC gene family in rice

图1 水稻、拟南芥、小麦和二穗短柄草MYB-MYC基因家族的系统进化树Fig.1 Phylogenetic tree of MYB-MYC genes in rice,Arabidopsis, wheat and Brachypodium distachyon
通过对水稻MYB-MYC转录因子的保守结构域进行分析,共识别到两类保守结构域,分别为MYB-MYC保守结构域和bHLH保守结构域。每个转录因子都含有MYB-MYC保守结构域,部分转录因子含有bHLH保守结构域。利用MEME软件对水稻MYB-MYC蛋白质的保守基序组成和数目进行了分析,结果发现,总共识别到10个保守基序motif,并依次命名为motif 1到motif 10。如图2-c所示,motif 4和motif 6作为MYB-MYC结构域的保守基序出现在所有的水稻MYB-MYC转录因子中,motif 1 只出现在bHLH结构域中,作为HLH结构域的保守基序;motif 8存在于1、2、3亚组中,motif 9只存在于第5亚组中,这些基序可以作为识别不同亚组的标志。这表明,MYB-MYC在进化过程中,存在着内部的分化,进一步可能导致功能的分化。
为了进一步预测基因功能和进化关系,利用OsMYB-MYC基因的CDS和DNA基因组序列进行了OsMYB-MYC基因结构分析。结果表明,OsMYB-MYC基因的外显子数量由1到10呈现不均匀分布。其中亚家族Ⅲ的外显子数量多,平均含有10个外显子。此外OsMYB-MYC13和OsMYB-MYC14只含有1个外显子。
根据保守基序分析和基因结构分析可知,虽然保守基序数量以及外显子、内含子长度有一定的差异,但是相同亚家族成员的保守基序和基因结构高度保守。
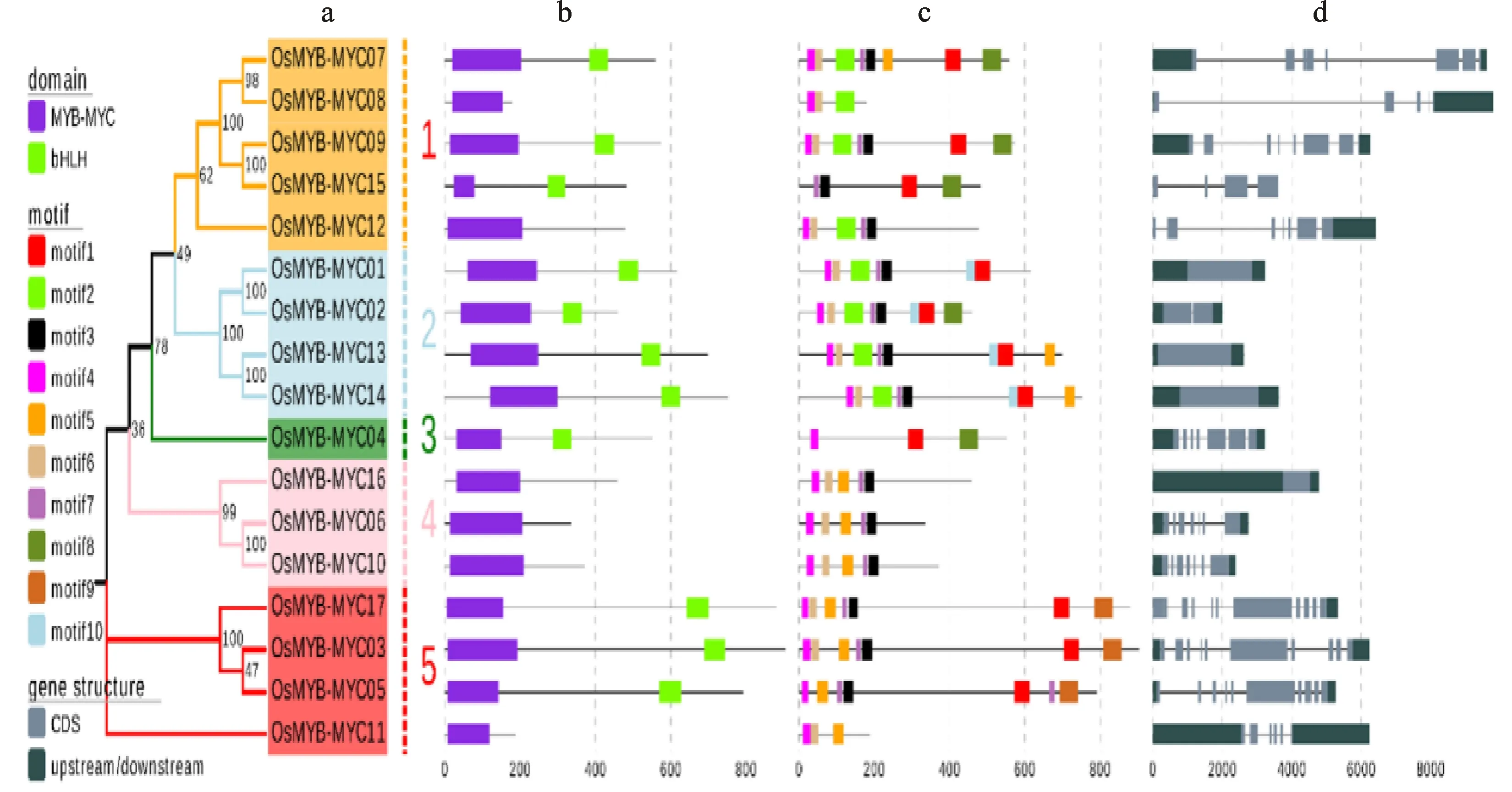
图2 水稻MYB-MYC基因家族的系统进化(a)、保守结构域(b)、保守基序(c)和基因结构(d)Fig.2 Phylogenetic relationships (a), conserved domain(b), conserved motifs(c) and gene structure(d) of MYB-MYC genes in rice
2.3 启动子顺式作用元件和GO注释分析
为了更好地了解水稻MYB-MYC转录因子的功能,将所有的水稻MYB-MYC转录因子进行基因本体(Gene ontology)注释。GO注释主要包括细胞成分(Cellular component)、分子功能(Molecular function)和生物过程(Biological process)3部分。如图3所示,在细胞成分中, 70.6%的OsMYB-MYC蛋白参与细胞内成分的构成,少于60%的蛋白可参与植物细胞内细胞器的构成。在分子功能方面,超过80%的蛋白能够与其他蛋白质结合,来发挥其在植物体内的生物学功能;41.2%的OsMYB-MYC蛋白能够参与杂环化合物的形成;少于20%的OsMYB-MYC蛋白具有催化作用。对水稻OsMYB-MYC蛋白参与的生物过程进行分析,发现有52.9%的蛋白参与细胞进程,47.1%的蛋白参与代谢以及生物调节过程,另有少于20%的OsMYB-MYC蛋白可在水稻信号传导及逆境胁迫和植物生殖器官的发育中起到调控作用。通过上述结果,推测水稻OsMYB-MYC蛋白可通过与其他蛋白的结合,来调节水稻体内一些生物学过程,从而响应一些非生物胁迫。
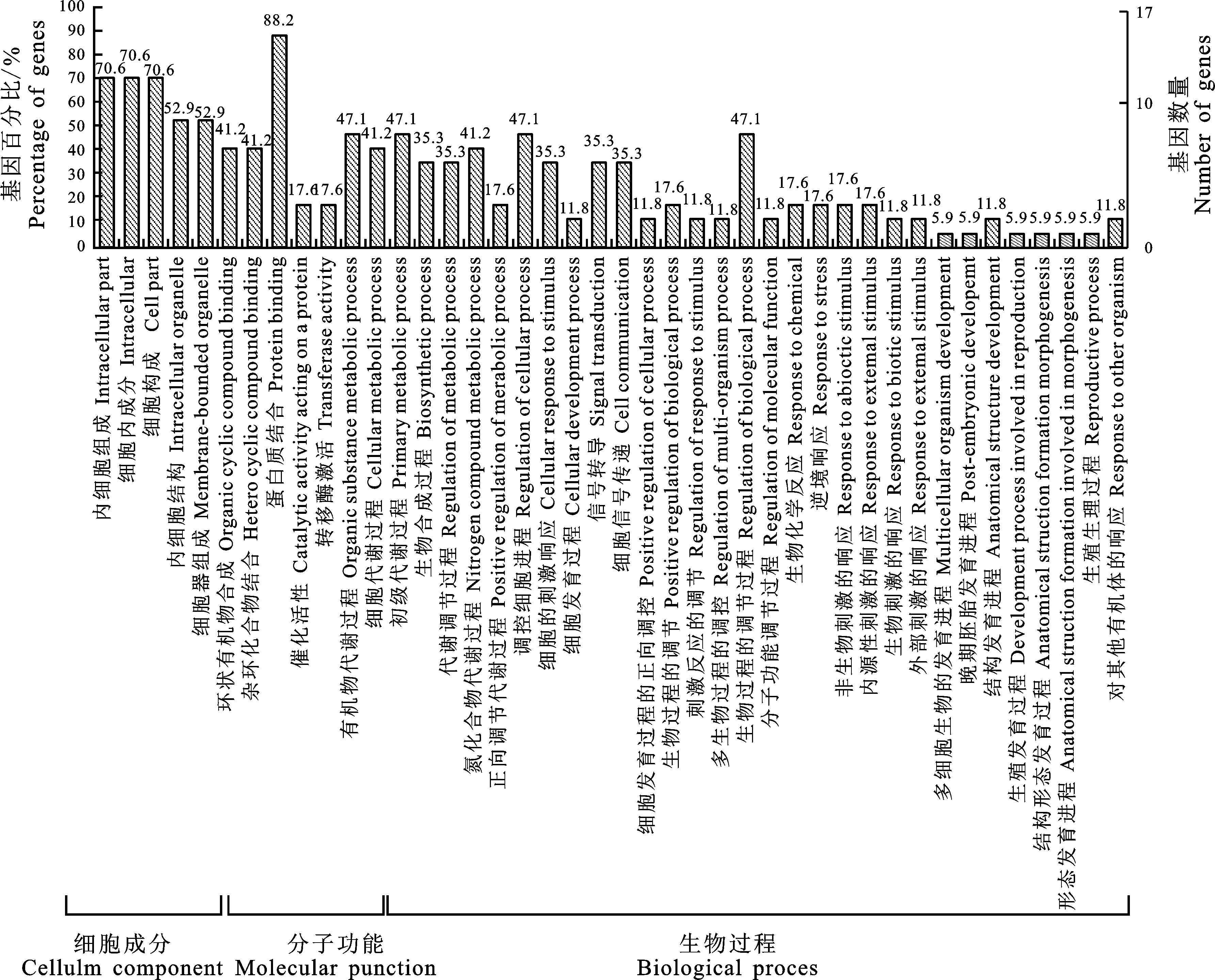
图3 OsMYB-MYC蛋白的基因本体(GO)注释分析Fig.3 Gene ontology annotation analysis of OsMYB-MYC proteins
顺式作用元件是位于基因上游,与功能基因一起发挥作用的一类端的核苷酸序列,它们能与转录因子结合进而发挥作用。本研究中,截取水稻MYB-MYC基因上游1.5 kb的序列,对OsMYB-MYC基因的顺式作用元件进行分析。结果发现,OsMYB-MYC基因上游存在4大类型的顺式作用元件。①调控植物生长发育相关元件,如调控分生组织表达CAT-box。②光调节相关元件,如Box4元件、G-Box元件、GT1-motif元件、I-box元件、TCCC-motif元件和AE-box元件等。③响应植物激素相关元件,如响应植物激素的TGACG-motif元件,响应ABA的ABRE元件,响应水杨酸代谢的TCA-element元件,响应赤霉素的P-box元件等。④响应逆境胁迫相关元件,如响应厌氧反应的ARE元件,响应干旱反应的MBS等。进一步研究发现,17个水稻MYB-MYC基因上游发现了ABRE元件,其中OsMYB-MYC04含有11个ABRE元件,表明该转录因子可能参与水稻ABA代谢途径。此外,光调节信号元件和激素响应元件在水稻MYB-MYC基因上游发现较多,共有102个光调节信号元件和127个响应植物激素元件,上述分析表明水稻MYB-MYC基因家族可能在调控植物生长发育、光调节、植物激素响应及逆境胁迫等生理过程中具有重要的作用。
2.4 染色体定位和基因复制分析
根据水稻基因组gff3注释文件,将鉴定得到了OsMYB-MYC基因进行染色体定位。结果发现(图4),17个基因均可以定位到水稻的不同染色体上,每条染色体上大约有1~3个水稻MYB-MYC基因。
在基因的进化以及分化过程中,基因复制在基因扩张和基因的功能分化中发挥着重要作用。其中,基因复制包括串联复制和并联复制。在本试验中,使用MSCcanX软件,对水稻全基因组进行共线性分析,以此来分析水稻全基因组产生的基因复制事件。结果发现共产生5对并联复制事件和3对串联复制事件。证明MYB-MYC基因在水稻进化过程中,基因复制使MYB-MYC基因家族进行扩张,但是扩张缓慢,在进化过程中十分保守。
在基因的进化过程中,不导致氨基酸改变的核苷酸变异被称为同义突变,反之则称为非同义突变。主要包括:同义突变频率(Ks)、非同义突变频率(Ka)、非同义突变频率与同义突变频率的比值(Ka/Ks)。Ka/Ks对基因的进化选择有重要的指导作用,当Ka/Ks>1,则认为受到正向选择作用,当Ka/Ks=1,则认为受到中性选择,当Ka/Ks<1,则认为受到纯化选择。为了进一步探讨这些复制基因对受到何种选择,对其进行同义突变频率(Ka)、非同义突变频率(Ks)值的计算。通过计算,发现水稻MYB-MYC基因的串联复制基因对Ka/Ks值<1 (0.559),水稻MYB-MYC基因的并联复制基因对的Ka/Ks值<1(0.258),说明OsMYB-MYC基因的复制基因对在水稻进化过程中都受到纯化选择。
为了探索共线性基因对的分歧时间,使用Umarmasood等[26]的方法,对其分歧时间进行计算。如表2所示,水稻MYB-MYC基因的串联复制基因对和并联复制基因对的平均分歧时间分别为27.19 Mya和94.89 Mya。上述结果表明并联复制比串联复制发生的更早,可能在进化以及基因分化过程中起到重要的作用。
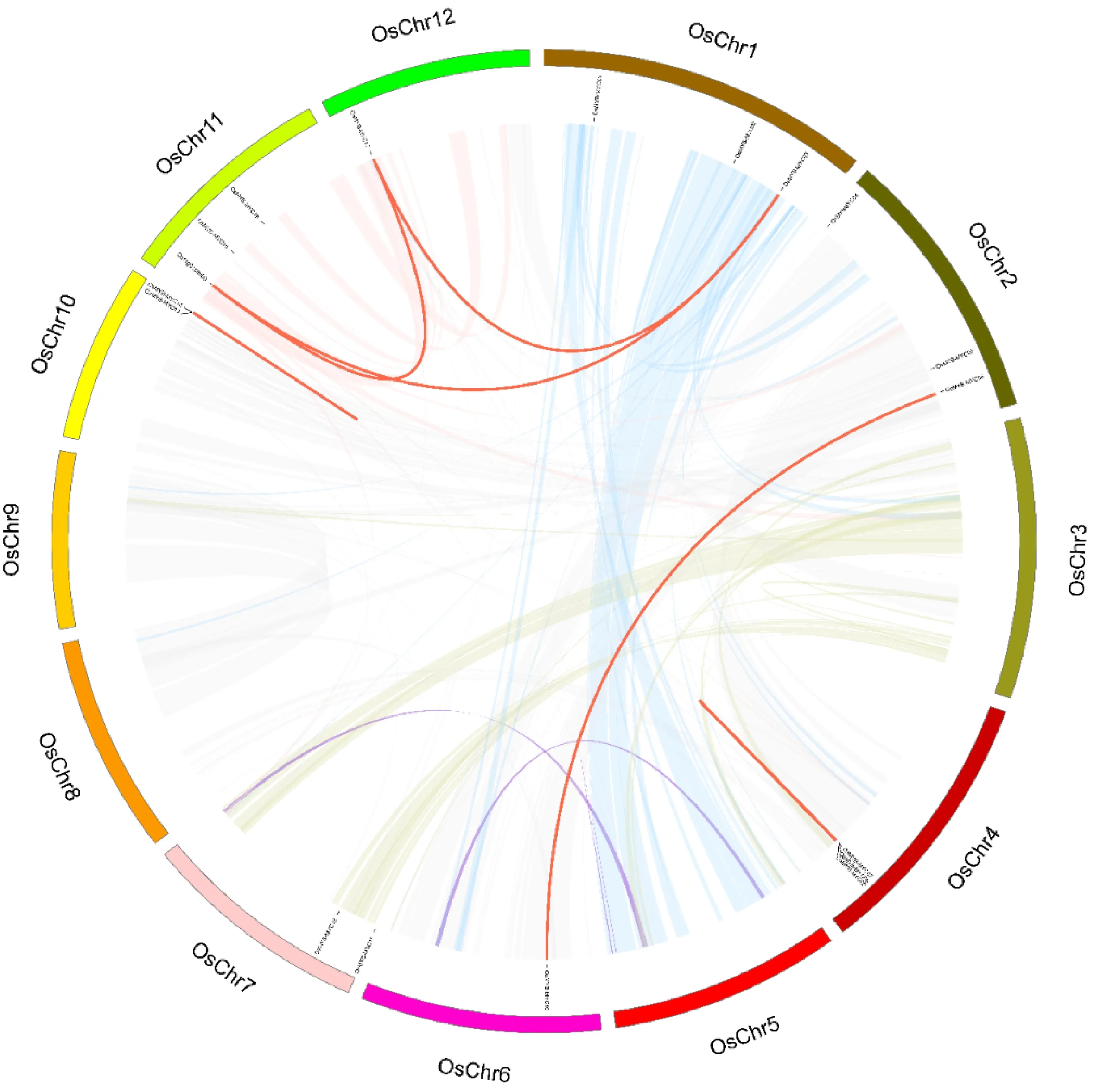
图4 水稻MYB-MYC转录因子的基因定位和水稻基因组内复制基因对Fig.4 Genomic locations of OsMYB-MYC TFs and duplicated gene pairs in rice
2.5 蛋白互作网络分析
众所周知,在植物体内,很少有单个的蛋白质能够直接参与植物的生长发育和逆境胁迫反应。大多数植物生理过程都是通过蛋白质的相互作用来完成。为了更好地理解OsMYB-MYC的分子机制,构建了OsMYB-MYC蛋白与其他水稻蛋白之间的相互作用网络。如图5所示,共有13个水稻MYB-MYC蛋白和29个水稻蛋白质形成了58对蛋白互作关系。其中,OsMYB-MYC03、OsMYB-MYC05和OsMYB-MYC01分别与14、14、9个水稻蛋白质产生相互作用,其参与的蛋白互作范围最大,占据总蛋白互作关系的63.7%,表明上述3个水稻MYB-MYC蛋白在蛋白互作中起到重要作用。
对水稻蛋白互作网络的基因进行功能注释后发现,这些互作蛋白属于不同的基因家族,有着不同的生理功能。比如Os01g0105700、Os03g0591300、Os04g0301500等基因属于bHLH基因家族,该基因家族能够调控植物生长发育以及参与逆境胁迫等[27];Os06g0622300,Os08g451400等属于AT-rich基因家族,该基因家族能够调控根系的生长[28];Os04g0653000可以抑制植物激素茉莉酸的信号转导并且调控水稻小穗的发育[29];Os09g0309700属于TIFY3类蛋白,可以抑制乙烯的生物合成,与水稻抗旱生理有关[30]。以上结果表明,水稻MYB-MYC蛋白通过与其他蛋白质相互作用,进而参与到水稻生长发育、响应植物激素及响应干旱胁迫等代谢途径。

表2 水稻MYB-MYC基因的基因复制信息及其Ka和Ks信息、基因分歧时间Table 2 The Ka/Ks ratios and divergence time for gene duplicated OsMYB-MYC genes

图5 水稻MYB-MYC蛋白互作网络Fig.5 Interaction network of MYB-MYC proteins in rice
2.6 表达模式分析
为探究水稻MYB-MYC基因在水稻生长发育过程中潜在的生物学功能,本研究利用NCBI-SRA数据库下载水稻的根、花药、心皮和种子4个组织的RNA-seq数据,对水稻MYB-MYC基因的表达模式进行研究。如图6-a所示,OsMYB-MYC基因表现出明显的组织表达特异性;13个OsMYB-MYC基因在心皮中表达量较高,其中OsMYB-MYC09、OsMYB-MYC10、OsMYB-MYC17在心皮中表达量最高。有9个OsMYB-MYC基因在种子中表达量较高,其中OsMYB-MYC05、OsMYB-MYC07、OsMYB-MYC11在种子中表达量最高。OsMYB-MYC02、OsMYB-MYC03、OsMYB-MYC08在花药中表达量最高。以上结果表明OsMYB-MYC基因可能在花发育过程以及种子形成或者萌发过程中发挥重要的功能。
同时为了研究OsMYB-MYC基因在逆境胁迫下的生物学功能,本试验利用GEO数据库分析了水稻栽培种‘Nagina 22’在干旱和盐胁迫下MYB-MYC基因的表达情况。如图6-b所示,在干旱胁迫处理中OsMYB-MYC基因表达有明显的变化,94.1%(16/17)的MYB-MYC基因表达量上调,其中OsMYB-MYC04和OsMYB-MYC11表达量有明显的上调。在盐胁迫处理中OsMYB-MYC基因表达也存在明显的变化, 82.4%(14/17)的MYB-MYC基因表达量上调,其中OsMYB-MYC08、OsMYB-MYC16、OsMYB-MYC17表达量有明显的上调。以上结果表明,OsMYB-MYC基因在响应干旱胁迫和盐胁迫下具有重要作用。

图6 OsMYB-MYC基因在不同组织中以及在干旱和盐胁迫中的表达Fig.6 Expression profiles of OsMYB-MYC genes in different tissues and under drought and salt stress
3 讨 论
水稻是中国主要的粮食作物之一,同时也是进行植物科学研究的模式植物之一,加强水稻的基础研究对保障国内粮食安全以及植物科学研究至关重要。
本试验利用最新的水稻基因组数据库,通过基因组学、转录组学等生物信息学手段,对水稻MYB-MYC基因家族进行鉴定,结果表明共有17个水稻MYB-MYC基因被鉴定。OsMYB-MYC基因定位大多都在细胞核中,部分基因也定位于叶绿体或者线粒体等部位,表明大部分的OsMYB-MYC基因都在细胞核中行使功能,部分OsMYB-MYC基因也可能在叶绿体或者线粒体中进行表达,行使生理生化功能。
通过系统进化、保守结构域和基因结构分析发现,水稻与其他植物的MYB-MYC蛋白进化关系很近,基序motif 4和motif 6存在于所有的水稻MYB-MYC蛋白中,且同一亚组内的基因具有相似的保守结构域和基因结构。结合系统进化树发现,MYB-MYC蛋白在单子叶和双子叶植物分化之前已经存在。顺式作用元件的分析表明OsMYB-MYC基因在光响应、激素响应、逆境响应过程中发挥作用。GO注释结果表明,OsMYB-MYC基因广泛参与了细胞组成、分子功能、生物进程3个生理过程。
MYB-MYC转录因子结构域含有MYB和MYC结构域,部分转录因子含有bHLH结构域,因此MYB-MYC基因功能非常丰富。前人研究表明MYB-MYC基因参与植物生长发育、响应植物激素以及非生物胁迫的响应。例如,拟南芥AtMYC2基因在植物激素JA[31-33]、ABA[4]代谢途径中起到重要作用;通过抑制分生组织的细胞分裂从而抑制拟南芥根系的伸长,同时促进侧根的形成[34];还参与拟南芥的昼夜节律、光和光敏色素信号转导[35];影响种子的发育[36];水稻OsMYC2基因参与调控水稻的衰老生理,同时参与水稻光信号介导[37]。MYB-MYC基因同时参与植物逆境胁迫。例如,拟南芥AtMYC2基因通过参与JA介导的相关途径来抵御非生物胁迫以及生物胁迫[38],同时在干旱胁迫下起到转录激活作用[4];过表达水稻OsMYC2能够增强JA相关基因的表达,从而抵御细菌的侵染[39]。本试验通过对水稻的表达模式分析表明,OsMYB-MYC基因在水稻的不同组织以及非生物胁迫下也有明显的表达差异,这些结果说明OsMYB-MYC广泛参与水稻的生长发育和逆境响应。
