假交替单胞菌对哈维氏弧菌拮抗作用初探
2019-12-03冯永勤谢珍玉
杨 行,章 翔,龙 昊,李 莹,冯永勤,谢珍玉
( 1.海南大学,南海海洋资源利用国家重点实验室,海南 海口 570228; 2.海南大学 海洋学院,海南省热带水生生物技术重点实验室,海南 海口 570228 )
随着海水养殖规模的扩大和养殖环境的持续恶化,养殖动物细菌性疾病呈暴发性流行,已成为制约全球海水养殖业可持续健康发展的重要因素,严重影响着海水养殖业的发展。其中弧菌病是海水动物养殖中危害最为严重的病害之一[1-3]。哈维氏弧菌(Vibrioharveyi)具有毒性大、耐药性强、可侵染多种宿主的特点,已成为华南地区海水养殖最严重的细菌性病原之一[4-5]。为防治疾病,多采用抗生素和化学药品控制弧菌病,结果不仅使养殖水体的正常菌群遭到破坏,还导致病原菌株的耐药性增强,严重污染近岸海域生态环境[6-7]。因此,建立哈维氏弧菌病原的生态防控技术是当前确保我国华南地区海水养殖产业健康发展的必由之路[8]。
利用微生物间的拮抗作用开展生物防治,是防控水产细菌性病原的重要有效途径[9-10]。目前应用于水产养殖上的拮抗菌制剂主要有两大类:(1)单一制剂,如荧光假单胞菌(Pseudomonnasfluorescens)、中间气单胞菌(Aerommasmedia)、芽孢杆菌(Bacillus)、乳酸乳球菌(Lactococcuslactis)、乳酸菌、乳酸杆菌(Lactobacillus)、溶藻胶弧菌(V.alginolyticus)、光合细菌、蛭弧菌(Bdellovibriobacteriovorus)等;(2)复合益生菌制剂,如美军方、复合型活性生物净水剂等,这类益生菌主要由硝化和反硝化假单胞菌、乳酸杆菌、酵母菌、双歧杆菌、反硝化细菌、枯草杆菌等菌株组成[11]。
近年来,自海南文昌地区中分离出的假交替单胞菌(Pseudoalteromonassp.)WCPW15003对哈维氏弧菌的拮抗作用最为明显[12],但该菌在2216E培养基中的最高培养密度仅108cfu/mL,且针对不同密度弧菌病原的具体使用密度也未确定,难以实现规模化培养和应用。笔者将以2216E培养基为基础,通过额外补充一定含量的碳源和氮源,优化假交替单胞菌WCPW15003的培养基组分;同时,确定不同密度弧菌病原所需要的最低拮抗菌密度,其结果将为今后开发防治热带海水养殖哈维氏弧菌病原的益生菌制剂及其施用技术奠定良好基础。
1 材料与方法
1.1 菌株
假交替单胞菌WCPW15003,分离自海南文昌水产养殖系统底泥样品(深80 cm);哈维氏弧菌PBVH3311分离自海南临高某对虾养殖基地[13]。以上2株菌种保存于本实验室。
1.2 方法
1.2.1 菌种活化
取保藏于-80 ℃冰箱中的哈维氏弧菌PBVH3311和假交替单胞菌WCPW15003,接种于2216E液体培养基中,30 ℃,180 r/min振荡培养24 h。
1.2.2 活菌计数标准曲线测定
取10 mL活化后的假交替单胞菌WCPW15003菌悬液或哈维氏弧菌PBVH3311菌悬液,4000 r/min离心5 min,移除上清液,重悬于PBS溶液;进行二倍倍比稀释,稀释5个密度梯度,分别测菌悬液吸光值。将各稀释梯度吸光值与其对应稀释倍数进行线性相关分析,要求r2>0.98。采用平板计数法[14]检测相应菌液中的活菌密度(cfu/mL)。根据菌悬液吸光值和活菌密度,绘制其活菌计数标准曲线[15]。
1.2.3 生长曲线测定
使用Bioscreen C全自动生长曲线分析仪测定假交替单胞菌WCPW15003和哈维氏弧菌PBVH3311的生长曲线。操作如下:加350 μL的2216E液体培养基至蜂窝板,分别接种活化的假交替单胞菌WCPW15003菌悬液和哈维氏弧菌PBVH3311菌悬液各50 μL,充分吸打混匀,于30 ℃下,180 r/min振荡培养72 h,每小时检测1次吸光值,检测波长为600 nm。设置3个平行组。
1.2.4 培养基优化
以2216E培养基为基础培养基,其组分为:胰蛋白胨(5 g/L)、酵母提取物(1 g/L)、磷酸铁(0.01 g/L),通过补加一定量的牛肉膏或(和)红糖,组成假交替单胞菌培养基A、B、C(试验组)(表1)。每组设置3个平行。

表1 假交替单胞菌培养基
注:“+”表示添加,“-”表示不添加.
接种1%(体积比)活化后的假交替单胞菌WCPW15003菌悬液(密度为3×108cfu/mL),振荡培养(30 ℃,180 r/min)至对数生长晚期。采用标准曲线计数法,确定各组菌悬液密度。采用SPSS 18.0软件对组间数据进行单因素方差分析和Duncan多重比较,统计值用平均值±标准差表示,以P<0.05表示差异显著,以P<0.01表示差异极显著。
1.2.5 拮抗试验
将活化的哈维氏弧菌PBVH3311菌悬液稀释后加入2216E半固体培养基(pH 7.6、盐度30)中,制作成病原菌平板。病原菌平板密度设置为101~108cfu/mL 共8个10倍倍比稀释密度。采用琼脂扩散法[16]测定101~109cfu/mL 共9个10倍倍比稀释的假交替单胞菌WCPW15003菌悬液的拮抗作用效果,打孔直径为5.98 mm。培养温度为30 ℃,正置培养24 h,用数显游标卡尺测量抑菌圈直径(精确到mm)。设置3个平行组。采用Matlab软件对数据进行回归分析,拟合多元二次回归方程。
2 结 果
2.1 活菌计数标准曲线绘制
2.1.1 假交替单胞菌WCPW15003活菌计数标准曲线
不同稀释倍数菌悬液的吸光值与其对应稀释倍数的线性方程为:y=1.8976x+0.137,r2=0.9877[x为假交替单胞菌WCPW15003稀释倍数倒数的值,y为假交替单胞菌WCPW15003稀释后吸光值(OD600)];标准曲线方程为:y=134.36x-17.976,r2=0.9924[x为假交替单胞菌WCPW15003吸光值(OD600),y为假交替单胞菌WCPW15003活菌菌落数],菌液吸光值与活菌数之间有显著线性关系(图1)。因此,假交替单胞菌WCPW15003的菌悬液吸光值与其活菌数量间存在良好线性关系,可用于后续菌液密度的测定。
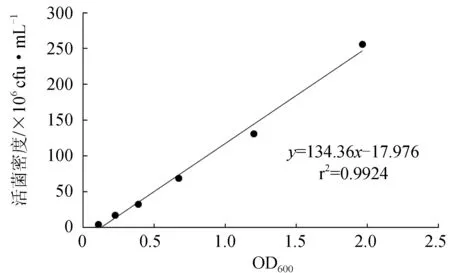
图1 假交替单胞菌WCPW15003活菌计数标准曲线
2.1.2 哈维氏弧菌 PBVH3311活菌计数的标准曲线
不同稀释倍数菌悬液的吸光值与其对应稀释倍数的线性方程为:y=1.42x+0.2052,r2=0.981[x为哈维氏弧菌PBVH3311 稀释倍数倒数的值,y为哈维氏弧菌PBVH3311稀释后吸光值(OD600)];标准曲线方程为:y=5.1028x-1.2664,r2=0.9956[x为哈维氏弧菌PBVH3311吸光值(OD600),y为哈维氏弧菌PBVH3311活菌菌落数],菌液吸光值与活菌数之间有显著线性关系(图2)。因此,哈维氏弧菌PBVH3311菌悬液吸光值与其活菌数量间线性关系良好,可用于后续菌液密度的测定。
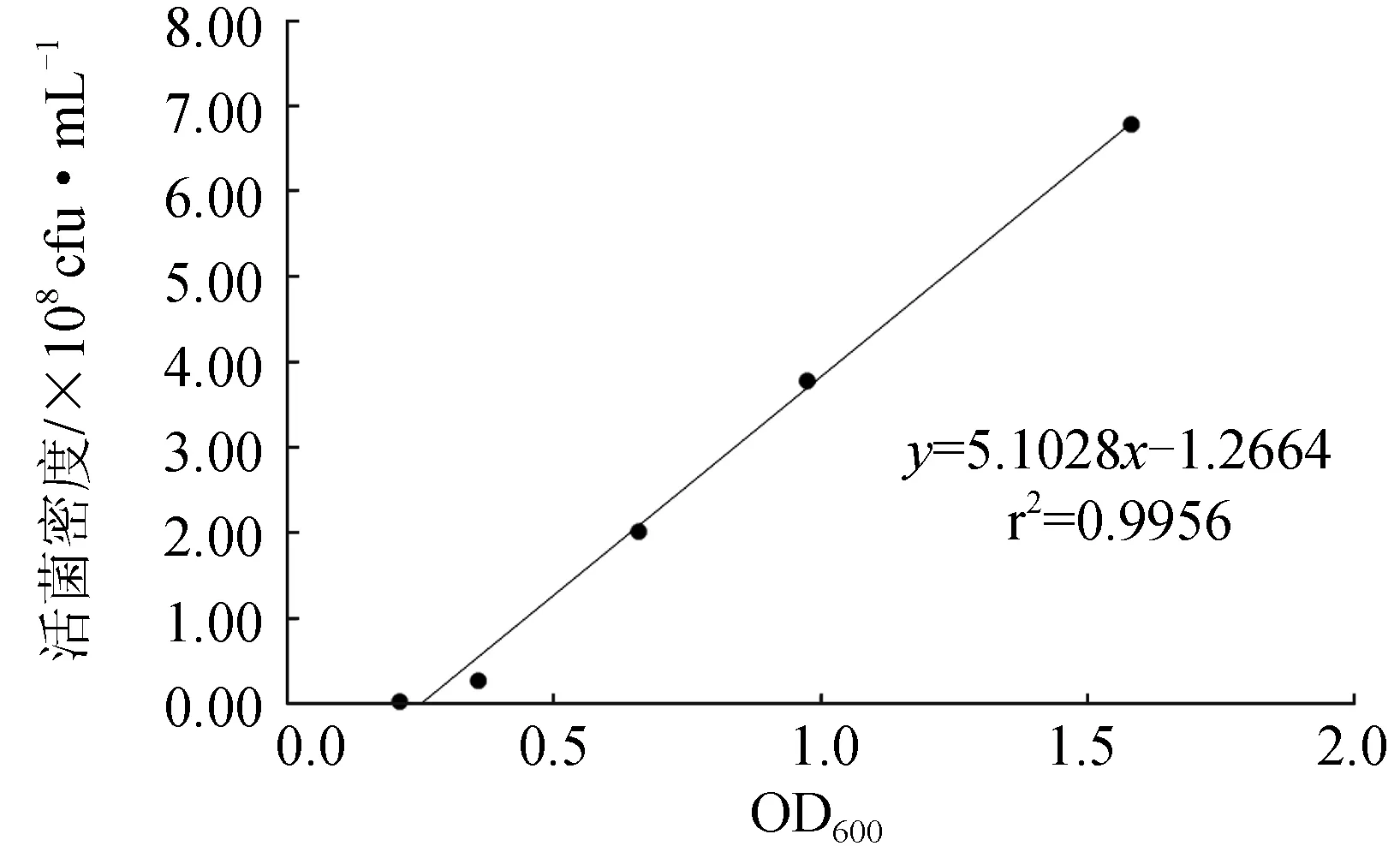
图2 哈维氏弧菌 PBVH3311活菌计数标准曲线
2.2 菌株生长曲线
2.2.1 假交替单胞菌 WCPW15003生长曲线
假交替单胞菌WCPW15003的生长曲线符合典型“S”型细菌生长曲线。即假交替单胞菌WCPW15003的生长周期可分为停滞期、增长期、平台期和衰亡期共4个时期。其中,接种后0~0.5 h为该菌株的停滞期,0.5~1.5 h为缓慢增长期,1.5~2.5 h进入短暂平台期,2.5~10 h进入对数增长期,10~36 h进入平台期,36 h后进入衰亡期(图3)。

图3 假交替单胞菌WCPW15003生长曲线
2.2.2 哈维氏弧菌PBVH3311菌株生长曲线
哈维氏弧菌PBVH3311的生长曲线符合典型“S”型细菌生长曲线。即哈维氏弧菌PBVH3311的生长生长周期可分为停滞期、增长期、平台期和衰亡期共4个时期。接种后0~0.5 h进入停滞期,0.5~1.5 h进入增长期,1.5~4.5 h进入短暂平台期,4.5~20 h进入对数增长期,20~44 h进入缓慢增长期,44~68 h进入平台期,68 h后进入衰亡期(图4)。
2.3 培养基优化
培养24 h后,不同假交替单胞菌WCPW15003培养基中菌悬液的密度为2.31×108~3.36×109cfu/mL(图5)。其中2216E培养基的活菌数最低,为2.31×108cfu/mL;试验组A的活菌数最高,为3.36×109cfu/mL;试验组B的活菌数为1.33×109cfu/
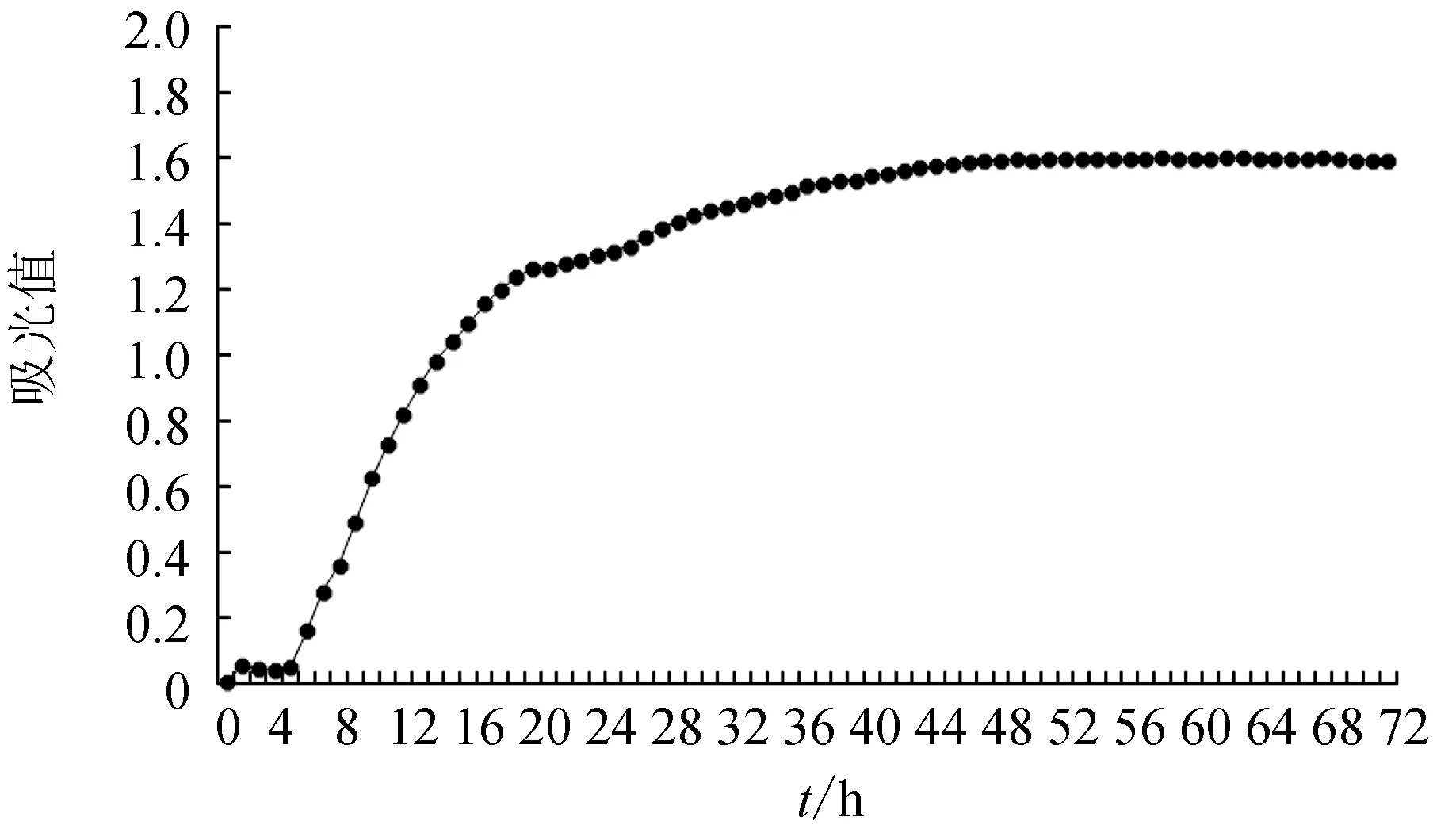
图4 哈维氏弧菌PBVH3311生长曲线
mL;试验组C的活菌数为1.95×109cfu/mL。与对照组相比,3个试验组的菌悬液密度均极显著高于对照组(P<0.01);尽管试验组B和试验组C间仅达到显著性差异(P<0.05),但试验组A与试验组B或试验组C间均达到了极显著差异(P<0.01)。
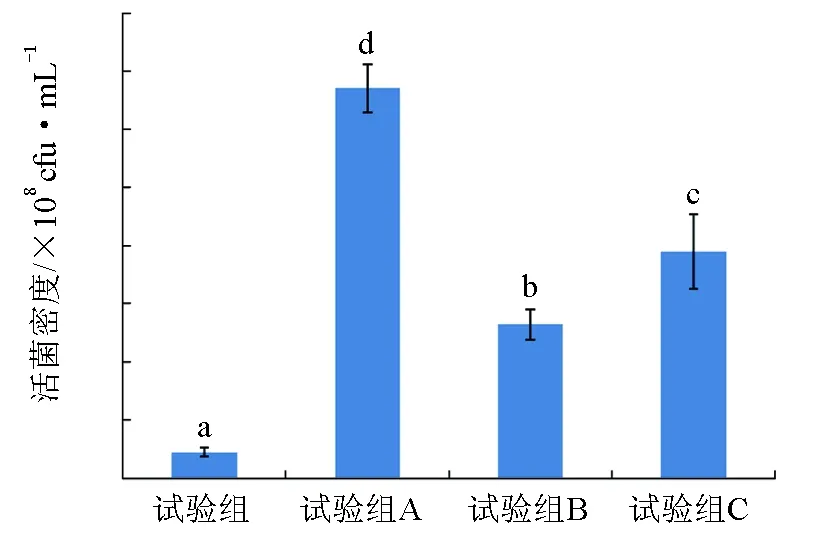
图5 培养基优化结果
2.4 拮抗试验
当哈维氏弧菌PBVH3311密度为101~102cfu/mL时,所有组别未出现明显的拮抗效果。当哈维氏弧菌PBVH3311密度为103cfu/mL时,假交替单胞菌WCPW15003的最小抑菌密度为103cfu/mL,抑菌圈直径为(8.40±0.16) mm;当哈维氏弧菌PBVH3311密度为104、105cfu/mL时,假交替单胞菌WCPW15003的最小抑菌密度均为105cfu/mL,抑菌圈直径分别为(9.64±0.07)、(8.24±0.22) mm。拮抗作用效果为全透明抑菌圈(图6)。
当哈维氏弧菌PBVH3311密度为106cfu/mL时,假交替单胞菌WCPW15003的最小抑菌密度为107cfu/mL,抑菌圈直径为(18.15±0.09) mm;当哈维氏弧菌PBVH3311密度为107、108cfu/mL时,假交替单胞菌WCPW15003的最小抑菌密度均为108cfu/mL,抑菌圈直径分别为(18.53±1.34)、(11.68±2.58) mm。拮抗作用效果为全透明抑菌圈,外侧还有一圈半透明抑菌圈(图6)。
总之,只有当哈维氏弧菌PBVH3311≥103cfu/mL时,假交替单胞菌WCPW15003才会产生拮抗作用,且假交替单胞菌WCPW15003的密度应相当于或高于哈维氏弧菌PBVH3311的密度,拮抗作用大小与假交替单胞菌WCPW15003密度呈正相关性。
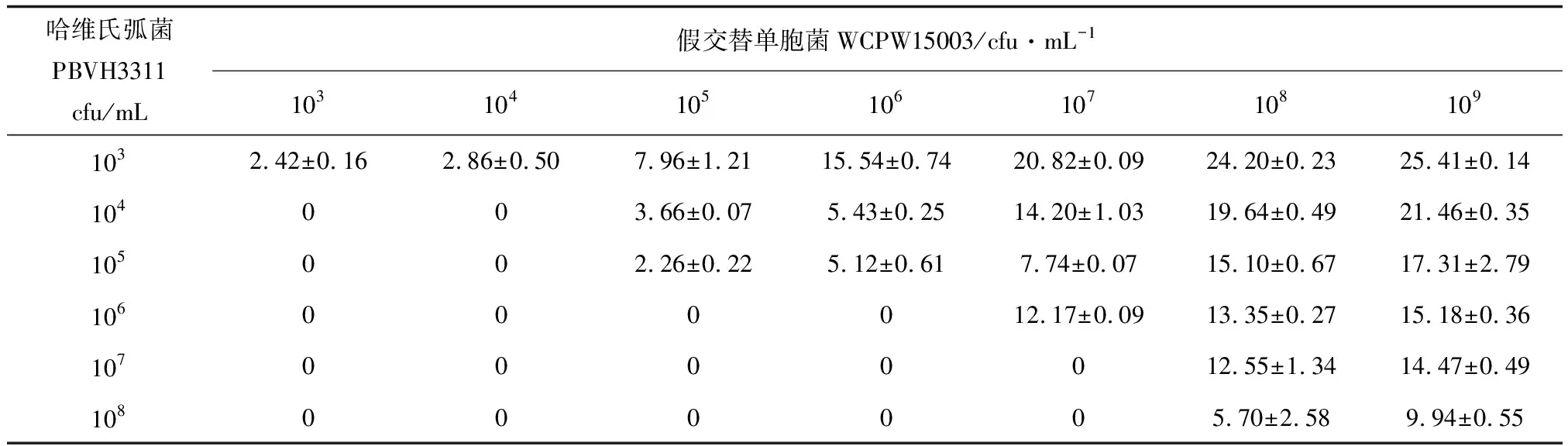
表3 不同密度假交替单胞菌与哈维氏弧菌拮抗抑菌圈直径(打孔器直径5.98 mm) mm
注:表中数据为剔除掉打孔器外径5.98 mm的结果,“0”表示不产生拮抗效果.
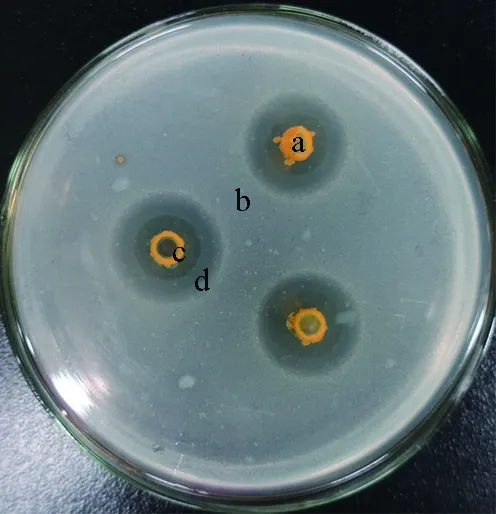
图6 假交替单胞菌WCPW15003与哈维氏弧菌PBVH3311拮抗作用效果a.假交替单胞菌;b.哈维氏弧菌;c.全透明抑菌圈;d.半透明抑菌圈.
2.5 数据分析
(1)当哈维氏弧菌PBVH3311密度为103、104、105cfu/mL时(低密度弧菌),拟合多元二次回归方程,拟合结果为: f(x,y)=9.09-0.3339x+0.02325y+0.00267x2-0.0002273xy+0.0002477y2[f(x,y)为抑菌圈直径(mm),x为哈维氏弧菌PBVH3311密度(×103cfu/mL),y为假交替单胞菌WCPW15003密度(×103cfu/mL)]。
当哈维氏弧菌PBVH3311密度为103、104、105cfu/mL时,若要实现100%拮抗效果,即r2=1(方程实际r2=0.9866),此时f(x,y)=5.98×(1+0.0134)=6.06。因此,当哈维氏弧菌PBVH3311为103~105cfu/mL时,实现100%拮抗作用的方程应为:6.06=9.09-0.3339x+0.02325y+0.00267x2-0.0002273xy+0.0002477y2。
(2)当哈维氏弧菌PBVH3311密度为106、107、108cfu/mL时(高密度弧菌),拟合多元二次回归方程,拟合结果为:f(x,y)=8.395-0.1682x+0.1161y+0.00106x2-0.00000675xy-0.0001026y2[f(x,y)为抑菌圈直径(mm),x为哈维氏弧菌PBVH3311密度(×106cfu/mL),y为假交替单胞菌WCPW15003密度(×106cfu/mL)]。
当哈维氏弧菌PBVH3311密度为106、107和108cfu/mL时,若要实现100%拮抗效果,即r2=1(方程实际r2= 0.9544),此时f(x,y)=5.98×(1+0.0456)=6.25。因此,当哈维氏弧菌PBVH3311为106~108cfu/mL时,实现100%拮抗作用的方程应为:6.25= 8.395-0.1682x+0.1161y+0.00106x2-0.00000675xy-0.0001026y2。
3 讨 论
3.1 拮抗菌WCPW15003及其培养基优化
哈维氏弧菌是南海近岸海洋环境中的优势菌种之一[17],也是华南地区海水养殖动物最常见的细菌性病原[4],常引发对虾发光病、对虾早期偷死综合征、石斑鱼烂身病等多种严重疾病[18-19]。
革兰氏阳性菌被广泛应用于水产养殖业中,其中应用较为普遍的主要是乳酸菌和一些芽孢杆菌等。Zokaeifar等[20]报道,将两株芽孢杆菌以108cfu/mL密度添加到饲料中,投喂8周龄凡纳滨对虾(Litopenaeusvannamei)时,能够促进其生长及提高消化酶活力,且对哈维氏弧菌有明显抑菌活性。虽然革兰氏阴性菌在水产养殖中的应用相对较少,但有些假交替单胞菌属菌种等也是公认的益生菌。Fjellheim等[21]报道,假交替单胞菌对大西洋鳕(Gadusmorhua)生长环境中的鳗弧菌(V.anguillarum)具有拮抗作用;Kesarcodi-Watson等[22]报道了假交替单胞菌可保护贝类幼苗免受灿烂弧菌(V.splendidus)的侵染;其他的研究结果也表明,假交替单胞菌对哈维氏弧菌、副溶血性弧菌(V.parahaemolyticus)等多种病原体有显著拮抗作用[23-27]。这与本研究结果基本一致,即假交替单胞菌WCPW15003对哈维氏弧菌PBVH3311具有明显的拮抗作用。
在大多数养殖系统中,只有当弧菌密度超过104cfu/mL时,才易暴发养殖动物弧菌病;同时,通过回归方程可得知,假交替单胞菌WCPW15003密度应大于或等于养殖水体中弧菌密度,才会表现出明显的拮抗效果。因此,提高菌液中菌体密度是实现假交替单胞菌WCPW15003应用的必要前提。尽管2216E是绝大多数海洋细菌的培养基[28],但由于营养成分含量相对单一,不适宜假交替单胞菌WCPW15003的高密度培养。笔者通过对2216E培养基的优化,可使假交替单胞菌WCPW15003密度由2.31×108cfu/mL升至3.36×109cfu/mL,可基本满足假交替单胞菌WCPW15003规模化培养和在小水体应用的要求,为今后建立该拮抗菌的连续发酵培养和生产应用奠定了重要基础。
3.2 拮抗菌WCPW15003对哈维氏弧菌病原拮抗机制
在基于培养皿的拮抗试验中,当病原菌哈维氏弧菌PBVH3311密度为103~105cfu/mL时,抑菌圈为清晰的全透明圈;当病原菌哈维氏弧菌PBVH3311密度大于106cfu/mL时,抑菌圈为两个同心圆,全透明圈在内,半透明圈在外。据此推测,当病原菌哈维氏弧菌PBVH3311密度较低时,拮抗菌假交替单胞菌WCPW15003通过识别弧菌并分泌胞外产物启动了第一套具有杀菌作用的拮抗机制,实现了低密度的拮抗菌假交替单胞菌WCPW15003的拮抗作用,拟合方程为:6.06=9.09-0.3339x+0.02325y+0.00267x2-0.0002273xy+0.0002477y2;当病原菌哈维氏弧菌PBVH3311密度较高时,拮抗菌假交替单胞菌WCPW15003除启动上述第一套拮抗机制外,还同时启动了具有抑菌作用的第二套拮抗机制,且该机制分泌的胞外产物在琼脂中的扩散速度大于第一套拮抗机制分泌的胞外产物,因此,产生半透明抑菌圈大于全透明圈的现象,此时的拟合方程为:6.25=8.395-0.1682x+0.1161y+0.00106x2-0.00000675xy-0.0001026y2。这一结果为后续开展该拮抗菌作用机制的研究奠定了重要基础。同时表明,该拮抗菌既可杀灭贫营养海水中的少量弧菌,又可抑制富营养海水中出现高密度的弧菌,还可保持富营养水体中剩余少量弧菌(承担养殖水体的物质循环作用),从而有利于成功构建基于细菌的“活水”的养殖系统。也就是说,该拮抗菌今后不仅可用于养殖前期的海水消毒,还可用于养殖水体中弧菌密度控制,防止因高密度弧菌引发海水养殖弧菌病的暴发,且不会导致水体因完全缺少细菌而成为“死水”。
总之,本研究不仅确定了假交替单胞菌WCP15003的生长特性及其对哈维氏弧菌PBVH3311存在显著的拮抗效果,还根据不同弧菌密度率先确定了该拮抗菌对弧菌的多元二次回归方程,可根据养殖水体中弧菌密度,确定拮抗菌的准确使用量,这为假交替单胞菌WCPW15003在生产中精准施用技术开发夯实了理论基础。
