慢性氨氮胁迫对“新吉富”罗非鱼幼鱼生长及血清生化指标的影响
2019-12-03唐首杰刘辛宇吴太淳赵金良
唐首杰,刘辛宇,吴太淳,赵金良
( 上海海洋大学,农业农村部淡水水产种质资源重点实验室,水产科学国家级实验教学示范中心,水产动物遗传育种中心上海市协同创新中心,上海 201306 )
“新吉富”罗非鱼(Oreochromisniloticus)是上海海洋大学以1994年引入的尼罗罗非鱼“GIFT”品系第3代为基础群体(F0),历经10年系统选育而成的罗非鱼新品种(登记号GS01-001-2005)[12],至2016年已选育至第20代(F20)。目前,该品种已成为我国罗非鱼养殖业的主养品种之一。但随着罗非鱼集约化养殖密度的提高,养殖水体中残饵、粪便等不断累积,致使部分地区罗非鱼长期处于较高含量氨氮的养殖环境中,从而导致其生长性能下降,影响了罗非鱼养殖效益[13]。鉴于此,在选育系F20的基础上,研究氨氮对“新吉富”罗非鱼的慢性毒性效应,探索氨氮的慢性胁迫机制已成当务之急。目前,国内外学者在尼罗罗非鱼慢性氨氮胁迫方面的研究主要集中在氨氮对尼罗罗非鱼幼鱼生长[8,14-16]、血清及肝脏生理功能影响[14-17]等领域,但慢性氨氮胁迫对“新吉富”罗非鱼生长及生理功能的影响尚未见报道。本研究根据氨氮对“新吉富”罗非鱼幼鱼的半致死质量浓度和安全质量浓度(待发表资料),采用实验生态学方法研究不同质量浓度氨氮胁迫对“新吉富”罗非鱼幼鱼生长性能及血清生化指标的影响,以期为“新吉富”罗非鱼的健康养殖提供科学依据。
1 材料和方法
1.1 试验材料
试验鱼为“新吉富”罗非鱼选育系F20幼鱼,初始体质量为(38.6±0.2) g,取自上海海洋大学鱼类种质研究试验站。试验鱼用3%氯化钠和2%碳酸氢钠消毒,然后放入水族箱暂养14 d以适应环境。投喂宁波天邦公司生产的罗非鱼浮性颗粒饲料,含粗蛋白32%。日饱食投喂2次(9:00,16:00)。氯化铵(纯度大于99.5%)购自上海生工生物工程技术服务有限公司。
1.2 试验方法
根据氨氮对“新吉富”罗非鱼幼鱼的急性毒性试验的结果(待发表)设定试验的氨氮质量浓度梯度。以96 h半致死质量浓度(144.287 mg/L)的10%为慢性胁迫试验的中间质量浓度,将慢性胁迫试验设4个氨氮质量浓度组,其总氨氮质量浓度分别为7.22、14.43、28.86、57.72 mg/L,同时以未添加氯化铵的正常饲养用水作为对照组。每组试验鱼15尾,设3个平行组。
试验于0.60 m×0.45 m×0.40 m的玻璃水族箱(试验实际水体为64.8 L)中进行。以氯化铵准确配置母液,再按试验设计分别稀释成各组试验液。试验用水为充分曝气处理的自来水,连续24 h充气,溶解氧6.5~7.2 mg/L,水温(28.0±1.0) ℃,pH 7.7±0.2,定时用纳氏试剂法[18]测定各组总氨氮质量浓度,并用母液及时调整至试验设定的表观质量浓度。在试验过程中,每日饱食投喂2次(9:00,16:00),早晚定时用虹吸管清除粪便,每晚(18:00)定时更换预先配置成相应质量浓度、等温的氯化铵溶液,用饱和碳酸钠溶液使水的pH维持相对稳定。
分别于氨氮暴露的第10、20 d和30 d时自各箱中分别取5尾试验鱼进行生长性状、血清生化指标分析。测定各项指标前,将试验鱼迅速捞起并投入200 mg/L的间氨基苯甲酸乙酯甲磺酸盐(Sigma,美国)溶液中进行深度麻醉。
1.2.1 生长性状测定
分别测定试验鱼的体质量、体长、体高等数据,按下式计算特定生长率[19]:
特定生长率/%·d-1=[(lnm2-lnm1)/(t2-t1)]×100%
式中,m1、m2分别为时间t1、t2时的体质量。
1.2.2 血清生化指标测定
尾静脉采血后,不加抗凝剂在室温放置30~40 min,然后3000 r/min,离心10 min,收集上清液。采用南京建成生物工程研究所研发的试剂盒测定血清中谷丙转氨酶、酸性磷酸酶和碱性磷酸酶的活性,组织蛋白含量采用考马斯亮蓝法测定。
1.3 数据统计
采用SPSS 19.0软件对试验数据进行处理分析,结果以平均值±标准差表示,各组间差异用单因素方差分析进行检验,并进行Duncan′s多重比较分析,P<0.05为差异显著。
本试验中所提及的氨氮是指水环境中的总氨氮质量浓度,由离子铵和非离子氨组成。通常在计算氨氮的半致死质量浓度时还要考虑非离子氨的半致死质量浓度。水体中非离子氨在总氨氮中所占的比例与温度和pH有关,换算公式如下[20]:
非离子氨质量浓度=A/[10(pKa-pH)+1]
pKa=0.09018+2729.92/T
式中,A为总氨氮质量浓度,pKa为离解常数,T为热力学温度(T=273+T℃)。
2 结 果
2.1 生长性能分析
30 d的慢性氨氮胁迫期间,各组别试验鱼均未出现死亡情况。在整个试验过程中,随着氨氮质量浓度的升高,各组别试验鱼摄食量呈下降趋势,其中,低质量浓度组(7.22 mg/L)与对照组间摄食量差异不明显,高质量浓度组(28.86、57.72 mg/L)摄食量显著减少,试验后期出现停止摄食的情况。各组别试验鱼在整个试验期间的生长性能见表1。5组试验鱼的初始体质量为38.28~38.68 g,30 d时的试验末体质量为32.13~62.07 g,特定生长率为-0.60%/d~1.58%/d。28.86、57.72 mg/L组试验末体质量均低于其初始体质量,因此,这2个试验组的特定生长率均为负值,表明高质量浓度氨氮对试验鱼的生长产生了明显的抑制。组间试验末体质量、特定生长率呈现随氨氮质量浓度升高而递减的趋势,即对照组>7.22 mg/L组>14.43 mg/L组>28.86 mg/L组>57.72 mg/L组,Duncan′s多重比较结果均显示,对照组和7.22 mg/L组间差异不显著,并且这2组的生长性能显著高于其他3个试验组(P<0.05);14.43、28.86 mg/L和57.72 mg/L组两两间均存在显著差异。
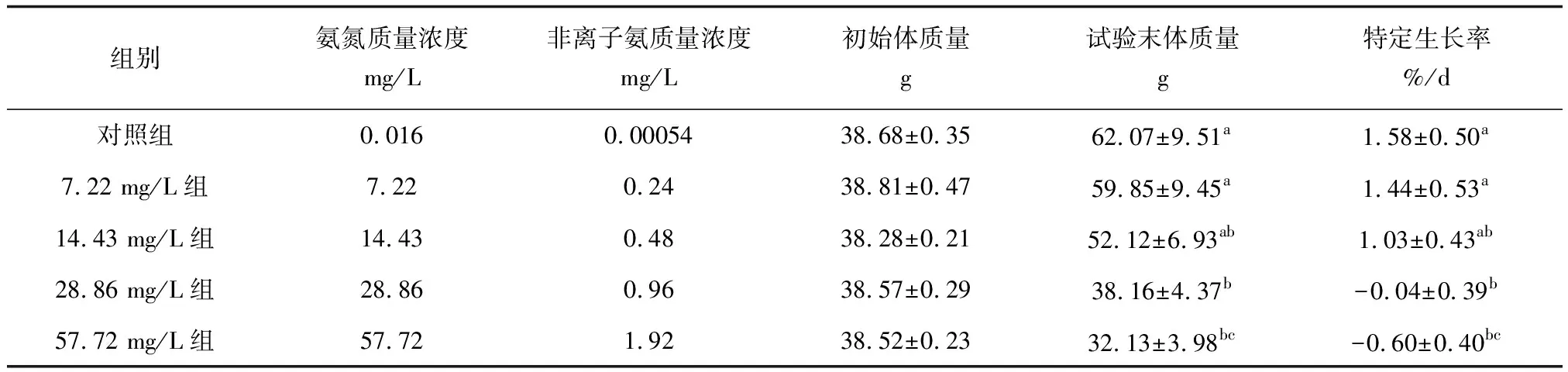
表1 慢性氨氮胁迫下“新吉富”罗非鱼幼鱼的生长性能
注:同列数据上标字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05).
5组试验鱼在不同时段内的特定生长率变化趋势见图1。在0~10 d、10~20 d和20~30 d时段,28.86、57.72 mg/L组的特定生长率均为负值,且57.72 mg/L组的特定生长率最低;在0~10 d和10~20 d时段,对照组特定生长率最高;在20~30 d时段,7.22 mg/L组特定生长率最高。Duncan′s多重比较结果显示,在所有3个时段内,28.86、57.72 mg/L组的特定生长率均显著低于其余3个组(P<0.05);在0~10 d时段,对照组、7.22 mg/L组的特定生长率显著高于14.43 mg/L组(P<0.05);在10~20 d时段,对照组的特定生长率显著高于7.22、14.43 mg/L组(P<0.05);在20~30 d时段,7.22 mg/L组的特定生长率显著高于对照组和14.43 mg/L组(P<0.05)。

图1 不同质量浓度氨氮胁迫下“新吉富”罗非鱼幼鱼特定生长率的动态变化同一时间段内,上标字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05).
2.2 血清生化指标分析
5组试验鱼血清中酸性磷酸酶活性的动态变化见图2。在10 d时,7.22 mg/L组的血清酸性磷酸酶活性最高,57.72 mg/L组的血清酸性磷酸酶活性最低,7.22 mg/L组和对照组间血清酸性磷酸酶活性差异不显著,14.43、28.86、57.72 mg/L组间血清酸性磷酸酶活性差异也不显著,7.22 mg/L组、对照组的血清酸性磷酸酶活性均显著高于其他3个组(P<0.05);在20 d时,14.43 mg/L组的血清酸性磷酸酶活性显著高于其他4个组(P<0.05),7.22 mg/L组、对照组的血清酸性磷酸酶活性均显著高于28.86、57.72 mg/L组(P<0.05),7.22 mg/L组和对照组间血清酸性磷酸酶活性差异不显著,28.86、57.72 mg/L组间血清酸性磷酸酶活性差异也不显著,57.72 mg/L组的血清酸性磷酸酶活性最低;在30 d时,7.22 mg/L组的血清酸性磷酸酶活性显著高于其他4组(P<0.05),57.72 mg/L组的血清酸性磷酸酶活性最低,14.43 mg/L组和对照组间血清酸性磷酸酶活性差异不显著,28.86、57.72 mg/L组间血清酸性磷酸酶活性差异也不显著,14.43 mg/L组、对照组血清酸性磷酸酶活性均显著高于28.86、57.72 mg/L组(P<0.05)。综上,7.22、14.43 mg/L组的血清酸性磷酸酶活性分别在30 d和20 d时显著高于对照组(P<0.05)。在高质量浓度氨氮作用下,28.86、57.72 mg/L组的血清酸性磷酸酶活性在整个试验过程中均显著低于对照组(P<0.05),表明这两个组的血清酸性磷酸酶活性受到了明显的抑制,氨氮对“新吉富”罗非鱼幼鱼血清产生了明显的毒性作用。
5组试验鱼血清中碱性磷酸酶活性的动态变化见图3。在10 d时,对照组的血清碱性磷酸酶活性显著高于其他4个组(P<0.05),7.22、14.43、28.86 mg/L间血清碱性磷酸酶活性差异不显著,且这3组的血清碱性磷酸酶活性均显著高于57.72 mg/L组(P<0.05);在20 d时,14.43 mg/L组的血清碱性磷酸酶活性显著高于其他4个组(P<0.05),对照组和7.22 mg/L组间血清碱性磷酸酶活性差异不显著,并且这2组血清碱性磷酸酶活性均显著高于28.86、57.72 mg/L组(P<0.05),57.72 mg/L组的血清碱性磷酸酶活性最低;在30 d时,7.22 mg/L组的血清碱性磷酸酶活性最高,对照组和7.22 mg/L组间血清碱性磷酸酶活性差异不显著,并且这2组血清碱性磷酸酶活性均显著高于其他3组(P<0.05),14.43、28.86 mg/L的血清碱性磷酸酶活性均显著高于57.72 mg/L组(P<0.05)。综上,7.22、14.43 mg/L组的血清碱性磷酸酶活性分别在30 d和20 d时高于对照组。在高质量浓度氨氮作用下,28.86、57.72 mg/L组的血清碱性磷酸酶活性在整个试验过程中均显著低于对照组(P<0.05),表明这2组的血清碱性磷酸酶活性受到了明显的抑制,氨氮对“新吉富”罗非鱼幼鱼血清产生了明显的毒性作用。
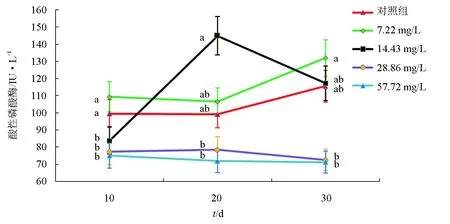
图2 不同质量浓度氨氮胁迫下“新吉富”罗非鱼幼鱼血清酸性磷酸酶活性动态变化同一时间内,同列字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05).下同.

图3 不同质量浓度氨氮胁迫下“新吉富”罗非鱼幼鱼血清碱性磷酸酶活性动态变化
5组试验鱼血清中谷丙转氨酶活性的动态变化见图4。在10 d时,57.72 mg/L组的血清谷丙转氨酶活性最高,对照组的血清谷丙转氨酶活性最低,各组间血清谷丙转氨酶活性差异不显著;血清谷丙转氨酶活性在20 d时和30 d时具有相同的变化趋势,即57.72 mg/L组的血清谷丙转氨酶活性显著高于其他4组(P<0.05),血清谷丙转氨酶活性呈现出随氨氮质量浓度升高而显著升高的趋势,57.72 mg/L组>28.86 mg/L>14.43 mg/L组>7.22 mg/L组>对照组,57.72、28.86、14.43 mg/L组的血清谷丙转氨酶活性均显著高于对照组(P<0.05),7.22 mg/L组和对照组间血清谷丙转氨酶活性差异不显著。综上,血清中谷丙转氨酶活性随氨氮质量浓度升高和胁迫时间的延长而显著升高。
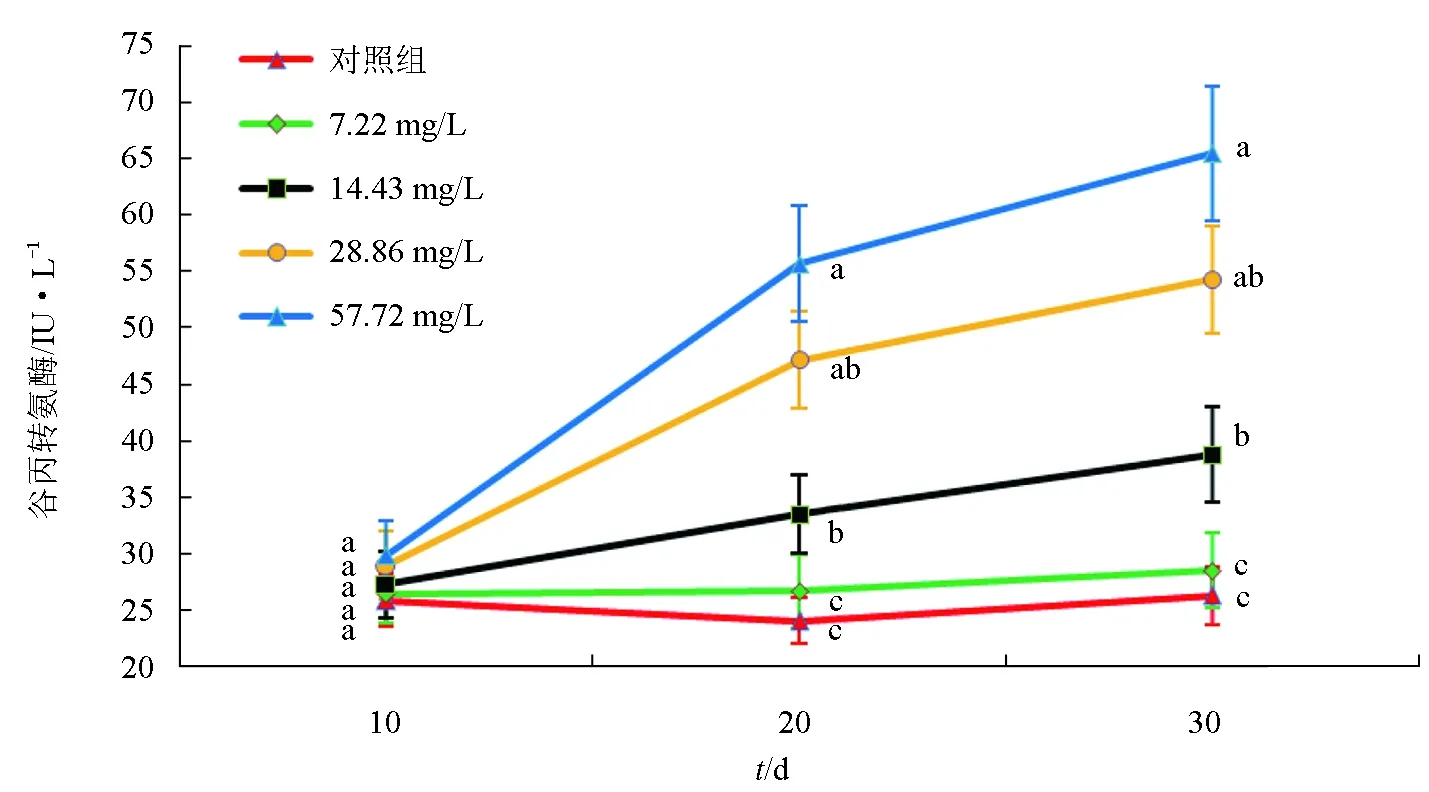
图4 不同质量浓度氨氮胁迫下“新吉富”罗非鱼幼鱼血清谷丙转氨酶活性动态变化
3 讨 论
3.1 慢性氨氮胁迫对“新吉富”罗非鱼幼鱼生长性能的影响
大量研究表明,长期的氨氮胁迫可使鱼类生长速度降低,随着水体中非离子氨含量的升高和胁迫时间的延长,鱼类摄食量下降,大部分能量用于机体的消耗,从而导致鱼类生长率下降甚至生长停滞[8,21-24]。因此,在集约化养殖生产中,将水体中非离子氨含量控制在不影响鱼类生长的安全范围内显得尤为重要。所谓安全限制含量,是指对水产动物生长、繁殖和生存没有明显影响的非离子氨含量[8]。许多学者通过实验生态学方法研究了非离子氨对养殖鱼类的安全限制含量。Alderson[25]曾报道,非离子氨对欧洲鳎(Soleasolea)和大菱鲆(Scophthalmusmaximus)幼鱼的安全限制质量浓度分别为0.066 mg/L和0.11 mg/L。而Szumski等[26]认为,非离子氨对暖水性鱼类的安全限制质量浓度为0.08 mg/L。Person-Le Ruyet等[27]报道,非离子氨对大菱鲆幼鱼的安全限制质量浓度为0.18~0.33 mg/L。Foss等[21]的研究表明,当非离子氨质量浓度大于0.06 mg/L时,大西洋鳕(Gadusmorhua)幼鱼的日摄食量减少,特定生长率显著低于对照组,大西洋鳕幼鱼养殖水体中非离子氨的安全限制质量浓度为0.06 mg/L。Lemarie等[22]研究发现,舌齿鲈(Dicentrarchuslabrax)幼鱼质量增加率与非离子氨质量浓度成负相关,养殖水体中非离子氨的安全限制质量浓度为0.26 mg/L。El-Shafai等[8]研究发现,当水体中非离子氨质量浓度高于0.068 mg/L时,尼罗罗非鱼幼鱼特定生长率显著低于对照组,由此提出尼罗罗非鱼幼鱼养殖水体中非离子氨的安全限制质量浓度为0.068 mg/L。本研究中,当非离子氨质量浓度为0.24 mg/L时,试验鱼的特定生长率与对照组间差异不显著;当非离子氨质量浓度为0.48 mg/L时,试验鱼的生长率显著低于对照组,与已有研究结果相比,本研究中的“新吉富”罗非鱼幼鱼能耐受的非离子氨质量浓度相对较高,究其原因,可能是因为鱼类对非离子氨的耐受性存在种间差异,也可能与试验鱼规格、养殖密度及试验条件(如pH、温度、溶解氧及盐度等)等不同有关。
此外,在本研究中,当水体中非离子氨质量浓度为0.24 mg/L时,试验鱼在初始阶段(0~10 d)、中间阶段(10~20 d)和最后阶段(20~30 d)的特定生长率分别为1.10%/d、1.23%/d和2.00%/d,呈逐渐升高的趋势。这一结果与Foss等[21]对大西洋鳕慢性氨氮耐受性的研究结果类似,Foss等[21]研究表明,在整个96 d试验的初始阶段(0~28 d),非离子氨质量浓度为0.11 mg/L和0.17 mg/L试验组的特定生长率分别比对照组降低11%和23%,而在试验最后阶段(57~96 d),这两个试验组的特定生长率分别比对照组降低7%和9%,且与对照组间无显著差异,试验组的特定生长率呈缓慢升高的趋势。在对花狼鳚(Anarhichasminor)[28]和舌齿鲈[22]的慢性氨氮胁迫研究中,也观察到了类似的现象。产生这种现象的原因,可能是鱼类对环境胁迫具有适应和自我调节能力,在慢性氨氮胁迫过程中,鱼类机体能逐渐适应非离子氨的毒性,并通过多种方式阻止非离子氨在体内的积累,如减少体内氨的合成、加速氨的排泄、或将氨转化为无毒的物质[29]。Randall等[30]研究发现,鱼类通过减少体内蛋白质水解和氨基酸的代谢可以阻止氨氮在体内的累积。许多鱼类通过增加体内谷氨酰胺合成酶的活性使氨氮快速转化为谷氨酰胺,或者通过鸟氨酸尿素循环将氨氮转化为尿素[29,31]。
3.2 慢性氨氮胁迫对“新吉富”罗非鱼幼鱼血清生化指标的影响
血液生化参数是反映鱼体健康状况和生理状态的主要指标,也是鱼类疾病诊断的依据之一,在慢性氨氮胁迫下,水体中的非离子氨通过鱼鳃的吸收,进入血液,会对血细胞及血清中的酶类产生影响。酸性磷酸酶是一种对鱼类的生理代谢有着重要影响的酶[32],在鱼类各组织器官中广泛分布;碱性磷酸酶主要参与生物体对物质的消化、吸收、转运,调节动物体内钙、磷的吸收,维持钙、磷的平衡,是鱼类生长发育的重要酶类之一[33]。酸性磷酸酶和碱性磷酸酶均参与了生物在环境毒物胁迫下产生的适应性反应,常用于评估环境毒物的毒性程度[34]。本研究中,血清中酸性磷酸酶和碱性磷酸酶的活性在慢性氨氮胁迫下的动态变化趋势基本一致,即7.22、14.43 mg/L组的血清酸性磷酸酶和碱性磷酸酶活性分别在30 d和20 d时高于对照组,28.86、57.72 mg/L组的血清酸性磷酸酶和碱性磷酸酶活性在整个试验过程中均显著低于对照组(P<0.05)。究其原因,可能是血清中的酸性磷酸酶、碱性磷酸酶主要来源于血细胞[35],在低质量浓度氨氮(7.22 mg/L)长时间(30 d)胁迫下,或在较高质量浓度氨氮(14.43 mg/L)较长时间(20 d)胁迫下,鱼体血细胞受损,其中的酸性磷酸酶、碱性磷酸酶进入血浆;同时,鱼体在氨氮胁迫下,可能产生了毒物兴奋作用[36],导致酸性磷酸酶、碱性磷酸酶诱导合成,从而引起血清中酸性磷酸酶、碱性磷酸酶活性显著上升。而在高质量浓度氨氮(28.86、57.72 mg/L)胁迫下,血清的电解质平衡遭到破坏,酸性磷酸酶、碱性磷酸酶诱导作用受到抑制,导致酸性磷酸酶、碱性磷酸酶活性显著下降,这与Jee等[37]的研究结果类似。本研究表明,“新吉富”罗非鱼幼鱼血清中酸性磷酸酶、碱性磷酸酶对氨氮具有一定耐受性,但超出生理耐受阈值后,其活性会受到显著影响。
谷丙转氨酶是广泛存在于动物组织细胞内参与氨基酸合成与分解代谢的重要氨基转移酶,催化谷氨酸与丙氨酸之间的氨基转换,正常血清中谷丙转氨酶的活性不高,但当组织细胞,特别是肝脏和心脏等器官的细胞发生病变时,能引起血清中谷丙转氨酶活性明显升高。因此,血清谷丙转氨酶是肝细胞受损最灵敏的指标之一[38],其活性的增减可以反映机体中毒或病理变化。本研究中,血清中谷丙转氨酶活性随氨氮质量浓度升高和胁迫时间的延长而显著升高。这与鲤鱼(Cyprinuscarpio)[39]、青鱼(Mylopharyngodonpiceus)[40]受氨氮胁迫后的谷丙转氨酶活性变化趋势相似。这可能是由于高质量浓度氨氮胁迫导致机体脂质过氧化产物增多,肝细胞肿胀、坏死,管壁细胞与基膜分离、管壁破裂等,影响肝胰腺正常生理功能所致[40-41]。
