促血管生成miR与乳腺癌新辅助化疗心脏毒性的关联
2019-11-28秦宪涛支庆江王振峰姜文营常方圆
秦宪涛, 支庆江, 王振峰, 姜文营, 常方圆
乳腺癌是女性最常见的恶性肿瘤,据最新世界肿瘤统计年鉴报告显示,2012年全球范围内约有170万新发乳腺癌病例以及52万乳腺癌死亡病例[1]。手术切除是乳腺癌优选的根治方案,然而不少患者在诊断时已处于中高肿瘤分期,导致手术机会降低。为了使乳腺癌降期以利于手术,或变不能手术为能手术,于手术前进行全身化疗以缩小肿块并为手术做准备(即新辅助化疗)越发受到临床重视[2-3]。然而,新辅助化疗同时提高了患者心脏毒性的发病风险,例如蒽环类药物作为最常用的乳腺癌新辅助化疗基础药物,可导致心肌纤维退化、心肌细胞凋亡和坏死,进而引发心脏毒性。因此,积极寻找新辅助化疗心脏毒性的预测标志物是十分必要的[4]。微小核糖核酸(microRNA, miR)是一组由23个左右核苷酸组成的内源性非编码RNA,可作为多种药物毒性的预测标志物,其中促血管生成相关miR可能通过刺激血管生长、组织灌注和恢复,进而参与新辅助化疗心脏毒性的调控,从而作为其心脏毒性发生风险的潜在标志物。然而,目前尚少见相关报道[5-7]。本研究旨在评估14个循环促血管生成miR的表达水平在新辅助化疗乳腺癌患者心脏毒性风险中的预测作用,报告如下。
1 对象与方法
1.1对象 本研究属于前瞻性队列研究,连续纳入2014年7月-2016年12月接受表柔比星/环磷酰胺序贯多西他赛(epirubicin/cyclophosphamide follow by docetaxel, EC-D)新辅助化疗的女性乳腺癌患者195例,年龄(45.16±5.80)岁(29~61岁)。患者的体质量指数(body mass index,BMI)为(23.15±2.06)kg/m2,心血管疾病风险因素即吸烟、高血压病、糖尿病、血脂异常、高尿酸血症和慢性肾脏病的患者分别有49例(25.1%),42例(21.5%),10例(5.1%),37例(19.0%),37例(19.0%)和8例(4.1%)。ECOG评分为0,1,2分的患者分别有161例(82.6%),31例(15.9%)和3例(1.5%)。患者基线期左心室射血分数(left ventricular ejection fraction, LVEF)为67.0%(64.0%~71.0%),心肌肌钙蛋白I(cardiac troponin I, cTnI)水平为22 pg/mL(10~52 pg/mL)。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。
入组标准:(1)经过临床、影像及病理确诊为原发性乳腺癌;(2)年龄18~75岁;(3) LVEF≥55%;(4)ECOG评分≤2;(5)TNM Ⅱ~Ⅲ期且准备手术治疗;(6)准备使用EC-D新辅助化疗治疗。排除标准:(1)转移性乳腺癌或双侧乳腺癌;(2)骨髓、肝脏或者肾脏功能异常;(3)难以控制的高血压病;(4)之前接受过或正在接受抗肿瘤药物治疗;(5)其他恶性实体肿瘤或者血液恶性疾病史;(6)重度感染史;(7)冠心病、心肌梗死、心衰史;(8)评估难以按照方案正常随访;(9)妊娠或哺乳期妇女。
1.2方法
1.2.1治疗方案 根据患者的病情、意愿及临床需要选择EC-D新辅助化疗。常规方案如下[8]:表柔比星100 mg/m2d1,环磷酰胺600 mg/m2d1,21 d为1个周期,连续4个周期;然后序贯多西他赛,75~100 mg/m2d1,21 d为1个周期,连续4个周期。如果患者的人表皮生长因子受体-2(human epidermal growth factor receptor, HER2)阳性,根据病情和意愿联合曲妥珠单抗6 mg/kg治疗,21 d为1个周期,在多西他赛每次治疗之后使用。患者新辅助化疗结束后即进行手术治疗,术后根据病情和临床需要接受相应的辅助治疗,共29例(14.9%)患者联合曲妥珠单抗治疗。
1.2.2标本采集 于新辅助化疗前(Cycle 0, C0)采集患者的外周血,并分离血浆以检测促血管生成miR的表达水平和cTnI水平。
1.2.3心脏毒性评估 于C0、EC-D化疗4周期结束时(C4)、多西他赛化疗4周期结束时即手术前(C8)及术后3月(M3)、6月(M6)、9月(M9)、12月(M12)分别采用超声心动图评估患者的LVEF,评估标准参考修正的Simpson方法[9]。心脏毒性定义为LVEF水平下降到53%以下且相对于基线期(C0)下降幅度超过10%、心衰、急性冠状动脉综合征或重度威胁生命的心率失常[10-11]。
1.2.4促血管生成miR位点的选择 通过文献检索寻找证实有促进血管生成作用的miR位点,并依据一篇大型综述的荟萃分析总结,筛选出14个促血管生成miR作为研究位点,评估它们预测新辅助化疗乳腺癌患者心脏毒性风险的可能性[7]。
1.2.5定量聚合酶链反应(quantitative polymerase chain reaction, qPCR)和免疫酶荧光检测 依照说明书,采用Trizol(美国Invitrogen公司)提取血浆样本总RNA,并将提取到的RNA通过PrimerScript Real-time reagent kit (日本TaKaRa公司)进行cDNA的逆转录。随后,采用KAPA SYBR®FAST qPCR Kit (美国KAPA公司)对14个促血管生成miR表达水平进行定量检测。miR的相对表达量以U6为内参,利用2-△△Ct方法计算。miR引物序列见表1。采用免疫酶荧光检测试剂盒(美国Dade International Inc公司)检测血浆cTnI的水平。

表1 miR引物序列
1.3随访 195例中,未完成研究20例(失访19例,退出研究1例),余175例完成整个研究流程。本研究按照意向性分析集(n=195)进行分析,提前退出的患者评估指标按照最后一次随访数据进行分析,患者平均随访时间为(17.0±3.0)月,中位随访时间为18.0月(范围:6.0~18.0,1/4-3/4分位值18.0~18.0)。
1.4统计学处理 采用SPSS 22.0软件进行统计分析,采用GraphPad Prism 6.0软件制作图片。采用Spearman秩相关分析miR水平与cTnI水平的相关性;采用Wilcoxon符号秩和检验评估组内各时间点LVEF值的差异;采用Wilcoxon秩和检验评估发生心脏毒性患者和未发生心脏毒性患者中血浆miR表达水平的差异;采用单元多元逻辑回归分析影响心脏毒性发生风险的miR;采用受试者工作曲线(receiver operator characteristic curve, ROC)评估联合miR对于心脏毒性发生风险的预测作用。P<0.05为差别有统计学意义。
2 结 果
2.1基线期促血管生成miR表达水平 qPCR检测得到血浆中14个促血管生成miR的表达水平(表2)。

表2 基线期(C0)miR相对表达水平
2.2促血管生成miR表达水平与乳腺癌心脏毒性标记物cTnI的关联 Spearman检验显示,血浆let-7f (r=-0.251,P<0.001)和miR-20a(r=-0.233,P=0.001)与乳腺癌心脏毒性标记物血浆cTnI水平呈现负相关,余12个miR与cTnI水平无关(表3)。
2.3EC-D新辅助化疗乳腺癌心脏毒性事件发生率 EC-D化疗后C4(P<0.001)、C8(P<0.001)时间点的LVEF相对于基线期(C0)大幅下降,随后在M3-M12各时间点数值上有所上升,但是相对于基线期依然显著降低。11例(5.6%)出现LVEF水平下降到53%以下且相对于基线期下降幅度超过10%。未出现心衰、急性冠状动脉综合征或重度威胁生命的心率失常,总体心脏毒性发生率为5.6%(图1)。

表3 miR与cTnI水平的关联分析
cTnI:心肌肌钙蛋白I.
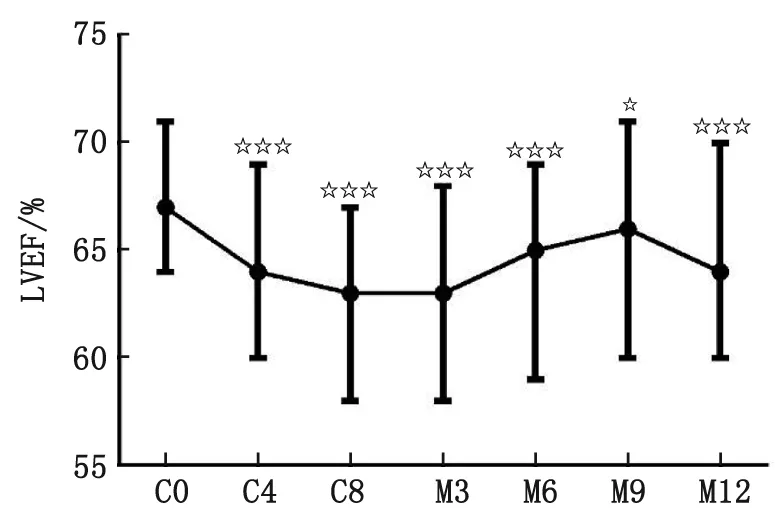
LVEF:左心室射血分数. ☆:P<0.05;☆☆:P<0.01;☆☆☆:P<0.001.图1 各随访点LVEF水平Fig 1 LVEF level at each follow-up points
2.4促血管生成miR与心脏毒性发生风险的关联 血浆let-7f(图2A,P=0.027),miR-20a(图2B,P=0.008),miR-126(图2C,P=0.009),miR-210(图2D,P=0.048)和miR-378(图2E,P=0.043)表达水平在发生心脏毒性患者中均显著降低,而其他9个miR在有心脏毒性患者和无心脏毒性患者间的表达水平未见差异(图2F-N)。进一步采用单元和多元逻辑回归模型评估促血管生成miR与心脏毒性发生风险的关联(表4),发现let-7f(P=0.016),miR-20a(P=0.047),miR-126(P=0.025)和miR-210(P=0.041)是EC-D新辅助化疗乳腺癌患者心脏毒性发生低风险的独立预测因素。
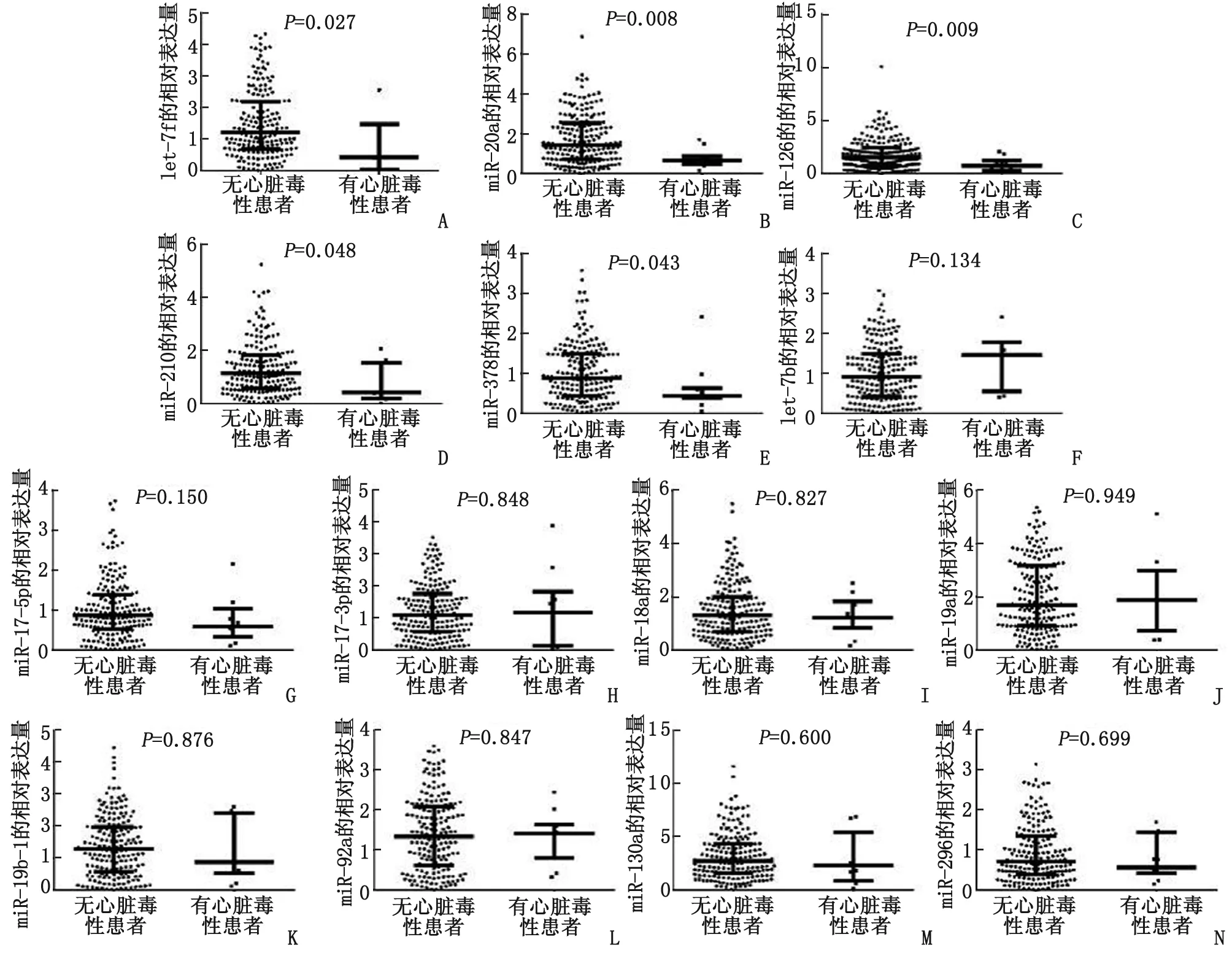
发生心脏毒性患者基线期let-7f(A),miR-20a(B),miR-126(C),miR-210(D)和miR-378(E)表达水平显著低于未发生心脏毒性患者,而其他9个miR在有心脏毒性患者和无心脏毒性患者间表达水平未见差异(F-N).图2 14个促血管生成miR与心脏毒性发生风险的关联Fig 2 Correlation between pro-angiogenic miR and risk of cardiac toxicity
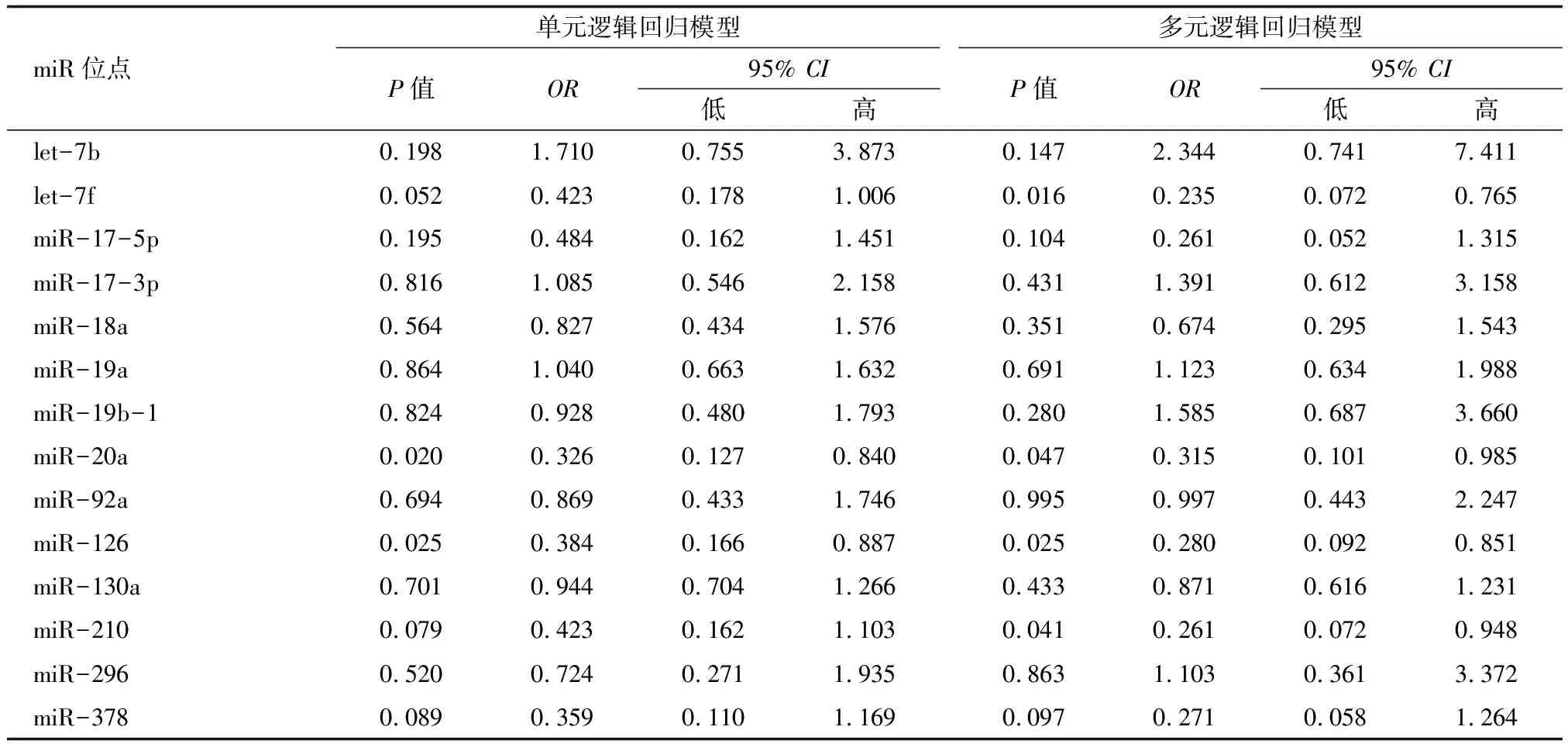
miR位点单元逻辑回归模型P值OR95% CI低高多元逻辑回归模型P值OR95% CI低高let-7b0.1981.7100.7553.8730.1472.3440.7417.411let-7f0.0520.4230.1781.0060.0160.2350.0720.765miR-17-5p0.1950.4840.1621.4510.1040.2610.0521.315miR-17-3p0.8161.0850.5462.1580.4311.3910.6123.158miR-18a0.5640.8270.4341.5760.3510.6740.2951.543miR-19a0.8641.0400.6631.6320.6911.1230.6341.988miR-19b-10.8240.9280.4801.7930.2801.5850.6873.660miR-20a0.0200.3260.1270.8400.0470.3150.1010.985miR-92a0.6940.8690.4331.7460.9950.9970.4432.247miR-1260.0250.3840.1660.8870.0250.2800.0920.851miR-130a0.7010.9440.7041.2660.4330.8710.6161.231miR-2100.0790.4230.1621.1030.0410.2610.0720.948miR-2960.5200.7240.2711.9350.8631.1030.3613.372miR-3780.0890.3590.1101.1690.0970.2710.0581.264
2.5联合let-7f,miR-20a,miR-126和miR-210对于心脏毒性发生风险的预测作用 ROC曲线分析结果表明,联合let-7f,miR-20a,miR-126和miR-210的表达水平对于心脏毒性发生低风险有着较强的预测价值,曲线下面积(AUC)为0.887,95%CI为0.809~0.965,在最佳工作点达到敏感度77.2%,特异度90.9%(最佳工作点定义为敏感度+特异度达到最大值的点)(图3)。

图3 心脏毒性发生风险预测价值的ROC曲线Fig 3 ROC curve of risk prediction of cardiac toxicity
2.6亚组分析 进一步将患者分为联合曲妥珠单抗患者(n=29)和未联合患者(n=166),发现联合曲妥珠单抗患者心脏毒性发生率(4/29,13.8%)高于未联合患者(7/166,4.2%)(P=0.062)。在联合亚组中,心脏毒性患者基线期let-7f(P=0.013),miR-20a(P=0.043)显著低于无心脏毒性患者,而其他12个miR未见差异;在未联合亚组中,心脏毒性患者基线期miR-126(P=0.021),miR-210(P=0.018)显著低于无心脏毒性患者,而其他12个miR未见差异。
3 讨 论
EC-D方案是目前乳腺癌新辅助化疗最常用的方案之一,可有效缩小肿块并提高手术机会和效果,而由于EC-D方案中蒽环类药物可能通过抑制线粒体呼吸、促进心肌细胞自噬和凋亡、破坏心肌细胞纤维结构等机制诱发心脏毒性,EC-D方案的心脏毒性风险需要引起临床的极大关注,但是目前尚缺乏能够预测EC-D方案心脏毒性的标记物。有研究发现,促血管生成相关miR在调控血管生成、心肌细胞纤维化和心肌重塑等方面发挥重要作用,并且可以作为预测蒽环类药物治疗乳腺癌心脏毒性的标志物[5-7]。基于以上证据,笔者推测促血管miR可能有作为预测乳腺癌患者采用EC-D新辅助化疗心脏毒性发生风险的潜能。因此本研究检测了14个促血管生成miR的表达水平,旨在评估14个miR在新辅助化疗乳腺癌患者心脏毒性风险中的预测作用。
目前,乳腺癌患者接受EC-D方案新辅助化疗的心脏毒性研究主要集中在症状性心脏事件(例如心衰等)的发生,这种评估方法低估了其心脏毒性的实际发生风险,因此积极采用更加敏感的LVEF下降联合评估心脏毒性的研究十分必要[12]。为了积极探寻此临床问题,本研究评估了乳腺癌患者采用EC-D新辅助化疗心脏毒性发生的风险,结果发现心脏毒性发生率为5.6%,发生事件均为LVEF水平下降到53%以下且相对于基线期(C0)下降幅度超过10%,而心衰、急性冠状动脉综合征或重度威胁生命的心率失常事件均未发生。
为了更好地降低基于蒽环类药物的新辅助和辅助化疗方案的心脏毒性风险,众多研究开始关注可预测蒽环类药物心脏毒性风险的标志物,例如cTnI、N末端脑利钠肽前体(N-terminal proB-type natriuretic peptide,NT-proBNP)等。而miR作为一类高保守性的非编码RNA,对于蒽环类药物化疗心脏毒性的调控作用一直备受关注。一项近期基础研究发现,miR-34a-5p可以通过靶向Sirt1/p66shc通路促进阿霉素导致的心脏毒性[13]。另外一项研究也发现,miR-320a可以通过靶向血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路加强阿霉素导致的心脏毒性[14]。此外,血浆miR-208水平在老鼠中被发现可以作为阿霉素导致的心脏毒性的生物标志物[15]。而另外一项临床研究发现,循环中miR-1表达水平可以作为阿霉素化疗治疗乳腺癌导致的心脏毒性的预测标志物,且其预测价值高于cTnI水平[16]。然而,目前关于循环促血管生成miR在阿霉素治疗乳腺癌患者导致心脏毒性的预测作用尚未见报道,关于其在EC-D治疗乳腺癌患者心脏毒性中的作用也尚不清楚。本研究发现,let-7f和miR-20a与乳腺癌心脏毒性标记物cTnI均呈现负相关,且let-7f,miR-20a,miR-126和miR-210是EC-D新辅助化疗乳腺癌较少发生心脏毒性风险的独立预测因素,进一步ROC曲线分析显示,联合血浆let-7f,miR-20a,miR-126和miR-210的水平对心脏毒性风险表现出较高的预测价值(AUC:0.887,95%CI:0.809~0.965)。原因可能是:(1)促血管生成miR可以通过调控血管生成、心肌细胞纤维化、改善组织灌注、促进组织恢复等方面间接降低新辅助化疗导致的心脏毒性[17-20]。(2)促血管生成miR可以像miR-34a-5p或miR-320a一样发挥功能,直接调控蒽环类药物对心肌细胞的损伤,但是这个假设还需要进一步通过基础实验证实[13-14]。
本研究尚有一些局限性:(1)本研究为单中心研究,患者主要来自于华北地区,因此存在患者选择性偏移;(2)血浆促血管生成miR表达水平只在新辅助化疗前进行了检测,而在其他各随访点未检测,因此其变化与心脏毒性的关联未能进行评估;(3)有意义的促血管生成miR降低EC-D治疗心脏毒性风险的机制需要进一步通过基础实验评估。
综上所述,本研究发现循环let-7f,miR-20a,miR-126和miR-210水平可以作为乳腺癌患者化疗低心脏毒性风险的生物标记物,这将为乳腺癌个体化治疗及心脏毒性的预防提供一定依据。
