煮制过程中食盐引起肉汤成分含量变化的研究
2019-11-28诸琼妞祝超智赵改名张秋会崔文明
诸琼妞,2,祝超智,*,赵改名,张秋会,崔文明
(1.河南农业大学食品科学技术学院,河南郑州 450002;2.南京农业大学食品科学技术学院,江苏南京 210095)
猪肉汤仅滋味甚好,且溶于水中的营养成分较多,含有丰富的短肽、氨基酸、脂肪酸、骨胶类物质以及矿物质元素等,易被人体吸收和利用[1]。根据汤的色泽可分为白汤、清汤和素汤[2]。白汤经加工后,色泽乳白,煮制过程中不添加食盐[2]。清汤汤汁澄清,以猪肉、猪骨等为原料煮制而成,加入食盐等调味料,煮制的汤就变成了透明的清汤,口味鲜浓[3]。加入食盐后,肉汤中原来的乳化体系被打破,煮制的白汤变成了清汤。
在食品加工过程中添加一定浓度盐是必须的[4]。在肉汤煮制过程中添加食盐,钠离子可提供咸味,氯离子促使肌原纤维蛋白溶解并对咸味起到修饰,从而发挥其加工特性[5]。肉中的蛋白质不能直接被人体内利用,而是转变为氨基酸小分子后被吸收。通过炖或煮的方法,将肉蛋白水解为易被利用的氨基酸而更有利于人体的吸收。煮制过程中食盐的添加,会改变肌原纤维蛋白的结构,尤其是肌球蛋白的提取率、完整性[6],进而影响蛋白质的功能特性及降解途径。另外,不饱和脂肪酸尤其是多不饱和脂肪酸对热不稳定,加盐与无盐肉汤都需经过高温煮制,这对于不饱和脂肪酸有一定的破坏作用,而食盐能在一定程度上防止氧化,提高肉汤的保水保油性能和货架期等[7],影响了食用品质。
随着人们对加工类肉制品需求量的不断增加及对肉制品营养品质要求的不断提高,对加工过程中食品成分的相互作用以及对产品品质、营养特性影响的研究越来越迫切。本文研究食盐对肉汤煮制过程中蛋白质及其降解物、脂肪及脂肪酸含量的差异变化。不仅明确了造成肉汤差异化的主要原因,也为食盐对肉制品营养及风味的影响提供参考。
1 材料与方法
1.1 材料与仪器
冷鲜猪肉(带皮里脊) 产于开封市福生祥食业有限公司,购于郑州市花园路拜特超市;食盐(食用级) 郑州市文化路丹尼斯超市;BCA法测定蛋白浓度试剂盒 上海生工生物工程股份有限公司;预染彩虹广谱蛋白Marker(ColorMixed Protein Marker range 11-245 KD) 北京索莱宝科技有限公司;AccQ·Tag氨基酸试剂包 美国Waters公司;37种脂肪酸甲酯混标 美国Supelco公司;无水乙醚、三氯乙酸、氯仿等均为国产分析纯,正己烷(色谱纯) 国药集团化学试剂有限公司;氮气 河南迎众化工产品有限公司。
T10 ULTRA-TURRAX高速分散器 德国IKA;MULTISKAN GO酶标仪 上海赛默生物科技发展有限公司;24 DN制胶器 北京市六一仪器厂;DYY-5型稳压稳流电泳仪 北京市六一仪器厂;Upland,CA凝胶成像系统 美国UVP公司;ALLEGRA-64A高速冷冻离心机 郑州美生商贸有限公司;ZF-06A脂肪测定仪 上海瑞正仪器设备有限公司;K1301半自动凯氏定氮仪 上海晟生有限公司;GC-2010气相色谱仪(配有氢火焰检测器(FID)及数据分析工作站) 日本岛津公司;Waters2695高效液相色谱仪(配有二极管检测器、717plus自动进样器及数据分析工作站) 美国Waters公司。
1.2 实验方法
1.2.1 猪肉汤的制备 将带皮里脊去除表皮、筋腱、淋巴、血管等,清水浸泡,去除血污,沥干,把肥、瘦肉切分开,按照肥瘦比为3∶7分成两份,保持水温90 ℃以上焯5 min,撇去浮沫和脏污,捞出冷凉并分别将肥、瘦肉切割成2 cm×1 cm×1 cm的块状,以肉∶清水比1∶1.5,(w/w)的比例[8]煮制。加盐组清水中加入水重2%的食盐,无盐组直接用清水煮制。两组处理均先用不锈钢锅大火煮制15 min,条件为1600 W,210 ℃,随后小火煮制2 h,条件为120 W,70 ℃。分别在小火煮制过程的30,60,90,120 min时取样。制样品时将肉汤用单层纱布过滤,无明显大颗粒存留。
1.2.2 样品中粗蛋白含量的测定 吸取样品20 mL(精确到0.1 mL以下同)于离心管中,采用冯志明[9]的方法并略作修改,经过3500 r/min,4 ℃离心10 min后,参照BCA法蛋白质浓度测定。选取酶标板上40个孔,分为标准组和样品组。其中16个孔,每个标准品设置1个重复,各孔分别加入20 μL相应浓度的标准蛋白质溶液;剩余24个孔,分为3个平行组,平行孔编号相同,其中编号不同的8个孔加入浓度不同的20 μL样品稀释液。再向各酶标孔加入200 μL BCA工作液,迅速混匀。在37 ℃水浴中保温30 min,冷却至室温后,在酶标仪上测各孔的A562 nm值。以标准组各孔A562 nm平均值为纵坐标,对应的蛋白质浓度为横坐标,绘制标准曲线。根据三个相同样品稀释液A562 nm值的平均值,在标准曲线上计算出该样品经过稀释后的蛋白质浓度,选择合适稀释度的样品计算最终的样品蛋白浓度,再由稀释倍数计算原样品粗蛋白浓度。
1.2.3 样品中非蛋白总氮含量的测定 吸取样品20 mL(精确到0.1 mL)于烧杯中,采用赵改名等[10]的方法,加入150 g/L三氯乙酸溶液(或15%)20 mL,漩涡混匀1 min以充分沉淀蛋白,于4 ℃冰箱里放置过夜,次日2500×g离心10 min后取滤液,移取10 mL滤液,参照微量凯氏定氮法测定非蛋白氮含量[11]。
1.2.4 样品中可溶性蛋白氮含量的测定 吸取样品20 mL(精确到0.1 mL)于烧杯中,采用赵改名等[10]的方法,加入70 mL缓冲液(50 mmol/L柠檬酸-柠檬酸钠缓冲溶液,pH6.0),在冰浴中高速匀浆1次(22000 r/min),在4 ℃冰箱里放置2 h,12000×g,4 ℃离心15 min,中速滤纸过滤后,用缓冲液定容至100 mL。按照测定粗蛋白含量方法,参照BCA法蛋白质浓度测定。
1.2.5 样品中盐溶性蛋白含量的测定 吸取样品10 mL(精确到0.1 mL)于烧杯中,采用刘野[12]的方法并略作修改,加入80 mL NaCl(0.8 mol/L)溶液,10 mL MgCl2(0.04 mol/L)溶液,用Na2HPO4和NaH2PO4(4 g/kg)粉末,用玻璃棒搅拌10 min,调整pH为7,用高速分散器最低转速下匀浆3 min后,上清液用四层纱布过滤,所得滤液即为肉汤盐溶性蛋白粗提液,参照BCA法蛋白质浓度测定。
1.2.6 样品蛋白质相对分子质量的测定 以分子量范围为11~245 kDa,采用SDS-PAGE分析食盐的添加对煮制过程中肉汤成分的全蛋白的降解情况,参照黄体冉等[13]的方法并略作修改,制胶的分离胶浓度为15%(4.6 mL水,10 mL 30%丙烯酰胺溶液,5 mL 1.5 mol/L Tris(pH8.8),0.2 mL 10% SDS,0.2 mL 10%过硫酸铵,8 μL 0.05% TEMED),浓缩胶浓度为5%(6.8 mL水,1.66 mL 30%丙烯酰胺溶液,1.26 mL 1.5 mol/L Tris(pH6.8),0.1 mL 10% SDS,0.1 mL 10%过硫酸铵,10 μL 0.05% TEMED)。先将10 mL样品离心取上层清液,按30 μL上清液加入10 μL 上样缓冲液的比例混匀后,100 ℃水浴加热10 min,使蛋白变性。冷却至室温后,离心12000 r/min,5 min,取上清液10 μL直接上样电泳。样品进入凝胶以后,在浓缩胶时,将电压调至80 V,保持电压强度不变,在分离胶时,再将电压调至120 V,保持电压强度不变。电泳结束后,准备好染色用的培养皿,用水缓慢将凝胶从玻璃板上脱离。在培养皿内加入考马斯亮蓝R-250染色液,充分混匀,浸泡4 h以上。染色完毕,倾出染色液,用蒸馏水冲洗后将凝胶置于脱色液中,脱色4~8 h,其间更换脱色液2~3次。
注:同一列不同大写字母表示同一加盐量不同煮制时间下猪肉汤各指标的差异显著(P<0.05);同列不同小写字母表示加盐与无盐猪肉汤各指标的差异显著(P<0.05);表2~表5、图2、图4 同。
1.2.7 样品中氨基酸含量及成分的测定 利用高效液相色谱仪,柱前衍生进行氨基酸分析测定。参照顾伟钢[14]和高向阳[15]的方法并略作修改,精确吸取样品5 mL(精确到0.1 mL),与盐酸按体积比1∶1加入水解管中,110 ℃水解24 h,冷却后,超纯水洗涤三次,用氢氧化钠溶液调pH至9.0左右,用超纯水定容至50 mL容量瓶中。色谱条件:色谱柱:Ultimate Amino acid,4.6 mm×250 mm,5 μm,;流动相A:V(醋酸钠溶液)∶V(乙腈)=93∶7,流动相B:V(水)∶V(乙腈)=20∶80,其中醋酸钠溶液用冰醋酸调节pH6.5(流动相A配好的醋酸钠需先调节pH到6.5,再按照上述比例加入乙腈进行抽滤),流动相梯度洗脱;柱温:37 ℃;流速:1 mL/min;检测波长:254 nm;进样量:5 μL。
1.2.8 样品中脂肪含量的测定 吸取样品20 mL(精确到0.1 mL),置于铝盒中,加入海砂约10 g,搅匀后先在95~105 ℃的烘箱中烘6 h直至恒重[16]。参照GB 5009.6-2016食品中脂肪的测定,以无水乙醚为萃取剂采用索氏提取器进行抽提[17]。
1.2.9 样品中脂肪酸含量及成分的测定 吸取样品5 mL(精确到0.1 mL)于50 mL离心管中,参照瞿明勇[1]的方法,用氮吹至出现黄白色固体。再用正己烷进行甲酯化。取上清液进行GC分析。色谱柱:DB-WAX(60 m×0.53 mm×1 μm);分流进样,分流比为1;载气控制方式:线速率36 cm/sec;SPL:250 ℃;FID:280;柱箱温度:50.0 ℃为初始温度,保留1.00 min;25.00 ℃/min升至200.0 ℃不保留;3.00 ℃/min升至230.0 ℃保留50.00 min。
1.2.10 样品蛋白水解指数(PI)计算 公式如下[18]。
式中:A为样品总氮含量;B为样品非蛋白氮含量。
1.3 数据处理
每组试验重复三次,试验数据均以平均值±标准差表示,以平均值±标准差表示测定结果,采用Excel 2007和SPSS 13.0软件进行数据分析。采用ANOVA对实验数据进行差异分析,P<0.05为显著。
2 结果与分析
2.1 加盐与无盐猪肉汤煮制过程中蛋白含量的变化
由表1可知,食盐的添加使猪肉汤中粗蛋白、非蛋白总氮、可溶性蛋白、盐溶性蛋白和蛋白质水解指数均显著增加(P<0.05)。加盐肉汤煮制过程中,粗蛋白与可溶性蛋白氮含量持续上升,且在煮制90 min时,其含量与无盐肉汤的差值最大。在煮制60~90 min期间,无盐肉汤中蛋白质降解反应最剧烈,90 min后水解指数趋于稳定,其蛋白质水解程度始终弱于加盐肉汤。非蛋白氮是表征蛋白质降解的一个指标[19],煮制时间对无盐肉汤中非蛋白总氮含量有显著性影响(P<0.05)。加盐肉汤的盐溶性蛋白含量高于无盐肉汤,肌肉蛋白在盐溶液中溶解是一个重要的物化过程,肉中的大部分蛋白质为水不溶性蛋白质[20],随着肉汤中食盐浓度增加,且每煮制30 min,盐溶性蛋白含量约增加0.6 mg/mL,随着肉汤中食盐浓度增加,蛋白质溶解到水相中,浸提出大量盐溶性蛋白质,从而肌原纤维吸水膨胀[21],与肉制品的加工特性如凝胶性、保水性等有密切关系,直接影响最终产品的食用品质[22]。
2.2 加盐与无盐猪肉汤煮制过程中脂肪含量的变化
由表2可知,煮制时间对肉汤中粗脂肪含量有显著性影响(P<0.05),长时间的煮制有利于脂肪从肌肉中析出。食盐的添加使肉汤的脂肪含量显著增加(P<0.05),煮制30 min时加盐与无盐肉汤的脂肪含量差值较小,到煮制120 min时,加盐肉汤脂肪含量比无盐肉汤多了3.193 mg/mL,差值增加了5倍。且加盐肉汤在煮制90 min时的脂肪含量就达到了无盐肉汤煮制120 min时的脂肪含量。
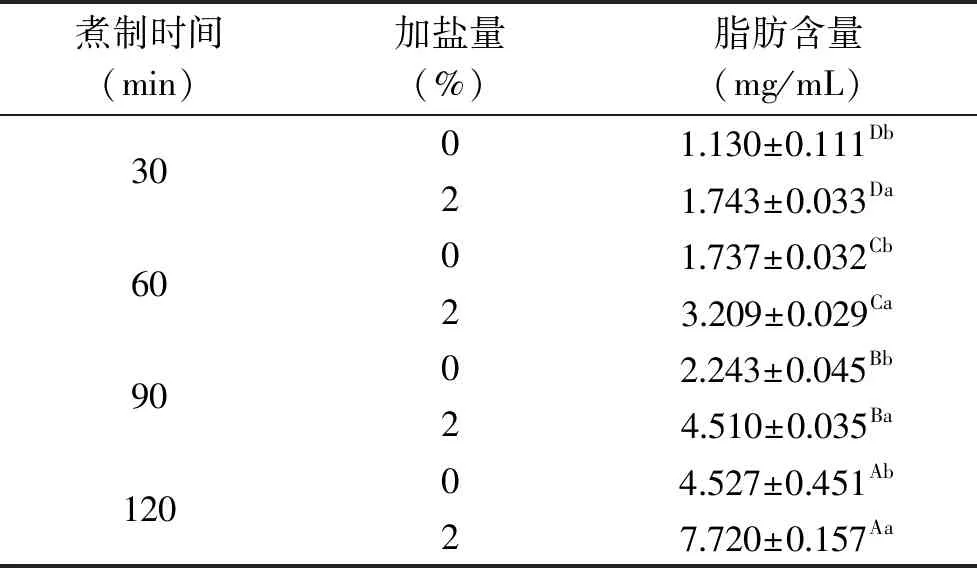
表2 加盐与无盐猪肉汤煮制过程中的脂肪含量Tab1e 2 Fat contents in pork broth withor without salt at different cooking times
2.3 SDS-PAGE凝胶电泳
SDS-PAGE凝胶电泳图谱显示煮制过程中大分子蛋白降解明显。由图1可知,无盐肉汤中分子量主要集中在135~245 kDa;而加盐肉汤中分子量主要集中在35~48 kDa,还含有17~25 kDa的低分子蛋白条带。加盐肉汤中低分子量蛋白条带更多,这说明食盐的添加使大分子蛋白降解成小分子蛋白。并且随着煮制时间的增加,蛋白条带变多且颜色加深,说明蛋白水解更彻底。

图1 不同煮制时间下加盐与无盐猪肉汤中全蛋白SDS-PAGE凝胶电泳图Fig.1 SDS-PAGE profile of whole proteinin pork broth with or without salt at different cooking times
2.4 加盐与无盐猪肉汤中水解氨基酸含量及组成的变化
由表3可知,在煮制过程中,食盐的添加使肉汤中水解氨基酸总含量显著增加(P<0.05),与前面对肉汤中粗蛋白含量的测定结果趋势一致。由图2可知,在煮制120 min时,食盐的添加对肉汤中Glu、Gly、His、Arg、Pro、Tyr、Leu含量有显著性影响(P<0.05)。加盐肉汤的Glu、Gly、His、Tyr等含量显著高于无盐肉汤,特别是加盐肉汤的His含量较高,其对于婴幼儿的成长尤为重要。食品中营养价值的高低主要由蛋白质中氨基酸的含量、组成及比例决定[23],在煮制过程中,各种氨基酸成分含量呈上升趋势,且加盐肉汤的必需氨基酸及总量均高于无盐肉汤,故加盐肉汤的营养成分能更好地被人体吸收利用。

表3 加盐与无盐猪肉汤煮制过程中的水解氨基酸总含量Table 3 Contents of hydrolyzed amino acids in pork brothwith or without salt at different cooking times

图2 煮制120 min时猪肉汤中的水解氨基酸含量及成分Fig.2 Contents and composition of hydrolyzedamino acids in pork broth for 120 minutes
2.5 加盐与无盐猪肉汤中游离氨基酸含量及组成的变化
氨基酸多以结合形式存在于蛋白质中,以自由态存在的游离氨基酸是由氨肽酶对肽类的分解而产生的[24],其可以通过和脂类发生的氧化反应,促进滋味产生,形成风味物质[25],一般把谷氨酸、天冬氨酸、苯丙氨酸、丙氨酸、甘氨酸和酪氨酸这6种能呈现出特殊鲜味的氨基酸称为呈味氨基酸[26]。由表4可知,在煮制90 min后,加盐肉汤中游离氨基酸总含量显著高于无盐肉汤(P<0.05),说明随着加热的进行,食盐可以促进游离氨基酸的溶出。由图3可知,在煮制120 min时,食盐的添加对肉汤中Gly、Arg、Thr、Ala、Pro、Tyr、Phe含量有显著性影响(P<0.05)。Arg在肉汤体系中的含量最多且增加量最大,无盐肉汤的Gly、Thr、Ala、Pro等含量均高于加盐肉汤,故无盐肉汤的必需氨基酸和呈味氨基酸均高于加盐肉汤。

表4 加盐与无盐猪肉汤煮制过程中的游离氨基酸总含量Table 4 Contents of free amino acids in pork brothwith or without salt at different cooking times

图3 煮制120 min时猪肉汤中的游离氨基酸含量及成分Fig.3 Content and composition offree amino acids in pork broth for 120 minutes
2.6 加盐与无盐猪肉汤中主要脂肪酸含量及组成的变化
脂肪酸含量的变化较为复杂,磷脂或甘油酯水解可以提高脂肪酸含量,但同时脂肪酸(尤其是不饱和脂肪酸)发生氧化,会使脂肪酸含量降低[27]。由表5可知,食盐的添加使肉汤中脂肪酸总含量显著增加(P<0.05),与前面肉汤中脂肪含量的测定结果趋势一致。由图4可知,在煮制120 min时,食盐的添加对肉汤中C16∶0、C16∶1、C18∶0、C18∶1含量均有显著性影响(P<0.05)。加盐肉汤中的C18∶1含量显著高于无盐肉汤,C18∶1作为主要单不饱和脂肪酸的一种,故加盐肉汤的单不饱和脂肪酸含量显著高于无盐肉汤;无盐肉汤的C18∶0显著高于加盐肉汤,C18∶0作为主要饱和脂肪酸的一种,故无盐肉汤中饱和脂肪酸含量高于加盐肉汤,这可能跟加热过程中无盐肉汤中不饱和脂肪酸氧化成饱和脂肪酸有关[1],说明食盐的添加在一定程度上防止不饱和脂肪酸的氧化。煮制120 min时,加盐肉汤中脂肪酸含量主要由单不饱和脂肪酸组成,达到52.98%;其次是饱和脂肪酸,占44.71%;多不饱和脂肪酸的含量最低,为2.30%。油酸占单不饱和脂肪酸中比例最高;而多不饱和脂肪酸中亚油酸较高。这与王蒙[28]等对清炖猪肉汤香气物质分析结果中一致。

表5 加盐与无盐猪肉汤煮制过程中的脂肪酸总含量Table 5 Contents of fatty acids in pork brothwith or without salt at different cooking times
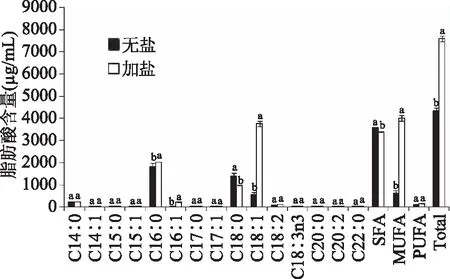
图4 煮制120 min时猪肉汤中的脂肪酸含量及成分Fig.4 Content and composition offatty acids in pork broth for 120 minutes
3 结论
本实验对加盐与无盐猪肉汤煮制过程中的蛋白质、脂肪等进行了定性与定量分析,验证了食盐添加对肉汤成分的影响,不仅为肉汤营养及风味提供参考,更明确了造成肉汤差异化的主要原因。在不同煮制时间下,加盐肉汤中粗蛋白含量、可溶性蛋白含量、非蛋白氮含量、盐溶性蛋白含量、脂肪含量、氨基酸总含量、脂肪酸总含量均高于无盐肉汤。SDS-PAGE凝胶电泳图谱显示,食盐的添加使大分子蛋白降解成小分子蛋白。无盐肉汤游离氨基酸中的呈味氨基酸和脂肪酸中的饱和脂肪酸含量均高于加盐肉汤,故其滋味比加盐肉汤要鲜美;加盐肉汤中的氨基酸总含量、脂肪及脂肪酸总含量均高于无盐肉汤,且其必需氨基酸比例更高,单不饱和脂肪酸更丰富,更有利于被人体吸收利用,在一定程度上提高了营养品质。
