益血降浊汤对TGF-β1诱导的肾小管上皮细胞α-SMA表达的影响
2019-11-27王悦彤徐薇李现成张楠屈凯于小勇
王悦彤 徐薇 李现成 张楠 屈凯 于小勇


摘要:目的探讨益血降浊汤对转化生长因子(TGF-β1)诱导的肾小管上皮细胞α-SMA表达及抗肾间质纤维化的影响。方法通过体外培养建立肾小管上皮细胞模型。分为空白组、转分化组、益血降浊汤组(实验组)和海昆肾喜胶囊组(对照组),通过免疫细胞化学法(SABC 法)检测后在倒置显微镜下观察细胞的形态和生长,以及观察各组细胞TGF-β1、α-平滑肌肌动蛋白(α-SMA)的表达。应用MTT比色法探索肾成纤维细胞的增殖情况,继而探讨益血降浊汤对体外培养的肾成纤维细胞增殖的影响。结果益血降浊汤能下调α-SMA的表达,对比TGF-β1组,差异具有统计学意义(P<0.05)。结论益血降浊汤通过下调α-SMA缓解肾间质纤维化。
关键词:肾小管上皮细胞;益血降浊汤;TGF-β1;α-SMA;肾间质纤维化
中图分类号:R285.6文献标志码:A文章编号:1007-2349(2019)10-0068-05
Effect of Yixue Jiangzhuo Decoction on Expression of α-SMA in Renal Tubular
Epithelial Cells Induced by TGF-β1
WANG Yue-xi1,XU Wei2,LI Xian-cheng2,ZHANG Nan2,QU Kai2,YU Xiao-yong2
(1. Shaanxi University of Traditional Chinese Medicine,Xianyang 712046,China;
2. Shaanxi Provincial Hospital of Traditional Chinese Medicine,Xian 710003,China)
【Abstract】Objective: To study the effect of Yixue Jiangzhuo Decoction on expression of α-SMA and anti-renal interstitial fibrosis induced by transforming growth factor(TGF-β1)in renal tubular epithelial cells. Methods: Tubular epithelial cell models were established by in vitro culture and divided into blank group,transdifferentiation group,Yixue Jiangzhuo Decoction group(experimental group)and Haikun Shenxi capsule group(control group). The cell form and growth as well as expression of TGF-β1 and α-smooth muscle actin(α-SMA)in each group were observed by immunocytochemistry(SABC method)under the inverted microscope. The proliferation of renal fibroblasts was observed by MTT colorimetric method and then the effect of Yixue Jiangzhuo Decoction on the proliferation of kidney fibroblasts cultured in vitro was studied. Results: Yixue Jiangzhuo Decoction could down-regulate the expression of α-SMA,compared with TGF-β1 group,and the difference was statistically significant(P<0.05). Conclusion: Yixue Jiangzhuo Decoction relieves renal interstitial fibrosis by down-regulating α-SMA.
【Key words】 renal tubular epithelial cells,Yixue Jiangzhuo Decoction,TGF-β1,α-SMA,renal interstitial fibrosis
腎脏是维持机体内环境相对稳定的重要器官。肾成纤维细胞通常不分布在正常的肾脏组织中。当肾脏受到创伤或者处于炎症状态时,肾内转化生长因子(例如TGF-β1)等的分泌增加可能导致肾小管上皮细胞的极性丧失,细胞内紧密连接消失,细胞间粘连减少,导致肾小管上皮细胞向肾成纤维细胞的转化,转化后的肾成纤维细胞有成纤维细胞、间充质细胞和平滑肌细胞三大特性,可以表达多种标志蛋白,如α-平滑肌肌动蛋白(α-SMA)。转化后的成纤维细胞又可上调转化生长因子(如TGF-β1)的表达,进一步的加重肾脏病理改变[1-4]。益血降浊汤的组方为[5](黄芪30 g,生地20 g,丹参20 g,山茱萸15 g,制首乌15 g,淫羊藿15 g,川芎15 g,莪术15 g,泽兰15 g,生大黄6 g)在本院肾病科长期的临床用药的过程中发现对其慢性肾脏病具有较好的临床疗效[6~7],在此它可以通过抑制和下调肾成纤维细胞中TGF-β1的表达来拮抗肾成纤维细胞不良增殖,从而抑制肾成纤维细胞的产生和发展。通过探究其中的作用机制和进一步观察肾小管上皮细胞的TGF-β1、α-SMA表达[8~10],本文通过观察肾小管上皮细胞的TGF-β1、α-SMA表达,探究实益血降浊汤对体外培养的肾成纤维细胞增殖作用的影响。现将实验结果报道如下。
1实验材料
1.1实验细胞
1.1.1从正常的Wistar大鼠肾皮质中培养获得肾小管上皮细胞
1.1.2从正常的Wistar大鼠肾髓质中培养获得肾成纤维细胞
1.2试剂及耗材胎牛血清(杭 州 四 季 青),DMEM-F12培养基,Ⅰ型胶原酶(美国 Sigma),胰酶消化液,兔抗人角蛋白CK18(Bioss),SABC免疫组化染色试剂盒(博士德生物),DAB显色试剂盒(博士德生物)、MTT(Sigm美国)、胰蛋白酶(Ameresco美国)、PMSF(北京鼎国生物科技有限公司)、青链霉素 、Tris(西安辉瑞生物科技有限责任公司)。
1.3实验仪器ST 16R(Thermo Scientific),CO2细胞培养箱(Therom公司),显微镜日本(Olympus),Centrifuge 5417R台式冷冻离心机,Power/PAC 300电泳仪,酶标仪,移液器等。
2实验方法
2.1肾小管上皮细胞模型的建立
2.1.1肾小管节段分离实验前将大鼠禁食12 h并进水自由。断尾处死,在75%乙醇中浸泡5 min。取处死大鼠肾组织并置于含有双抗的PBS冷溶液中以除去肾蒂和包膜,剪碎,研磨肾皮质,并将取得的液体经离心机1500 r/min离心8 min,弃上清液在沉淀中加入Ⅰ型胶原酶,分别37℃振荡消化,1500 r/min 离心。
2.1.2肾小管上皮细胞的元代培养及传代离心后的沉淀中加入含10%胎牛血清的DMEM-F12培养基并轻轻吹打混合均匀。将细胞接种到培养瓶中并静置于37℃5%的CO2培养箱中培养。24 h后补加培养基。原代培养约4~6 d,讓其细胞贴满瓶底,用胰蛋白酶消化并传代培养。在倒置显微镜下观察细胞的形态及生长规律。
2.1.3免疫细胞化学法(SABC 法)细胞爬片后,PBS轻轻冲洗。4%多聚甲醛固定60 min。试剂盒显色,使用苏木素轻度复染,并用中性树胶封片。
2.2将肾小管上皮细胞分组进行免疫细胞化学观察和TGF-β1、α-SMA的表达分析
2.2.1分组空白组、转分化组、益血降浊汤组、海昆肾喜胶囊组。
2.2.2每组进行细胞爬片24 h后进行同步,然后按照上述组别培养24 h。取出细胞爬片,用PBS漂洗,4%多聚甲醛室温固定20 min后进行细胞免疫化学检测。按试剂盒说明书进行具体步骤操作。
2.3通过MTT比色法探益血降浊汤对体外培养的肾成纤维细胞增殖的影响。
2.3.1分组空白组、增殖组、益血降浊汤组、海昆肾喜胶囊组。
2.3.2空白组在培养液中加入0.4 mL空白组大鼠血清,增殖组在培养液中加入肾脏间质纤维化模型大鼠血清和空白组大鼠血清各0.2 mL,益血降浊汤组在培养液中加入肾脏间质纤维化模型大鼠血清和含益血降浊汤血清各0.2 mL,海昆肾喜胶囊组在培养液中加入肾脏间质纤维化模型大鼠血清和含百令胶囊血清各0.2 mL,继续培养。在48 h、72 h和96 h的培养中,收集培养孔中各组的细胞,并通过MTT比色法观察肾成纤维细胞增殖的变化。
2.4统计学处理采用SPSS 19.0统计学软件处理,数据用(平均数±标准差)表示,组间采用单因素方差分析。组间两两比较用LSD。P<0.05为差异有统计学意义。
3实验结果
3.1肾小管上皮细胞模型的建立在显微镜下能观察到正常的肾小管细胞的形态大多为鹅卵石铺路状。排列分布较为均匀,贴壁数量较多,见图1。
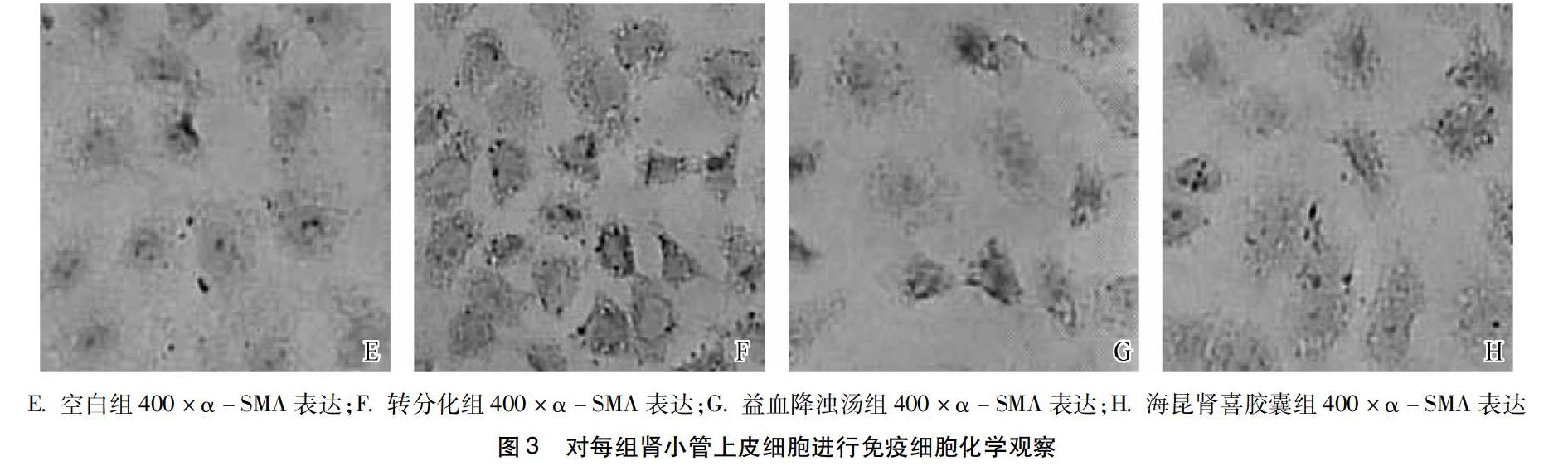
3.2分别对每组肾小管上皮细胞进行免疫细胞化学观察、分析TGF-β1、α-SMA的表达情况倒置显微镜下观察细胞的形态, 益血降浊汤组、海昆肾喜胶囊组的肾小管上皮细胞形态学特征呈椭圆形。转分化TGF-β1组细胞呈现无序的梭形外观, 并且细胞被转分化为肾成纤维细胞.阳性表达十分明显,呈深棕色。益血降浊汤组、海昆肾喜胶囊组黄色区域变淡,而益血降浊汤组阳性表达的总面积低于海昆肾喜胶囊组,差异有统计学意义(P<0.001),图2。
观察显微镜下观察在胞浆中的α-SMA表达,上图空白组中可观察到少量黄色阳性表达。转分化组黄色阳性表达增多和加深,部分区域呈深褐色,阳性表达非常显著。益血降浊汤组阳性表达面积明显减少,相较其他组颜色变浅,与空白组相比,具有显著差异性。益血降浊汤组α-SMA表达与海昆肾喜胶囊组α-SMA表达相比较黄色变少,如图颜色较浅,阳性表达区域明显降低,差异具有统计学意义(P<0.001),见图3。
3.3统计学结果转分化组肾成纤维细胞的增殖明显高于空白组,与之比较具有统计学差异(P<0.05);益血降浊汤组、海昆肾喜胶囊组的肾成纤维细胞的增殖低于转分化组,与之相比具有统计学差异(P<0.05);说明转分化组肾成纤维细胞的增殖量增加,而益血降浊汤能降低转分化因子的表达,见表1。
转分化组肾小管上皮细胞中TGF-β1、α-SMA的表达显著高于空白组,与之比较有统计学差异(P<0.05);益血降浊汤组、海昆肾喜胶囊组的肾小管上皮细胞TGF-β1、α-SMA的表达明显低于转分化组,与之相比具有统计学差异(P<0.05);说明转分化组肾小管上皮细胞TGF-β1、α-SMA的表达显著,而益血降浊汤能明显降低肾小管上皮细胞TGF-β1、α-SMA的表达,见表2。
转分化组中益血降浊汤对体外培养的肾成纤维细胞48h增殖的影响高于空白组,与之比较有统计学差异(P<0.05);益血降浊汤组、海昆肾喜胶囊组的益血降浊汤对体外培养的肾成纤维细胞增殖的影响低于转分化组,与之相比具有统计学差异(P<0.05);说明转分化组中益血降浊汤对体外培养的肾成纤维细胞增殖的影响较大,而益血降浊汤能降低在体外培养的肾成纤维细胞的增殖,见表3。
转分化组中益血降浊汤对体外培养的肾成纤维细胞72h增殖的影响明显高于空白组,与之比较有统计学差异(P<0.05);益血降浊汤组、海昆肾喜胶囊组的益血降浊汤对体外培养的肾成纤维细胞增殖的影响低于转分化组,与之相比具有统计学差异(P<0.05);说明转分化组中益血降浊汤对体外培养的肾成纤维细胞增殖的影响较大,而益血降浊汤能明显降低在体外培养的肾成纤维细胞的增殖,见表4。
转分化组中益血降浊汤对体外培养的肾成纤维细胞96h增殖的影响显著高于空白组,与之比较有统计学差异(P<0.05);益血降浊汤组、海昆肾喜胶囊组的益血降浊汤对体外培养的肾成纤维细胞增殖的影响显著低于转分化组,与之相比具有统计学差异(P<0.05);说明转分化组中益血降浊汤对体外培养的肾成纤维细胞增殖的影响较大,而益血降浊汤能明显降低在体外培养的肾成纤维细胞的增殖,见表5。
4讨论
肾间质纤维化的产生和进行式发展是多种慢性肾脏病持续进展的结果。是由多种炎症介质、转化生长因子、细胞增殖和细胞凋亡等作用下的结局。其中它与成纤维细胞的增殖密切相关。肾间质纤维化的形成过程主要是由于肾小管上皮细胞在病理损伤、炎症等的状态下经TGF-β1作用下,产生肾成纤维细胞,使之进一步发展,并最终积聚在细胞外基质中[11-15]。α-SMA作为肌成纤维细胞的标志蛋白,同时也是肾小管上皮细胞向间质细胞转化过程中的标志性蛋白,它是细胞外基质合成的主要来源,又影响肾成纤维细胞、肾小管细胞等的凋亡进程。当在TGF-β1增加的过程中,α-SMA的表达增高,对肾脏的损害程度也随之加重[16-17]。针对这一病理因素,在实验和临床上选用益血降浊汤进行治疗取得了良好效果。黄芪在方中可以活血利湿,补中益气,大黄通腑泄浊,推陈出新,制首乌、山茱萸、淫羊藿、生地黄补气血,益精气,有填补肾精之功效。与丹参、川芎、泽兰、莪术配伍可达到活血化瘀,通利排毒的目的。此方标本兼顾,使得生化有源,水湿得化。益血降浊汤能抑制转分化的发生发展,具有拮抗α-SMA表达,同时降低TGF-β1对肾小管上皮细胞的损伤,改善肾脏纤维化的程度,对肾脏功能起到保护作用[18]。
综上,益血降浊汤可通过降低TGF-β1和α-SMA蛋白的表达,减轻肾小管上皮细胞的损伤程度,抑制转分化的发生,减轻肾间质纤维化,进一步证实了其在预防和治疗慢性肾脏病中的重要性。
参考文献:
[1]李冰,吕海琳,高兆丽,等.肾小管上皮细胞-间充质细胞转分化与肾间质纤维化的关系研究[J].系统医学,2018,3(21):196-198.
[2]杨嫆嫆,陆红,吴莲凤,等.垂盆草提取物對TGF-β1诱导的肾小管上皮细胞-肌成纤维细胞转分化和基质累积的影响[J].温州医科大学学报,2015,45(4):243-247.
[3]冯博.益气活血降浊方对TGF-β1诱导肾小管上皮细胞转分化的作用机制研究[D].中国中医科学院,2012.
[4]杨丽花.四妙散对尿酸诱导的人肾小管上皮细胞(HK-2)TGF-β1、α-SMA及E-Cadherin表达的影响[D].福建中医药大学,2014.
[5]成晓萍,于小勇,程小红,等.益血降浊汤对慢性肾脏病4期微炎症状态的影响[J].陕西中医,2015,36(4):399-401.
[6]成晓萍,魏钢,于小勇,等.益血降浊汤治疗慢性肾脏病4期疗效观察[J].陕西中医,2013,34(8):950-952.
[7]于小勇,程小红,淡华.益血降浊汤配合西药治疗慢性肾功能衰竭56例[J].陕西中医,2009,30(12):1585-1586.
[8]黄健,陈松,杨静,等.阿利吉仑抑制转化生长因子-β1诱导肾小管上皮细胞转分化的作用研究[J].临床肾脏病杂志,2018,18(8):466-470.
[9]卢小露,艾斯,郑健.肾康灵对TGF-β1干预的肾小管上皮细胞的α-SMA和E-cadherin表达的影响[J].中国卫生标准管理,2018,9(18):117-119.
[10]索艳,谷优优,王肃.α-平滑肌肌动蛋白对高糖诱导的肾小管上皮细胞增殖、凋亡的影响[J].山东医药,2017,57(30):14-17.
[11]王雪瑶,陈爽,王小丛.TGF-β1诱导体外培养人肾小管上皮细胞的表型转化[J].中国实验诊断学,2019,23(6):1055-1058.
[12]李翠琼. 黄芪甲苷对TGF-β1诱导的大鼠肾小管上皮细胞转分化的作用及机制研究[D].西南医科大学,2018.
[13]刘新辉,宋高峰,韦弦,李顺民.黄芪甲苷对TGF-β1诱导下肾小管上皮细胞间充质转分化的保护作用及机制[J].江西中医药,2018,49(2):61-63.
[14]曲玥阳,陈旭,岳喜庆,等.原代肾小管上皮细胞的提取和培养方法的优化[J].沈阳农业大学学报,2018,49(1):27-33.
[15]黄健,陈松,杨静,闵亚丽.阿利吉仑抑制转化生长因子-β1诱导肾小管上皮细胞转分化的作用研究[J].临床肾脏病杂志,2018,18(8):466-470.
[16]秦曼,吕孝冬,仲维娜.中医药防治肾小管上皮细胞转分化的研究进展[J].黑龙江中医药,2015,44(2):74-75.
[17]曾虹,周懿,姚国媛.转化生长因子β1诱导人肾小管上皮细胞转分化:Notch1受体阻断剂的影响[J].中国组织工程研究,2014,18(51):8261-8268.
[18]冯博. 益气活血降浊方对TGF-β1诱导肾小管上皮细胞转分化的作用机制研究[D].中国中医科学院,2012.
