高效液相色谱法测定复方氯霉素水杨酸酊中氯霉素及水杨酸含量的方法学建立与验证
2019-11-27刘晓强张岩琛
刘晓强 张岩琛
高效液相色谱法(high-performance liquid chromatography, HPLC)为常用分离和检测手段,在有机化学、生物化学、医学、药物学与检测、化工、食品科学、环境监测、商检和法检等方面均有广泛应用[1]。其仪器配置包括色谱泵及控制器、色谱柱、检测器、进样器、数据处理及控制[2],具有适用性广、分析速度快、分离效率高、检测灵敏度高、检测自动化、样品回收利用简单等特点[3],有着广泛的应用前景。
复方氯霉素水杨酸酊是一种医院制剂,与药厂制剂比较,具有密切结合临床、适应性强、高度灵活性、治疗作用明确、专科特色强、不良反应少等优点[4]。其主要成分包括氯霉素和水杨酸,为无色或微黄色澄清透明液体,需要遮光、密封贮存。氯霉素为广谱抑菌剂,抑制革兰阴性菌的作用强于革兰阳性菌,也是治疗厌氧菌感染的特效药物之一,其次用于敏感微生物所致的各种感染性疾病的治疗。水杨酸是一种脂溶性有机酸,刺激性大,仅外用,具有抗真菌及溶解角质作用,可沿分泌油脂的皮脂腺渗入毛孔深层,溶解毛孔内陈旧堆积的角质层,改善毛孔粗大情况。复方氯霉素水杨酸酊是一种皮肤外用药,临床主要用于痤疮、毛囊炎、脂溢性皮炎、酒糟鼻及头皮糠疹的治疗,局部用药可达到非常理想效果[5-8]。
采用滴定法测定制剂中水杨酸的含量误差来源广泛,且结果受操作人员影响较大[9],且已有文献[10-11]采用 HPLC同时测定制剂中氯霉素和水杨酸含量的报道。本研究就采用 HPLC同时测定复方氯霉素水杨酸酊中氯霉素和水杨酸的含量的可行性进行分析。现报道如下。
1 仪器与试药
1.1 仪器
高效液相色谱仪(品牌Waters,型号2695;品牌岛津,型号LC-20AD;品牌Agilent,型号1200);色谱柱:C18-15-H(Hibar-C18, Merk, 4.6×250 mm,5 µm)、C18-30-H(Symmetry-C18, Waters, 4.6×150 mm, 5 μm)、C18-37-H(ZORBAX Extend-C18,Agilent, 4.6×250 mm, 5 μm);电子天平(Mettler Toledo,型号 PB602-N/1203010201,唯一性标识DZTP-07-H;Mettler Toledo,型号XP205/B209739832,唯一性标识DZTP-20-H)。
1.2 试药
氯霉素对照品(中国食品药品检定研究院,批号130555-201203,含量99.8%);水杨酸对照品(中国食品药品检定研究院,批号100106-201605,含量99.3%);氯霉素二醇物对照品(中国食品药品检定研究院,130436-200302)。乙腈为色谱纯,其他试剂为分析纯,水为纯化水。复方氯霉素水杨酸酊。
2 溶液的制备
供试品溶液及对照品溶液应临用新制。
2.1 对照品溶液
分别精密称取氯霉素对照品和水杨酸对照品适量(10 mg氯霉素、水杨酸加甲醇1 ml)使溶解,用流动相制成每毫升中含100 μg氯霉素、200 μg水杨酸的溶液,作为对照品溶液。
2.2 供试品溶液
精密量取氯霉素水杨酸酊10 ml至100 ml容量瓶中,用流动相稀释至刻度,摇匀。再精密量取5 ml至50 ml容量瓶中,用流动相稀释至刻度,摇匀,作为供试品溶液。
2.3 定位溶液
精密称取10 mg氯霉素二醇物对照品、10 mg氯霉素对照品和20 mg水杨酸对照品至100 ml容量瓶中,加入少量流动相,超声使其溶解,用流动相稀释至刻度,摇匀,作为定位溶液。
3 方法学验证
3.1 色谱条件
色谱柱:用十八烷基硅烷键合硅胶为填充剂;以0.01 mol/L庚烷磺酸钠缓冲溶液(取磷酸二氢钾6.8 g,用 0.01mol/L庚烷磺酸钠溶液溶解并稀释至1000 ml,再加三乙胺5 ml,混匀,用磷酸调节pH值至 2.5)—乙腈(75:25)为流动相;流速为 1.0 ml/min;检测波长为278 nm,柱温为30 ℃;进样量10 µl。
3.2 检测波长的确定
本实验利用二极管阵列检测器,对氯霉素和水杨酸在210~400 nm波长处进行扫描,其中氯霉素的最大吸收波长为278 nm,水杨酸的最大吸收波长为234 nm和298 nm。由于氯霉素与水杨酸含量比较较少,所以为了提高氯霉素的灵敏度,更好地兼顾氯霉素和水杨酸的检测需求,所以选择278 nm作为检测波长。见图1~2。
3.3 系统适用性实验
取定位溶液、溶解溶剂和稀释溶剂,在“3.1”项色谱条件下进样分析,记录色谱。出峰的时间顺序分别是氯霉素二醇物(3.395 min)、水杨酸(8.672 min)、氯霉素(10.653 min)。各峰之间的分离度均大于2.0。见图3~4,表1。
3.4 线性关系实验
3.4.1 溶液配制精密称取氯霉素对照品 25 mg和水杨酸对照品50 mg,置于25 ml量瓶中,加入少量甲醇和流动相,超声使其溶解,用流动相稀释至刻度,摇匀,得储备溶液。精密量取储备溶液5 ml至20 ml容量瓶得浓度为氯霉素250 μg/ml水杨酸500 μg/ml的①号溶液;精密量取储备溶液3 ml至25 ml容量瓶得浓度为氯霉素120 μg/ml水杨酸240 μg/ml的②号溶液;精密量取储备溶液5 ml至50 ml容量瓶得浓度为氯霉素100 μg/ml水杨酸200 μg/ml的③号溶液;精密量取储备溶液2 ml至25 ml容量瓶得浓度为氯霉素80 μg/ml水杨酸160 μg/ml的④号溶液;再精密量取上述③号溶液5 ml至10 ml容量瓶得浓度为氯霉素50 μg/ml水杨酸100 μg/ml的⑤号溶液,分别用流动相稀释至刻度,摇匀。按“3.1”项色谱条件下,依次进样10 μl,测定峰面积。以峰面积为纵坐标,氯霉素及水杨酸的浓度为横坐标,分别进行线性回归。

图1 氯霉素波长吸收
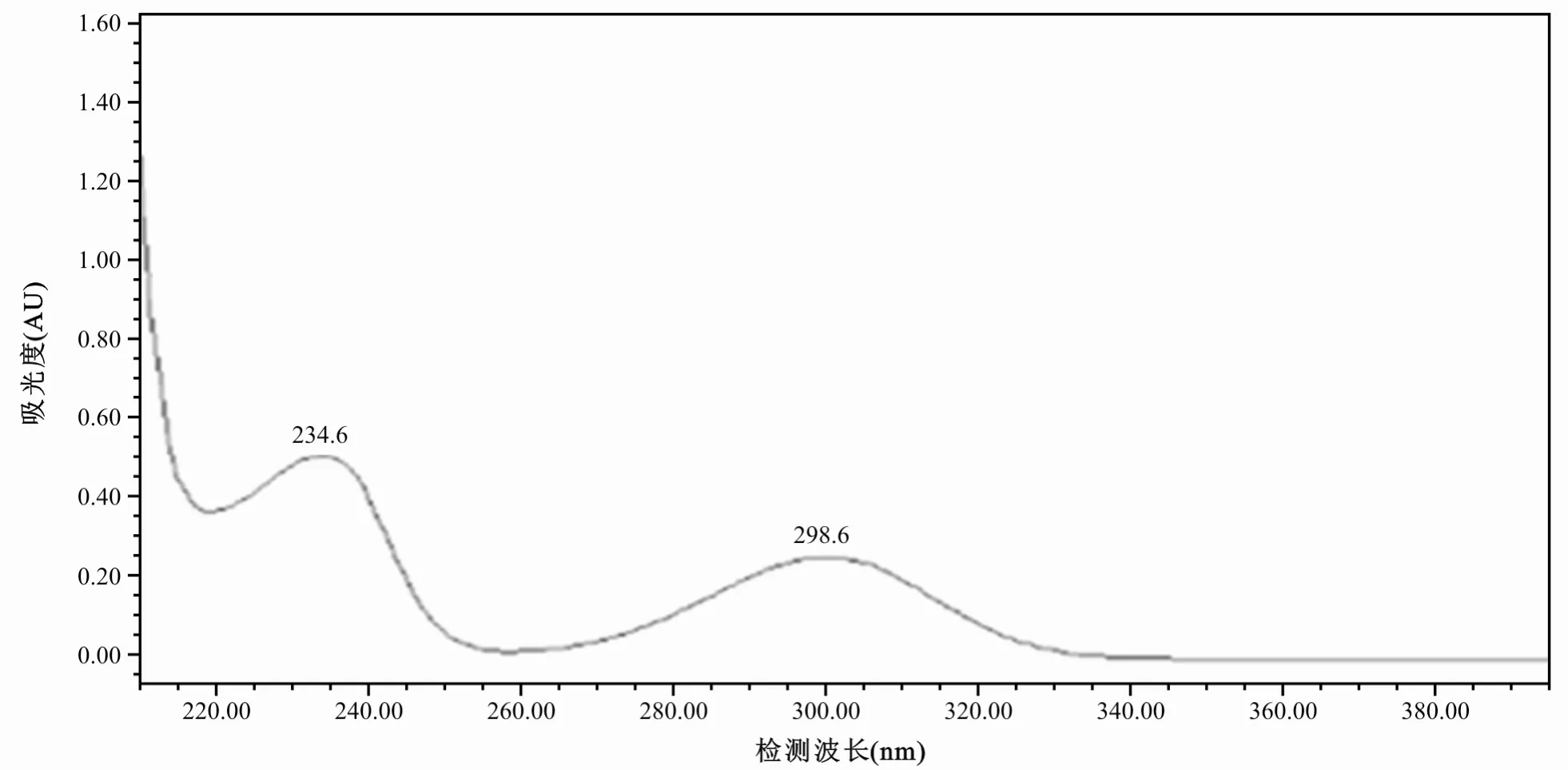
图2 水杨酸波长吸收
图3 流动相溶液色谱图

图4 系统适用性溶液色谱图

表1 系统适用性实验结果
3.4.2 测定结果得到氯霉素和水杨酸的回归方程分别为氯霉素:Y=16 259X+ 87 826(r=0.999 8);水杨酸:Y=5 323.1X+ 38 341(r=0.999 9)。结果表明,氯霉素在52.95~264.77 μg/ml和水杨酸在102.60~512.98 μg/ml范围内呈良好的线性关系。见表2~3。
3.5 精密度实验
3.5.1 溶液配制取氯霉素和水杨酸线性关系项下⑤号溶液即对照品溶液,在“3.1”项色谱条件下重复进样6次,测定峰面积。

表2 氯霉素线性关系实验结果

表3 水杨酸线性关系实验结果
3.5.2 测定结果氯霉素和水杨酸的相对标准偏差(RSD)分别为0.57%和0.64%。见表4~5。
3.6 对照品稳定性实验
3.6.1 溶液配制取氯霉素和水杨酸线性关系项下⑤号溶液即对照品溶液,在“3.1”项色谱条件下,在室温下分别于0、6、14、27 h进样10 μl,记录其峰面积。

表4 氯霉素精密度实验结果(n=6)

表5 水杨酸精密度实验结果(n=6)
3.6.2 测定结果对照品室温条件下至少在27 h内稳定。见表6~7。

表6 氯霉素对照品稳定性实验结果

表7 水杨酸对照品稳定性实验结果
3.7 膜吸附实验
3.7.1 溶液配制精密量取复方氯霉素水杨酸酊10 ml至100 ml容量瓶中,用流动相稀释至刻度,摇匀。再精密量取5 ml至50 ml容量瓶中,用流动相稀释至刻度,摇匀,滤过0 ml、2 ml、4 ml、6 ml、8 ml在“3.1”项色谱条件下分别进样,测定峰面积。
3.7.2 测定结果实验数据显示可能存在膜吸附,建议弃去至少2 ml初滤液。见表8~9。

表8 氯霉素膜过滤实验结果

表9 水杨酸膜过滤实验结果
3.8 耐用性实验
3.8.1 溶液配制分别改变色谱条件中柱温(25 ℃、30 ℃、35 ℃)、流速(0.8 ml/min、1.0 ml/min、1.2 ml/min)以及水相 pH(2.3、2.5、2.7),在同一台高效液相色谱仪用同一种色谱柱,以及改变仪器改变色谱柱,用系统适用性溶液作为供试品溶液,在上述不同条件下分别取10 μl注入液相色谱仪,记录色谱图。
3.8.2 测定结果各峰之间的分离度均大于2.0,表明本方法耐用性良好。见图5~10,表10~13。
3.9 重复性实验

图5 柱温25 ℃系统适用性

图6 柱温35 ℃系统适用性

表10 改变柱温实验结果

图7 流速0.8 ml/min系统适用性

图8 流速1.2 ml/min系统适用性

表11 改变流速实验结果

图9 水相pH2.3系统适用性

图10 pH2.7系统适用性

表12 改变水相pH实验结果

表13 改变仪器、色谱柱实验结果
3.9.1 溶液配制精密量取复方氯霉素水杨酸酊10 ml至100 ml容量瓶中,用流动相稀释至刻度,摇匀。再精密量取5 ml至50 ml容量瓶中,用流动相稀释至刻度,摇匀。取同一批复方氯霉素水杨酸酊平行配制6份。在“3.1”项色谱条件下分别进样。
3.9.2 测定结果氯霉素的含量为97.25%,RSD为0.37%;水杨酸的含量为97.90%,RSD为0.44%,均不超过2.0%。见表14~15。

表14 氯霉素重复性实验结果(n=6)
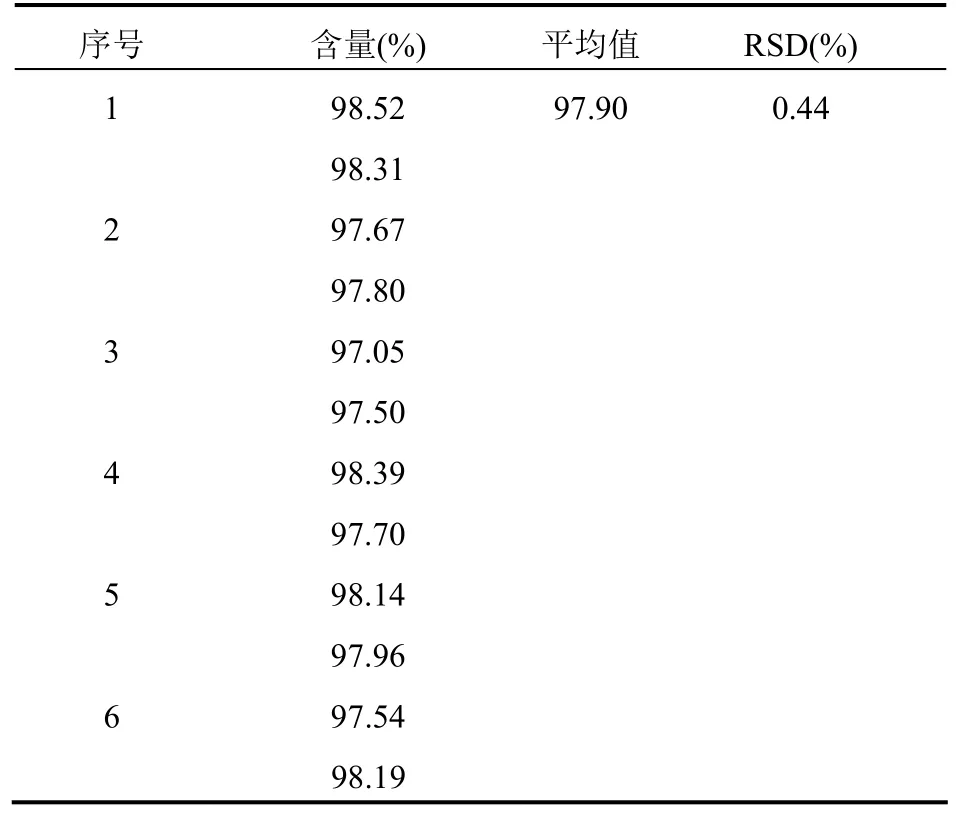
表15 水杨酸重复性实验结果(n=6)
3.10 回收率实验
3.10.1 溶液配制分别精密量取 10 ml同批次的复方氯霉素水杨酸酊至3个100 ml容量瓶中,精密称取氯霉素对照品约1 g和水杨酸对照品约2 g至10 ml容量瓶中,加入少量甲醇和流动相,超声使其溶解,用流动相稀释至刻度,摇匀,再分别精密量取 800 μl、1000 μl、1200 μl至之前的 3 个 100 ml容量瓶中,用流动相稀释至刻度,摇匀,再分别精密量取5 ml置50 ml量瓶中,用流动相稀释至刻度,摇匀。在“3.1”项色谱条件下分别进样,计算回收率。
3.10.2 测定结果氯霉素的平均回收率为 99.7%,RSD为0.35%,水杨酸的平均回收率为99.8%,RSD为0.41%。见表16~17。

表16 氯霉素加样回收率实验结果(n=9)
3.11 含量测定
3.11.1 溶液配制取氯霉素水杨酸酊三批,按“2.2”项下方法制备供试品溶液,滤过,取续滤液,按“2.1”项下方法制备对照品溶液,在“3.1”项色谱条件下分别进样,每批样品平行配制2份,每份进样两针。记录色谱图,按外标法以峰面积计算。
3.11.2 测定结果结果如下,见表18。

表17 水杨酸加样回收率实验结果(n=9)

表18 氯霉素、水杨酸含量测定实验结果(%)
4 讨论
本研究采用 HPLC能够同时测定氯霉素和水杨酸含量,方法简便、灵敏度高、结果准确可靠。
4.1 溶解方法的选择
本实验在对照品溶液与供试品溶液中加入甲醇目的是增强溶解,由于甲醇未在水杨酸及氯霉素处出峰,所以可以不用考虑甲醇的干扰。
4.2 流动相体系的优化
本实验采用生产单位制定标准氯霉素含量测定项下用的流动相,当水相:乙腈为75:25时,氯霉素和水杨酸峰形好,分离效果好,保留时间适当。后期耐用性实验结果表明,提高水相pH有助于提高氯霉素和水杨酸的分离度,并且可通过增加有机相比例以缩短分析时间,增加工作效率,但是由于时间限制,未能对流动相的配比对两主峰的分离度及保留时间的影响进行深入研究,同时也未能探讨在不同pH值流动相中样品及对照品溶液的稳定性,之后可以对这方面进一步地探讨。
综上所述,本实验采用 HPLC成功实现了复方氯霉素水杨酸酊中氯霉素和水杨酸的含量测定,本法操作简便、准确、灵敏度高、专属性强、干扰小,并且实验验证了该法对氯霉素和水杨酸含量测定的准确性和可靠性,对复方氯霉素水杨酸这种医院制剂的的安全性、有效性起到了保证作用,为进一步提升复方氯霉素水杨酸酊质量提供依据。
