胡萝卜黑腐病生防放线菌G-1抑菌活性研究
2019-11-21张家榕高振峰张晓宇
张家榕,高振峰,李 娜,张晓宇
(1.山西农业大学 生命科学学院,山西 太谷 030801; 2.山西省农业科学院 农产品贮藏保鲜研究所,山西 太原 030031;3.山西科技新闻出版传媒集团 今日农业杂志社,山西 太原 030006)
胡萝卜黑腐病作为一种由胡萝卜黑腐交链孢(Alternariaradicina)引起的重要真菌病害,在全国各种植区均有发生,对我国胡萝卜产量、品质和产业健康发展具有重要影响[1]。近年来,有关该病害的发生与防治已有相关报道,但同其他作物病害相比被重视程度较低,相关防治研究较为薄弱。目前,国内主要有赵晓军等[1-2]、周建波等[3-4]、罗真等[5]、李海波等[6]、周通[7]、牛国飞[8]对胡萝卜黑腐病的发生规律、病原鉴定及生物学特性、化学防治、抗性品种筛选、采后贮藏保鲜危害等内容进行了相关研究和报道。此外,还有研究发现,胡萝卜受该病原侵染不仅对其产量和品质具有重要影响,而且还会产生植物毒素影响人体健康,因此,有关胡萝卜黑腐病防治的研究对提高种植区胡萝卜产量、品质和人体健康具有重要意义[9]。
化学防治作为植物病害防治的重要手段,在保障我国粮食安全中发挥重要作用。目前,已有研究发现,百菌清药剂和扑海因药剂在防治该病害方面具有较好效果[1,5],但随着化学药剂防治问题(残留超标、病原抗药性增强和环境污染等)的凸显、人们对高品质安全农产品需求的增加以及我国“减药”方针的出台,新型、绿色安全农药开发和防治技术研究迫在眉睫[10-11]。另外,为有效防治胡萝卜黑腐病和缓解化学农药不合理使用引起的负面问题,国外还对该病原的生物防治进行了相关研究,例如研究发现菌株Pseudomonassp.MF416和ClonostachysroseaIK726生物菌剂对胡萝卜黑腐病具有良好防效[12];Pseudomonasspp.与热水联合处理胡萝卜种子可有效防止胡萝卜黑腐病发生[13];菌株Ulocladiumatrum对胡萝卜黑腐病防效显著[14],但在国内还未见有关该病害生物防治的相关研究报道。
选用抗病微生物进行植物病害生物防治,近年来备受关注,并被广泛研究。放线菌作为一种抗病微生物,是抗生素的主要产生菌之一,且所产抗生素种类较多,约占已报道种类的60%~80%,对多种植物病害具有良好防效,其植物病害防治应用潜力明显[15]。鉴于此,拟从胡萝卜表层土壤中分离和筛选对胡萝卜黑腐病病原具有良好抑制效果的放线菌菌株,并进行盆栽试验效果验证,旨在筛选对该病原具有良好防效的拮抗放线菌,为该病害的生物防治奠定理论基础。
1 材料和方法
1.1 供试菌株
胡萝卜黑腐交链孢(Alternariaradicina)由山西省农业科学院农产品贮藏保鲜研究所采后病理室分离,经ITS序列鉴定,以斜面保藏法低温保藏。
1.2 供试培养基
高氏1号培养基:可溶性淀粉20 g、MgSO4·7H2O 1 g、KNO31 g、NaCl 0.5 g、K2HPO4·3H2O 0.5 g、FeSO4·7H2O 0.01 g、K2Cr2O7750 (μg/mL)0.75 g、琼脂20 g,蒸馏水1 000 mL,pH值7.5。
改良PDB培养液:马铃薯200 g、葡萄糖10 g、胡萝卜汁5 mL,蒸馏水定容至1 000 mL,自然pH值。
改良PDA培养基:在改良PDB培养液中加入20 g琼脂粉。
1.3 胡萝卜表层土中放线菌分离与纯化
1.3.1 胡萝卜表层土收集 2017年10月7日分别于新绛县西行庄村、大聂村和襄汾县义西毛村,将收获的胡萝卜用冰袋带回实验室,置于无菌不锈钢托盘中风干4 h,随后使用软毛刷将其表面携带的泥土缓慢刷下、收集,从而获得胡萝卜表层土,并置于100 mL无菌蓝盖瓶中保存备用。
1.3.2 放线菌分离与纯化 称取胡萝卜表层风干土壤1 g,置于装有15 mL无菌水的50 mL无菌离心管中,置于恒温振荡培养箱中,28 ℃、160 r/min振荡3 h,稀释10 000倍后吸取120 μL涂布于高氏1号平板,28 ℃恒温培养15 d,每处理重复3次,每隔24 h观察1次,有菌落出现时依据菌落颜色和形态及时进行纯化。各菌落使用划线法纯化3代后于4 ℃保存备用。
1.4 胡萝卜黑腐病拮抗放线菌初筛
采用平板对峙法[16]对胡萝卜黑腐病拮抗放线菌初筛:使用直径为5 mm的打孔器,打取活化培养5 d后的胡萝卜黑腐病病原,接种于改良PDA平板中央;使用接种环挑取放线菌,于距离病原真菌菌饼中心2 cm处接种供试的放线菌;置于28 ℃恒温培养箱中培养7 d,并采用十字交叉法测量对峙面病原菌落直径,计算抑菌率,以仅接种病原菌菌落为对照,各处理和试验均重复3次。
抑菌率=(对照菌落直径-处理菌落直径)×100/(对照菌落直径-5 mm)×100%。
1.5 胡萝卜黑腐病拮抗放线菌复筛
1.5.1 放线菌无菌发酵滤液制备 采用接种环挑取一环纯化后的放线菌菌株,分别接种至装有300 mL改良PDB无菌发酵液的500 mL三角瓶中,于28 ℃、160 r/min恒温振荡培养7 d后终止发酵。随后将发酵液于4 ℃、12 000 r/min离心10 min,并用0.22 μm微孔滤膜过滤,获得无菌发酵滤液。
1.5.2 无菌发酵滤液抑菌活性测定 采用宋洪允等[17]的生长速率法,以胡萝卜黑腐病为靶标,对不同放线菌菌株无菌滤液的抑菌活性进行测定。各处理和试验均重复3次。
1.6 拮抗放线菌G-1的16S rRNA序列鉴定
参照GAO等[18]的方法提取菌株G-1基因组DNA,经1%琼脂糖凝胶电泳检测合格后,使用通用引物27F和1492R,参照GAO等[18]的反应体系和扩增程序对菌株G-1的16S rRNA基因序列进行扩增,经1%琼脂糖凝胶电泳检测合格后,将PCR产物送交北京华大基因科技有限公司进行测序。获得菌株G-1 16S rRNA基因序列后使用NCBI在线软件BLAST将获得序列同模式菌株进行比对分析,选择不同种同源性较高的模式菌株16S rRNA基因序列,使用MEGA 5.0软件中的ClustalW(1.6)进行多重比对分析,构建NJ系统发育树,以确定菌株G-1分类地位。
1.7 拮抗放线菌G-1盆栽防效测定
将田间土壤与河沙按照2∶1(体积比)混合,置于高压灭菌锅中121 ℃灭菌2 h,60 ℃烘干。随后将灭菌沙土置于上口径21 cm和高18 cm的塑料盆中,装土至盆高的3/4。每盆播种胡萝卜种子(超级红冠)6粒,置于人工气候箱中(相对湿度80%~90%,温度25~30 ℃,光周期L∶D为16∶8,光照强度24 000 lx),长出真叶后间苗,每盆留苗3棵。长至5~6叶后,采用针刺喷雾(以表面不形成液滴为宜)和灌根(用量为100 mL)2种方法同时接种胡萝卜黑腐病病原(浓度为106cfu/mL)。每隔5 d接种1次,连续接种2次。最后一次接种病原5 d后,采用喷雾和灌根2种方法同时接种放线菌G-1不同稀释倍数(0、50、100、200、300倍)无菌发酵液上清液,以空白无菌发酵液作为对照,用量为150 mL。每隔5 d接种1次,连续接种3次。在最后一次接种发酵液20 d后参照周建波等[4]的方法统计处理组和对照组发病情况,计算病情指数和防效。其余盆栽管理措施参照田间管理。每处理4盆,各试验重复3次。
1.8 数据处理
采用SPSS 17.0软件对数据进行处理,利用Duncan’s法进行多重比较。
2 结果与分析
2.1 胡萝卜表层土中放线菌的分离、纯化
采用平板稀释涂布法对不同种植区胡萝卜表层土壤中的放线菌进行分离、纯化,3个胡萝卜种植区分离到的放线菌数量存在明显差异(表1)。其中,采集地大聂村和义西毛村的差异较小,分别有7、6株放线菌被分离、纯化出来,而西行庄村则只有2株放线菌被分离、纯化出来,说明放线菌菌群多样性具有明显的地域差异。从分离数量上来看,其明显少于已报道的细菌和真菌,说明放线菌的分离培养难度较大。另外,在无菌水对照平板中未发现其他杂菌生长,说明分离到的7株放线菌均来自胡萝卜表层土壤。

表1 不同采集地胡萝卜表层土放线菌分离、纯化结果Tab.1 Separation and purification results of actinomycetes from carrot surface soils of different collections
2.2 不同放线菌菌株对胡萝卜黑腐病病原的抑菌活性
采用平板对峙法对上述15株不同形态放线菌对胡萝卜黑腐病病原的抑菌活性进行测定后发现,仅有3株放线菌(YHT-2、G-1、G-6)对胡萝卜黑腐病病原具有一定抑菌活性,只占分离总数的20%(表2),再次说明抗病放线菌分离较困难。3株有活性的菌株中以菌株G-1抑菌活性最高,抑菌率为77.2%,明显高于菌株YHT-2(13.2%)和G-6(17.9%)(表2、图1),说明菌株G-1对胡萝卜黑腐病病原具有良好的抑菌效果,且在该病害生物防治中具有较好应用潜力。
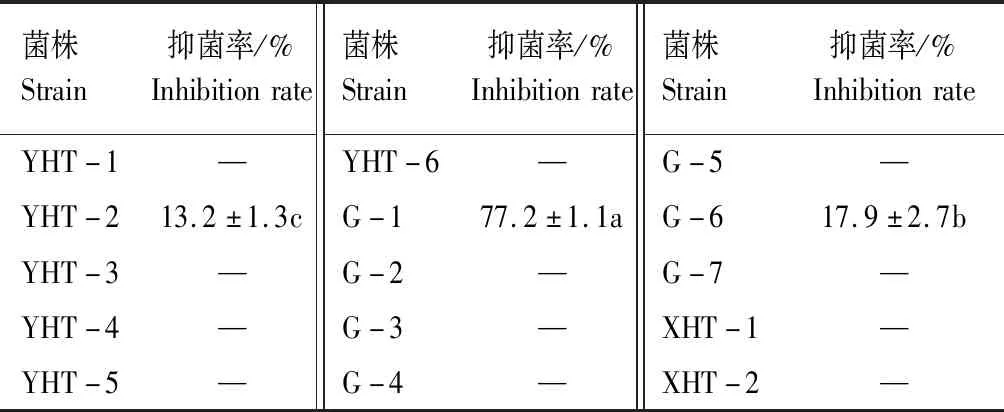
表2 不同放线菌对胡萝卜黑腐病病原的抑菌活性Tab.2 Antifungal activity of different actinomycetes against Alternaria radicina
注:“—”表示无抑菌活性;不同小写字母表示差异显著(P<0.05),表3同。
Note: “—” represent no antifungal activity;Different lowercase letters indicate significant difference (P<0.05),Tab. 3 is the same.
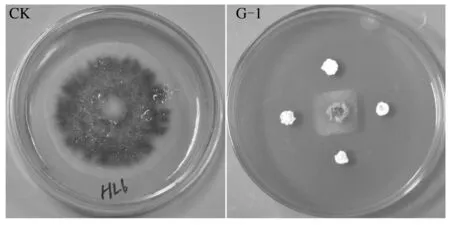
图1 菌株G-1对胡萝卜黑腐病病原的抑菌活性Fig.1 The antifungal activity of strain G-1 against Alternaria radicina
2.3 不同放线菌菌株发酵液对胡萝卜黑腐病病原的抑菌活性
放线菌生长较缓慢,且其活性物质产生所需时间较长,因此,为避免活性菌株漏筛,本研究还采用发酵液对15株放线菌对胡萝卜黑腐病病原抑菌活性进行了复筛。结果发现,菌株G-1发酵液抑菌活性同平板对峙法差异较小,抑菌率为78.5%(表3、图2);菌株YHT-2和菌株G-6发酵液抑菌活性高于平板对峙法测定结果,其发酵液抑菌活性分别为34.3%、46.1%;菌株YHT-5和菌株G-3发酵液同样表现出微弱抑菌活性,抑菌率分别为12.6%和13.7%,说明部分菌株在固体平板上产活性物质速率和产量低于发酵培养,且单纯使用平板对峙法筛选活性菌株存在漏筛可能性,因此,在后续活性菌株筛选过程中应注重发酵液复筛过程。
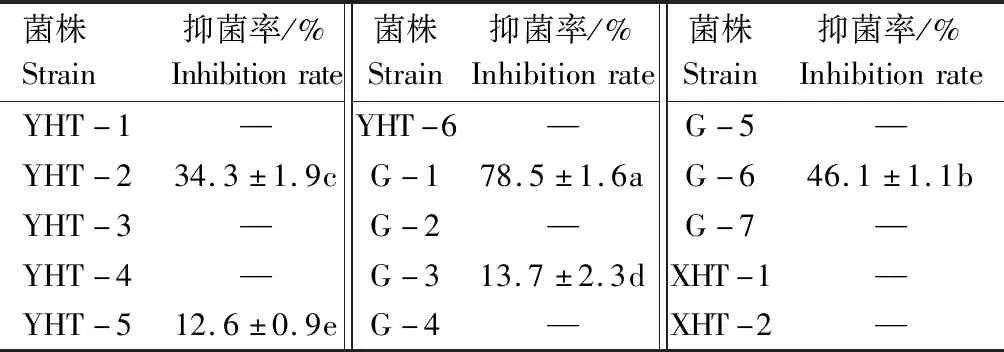
表3 不同放线菌发酵液对胡萝卜黑腐病病原的抑菌活性Tab.3 Antifungal activity of fermentation broth of different actinomycetes against Alternaria radicina
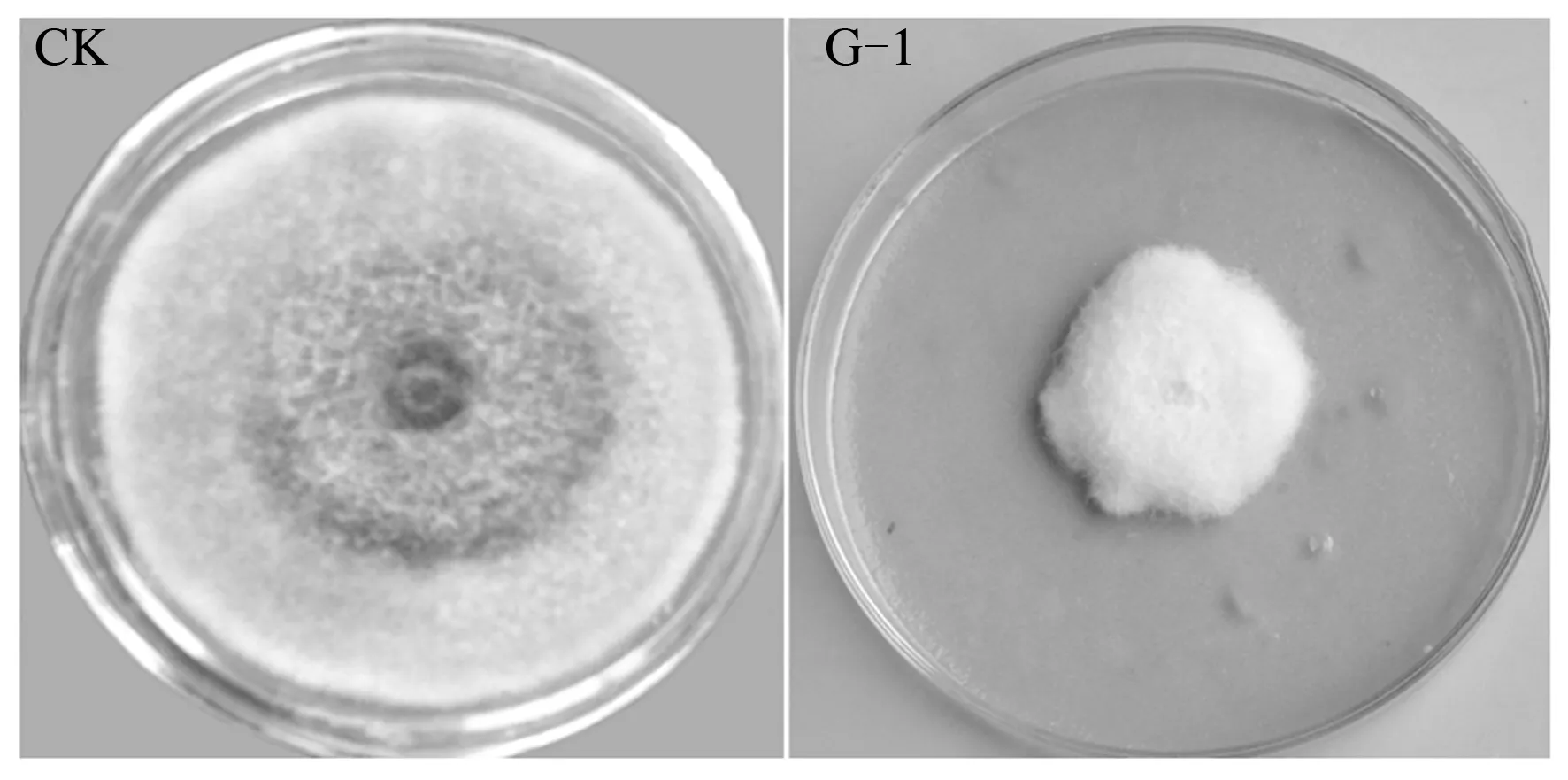
图2 菌株G-1发酵液对胡萝卜黑腐病病原的抑菌活性Fig.2 Antifungal activity of fermentation broth of strain G-1 against Alternaria radicina
2.4 基于16S rRNA的菌株G-1分类
将菌株G-1的16S rRNA序列在NCBI网站中同模式菌株进行对比分析,发现菌株G-1的16S rRNA基因序列同链霉菌属菌株具有较高的相似比。随后选择链霉菌属不同种模式菌株16S rRNA序列与菌株G-1的16S rRNA序列使用MEGA 5.0软件构建系统NJ系统发育树,发现菌株G-1同模式菌株StreptomycesalbidoflavusDSM 40455T(NR 116634.1)聚在同一支(图3),说明菌株G-1同该菌株具有较高的同源性,因此,将该菌株鉴定为微白黄链霉菌(Streptomycesalbidoflavus)。
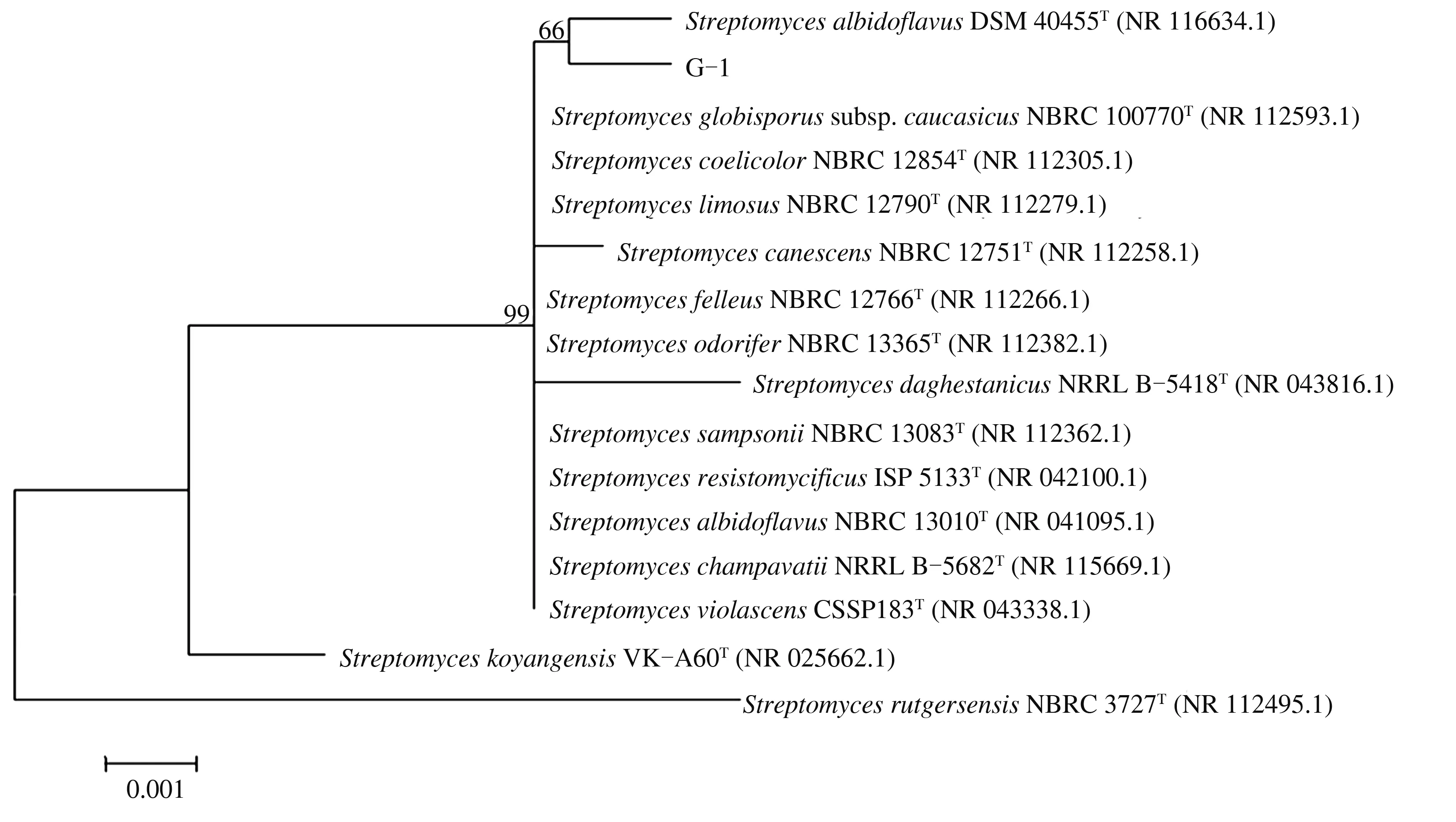
图3 菌株G-1基于16S rRNA序列的NJ系统发育树Fig.3 NJ phylogenetic tree of strain G-1 based on 16S rRNA sequence
2.5 菌株G-1发酵液对胡萝卜黑腐病的盆栽防效
采用盆栽试验对菌株G-1发酵液对胡萝卜黑腐病的盆栽防效进行测定后发现,菌株G-1发酵液对该病害具有良好防效,但不同稀释倍数之间防效差异显著,以稀释50倍和100倍防效较好,其防效分别为73.2%、70.5%(表4)。当稀释倍数为0时,试验过程中出现烧苗现象;当稀释倍数达200倍时,防效出现明显下降,为54.9%;当稀释倍数为300倍时,防效出现大幅度下降,防效仅为43.4%。上述结果表明,在利用菌株G-1发酵液防治胡萝卜黑腐病时,稀释倍数应为100倍左右,既可保持良好防治效果,又不影响胡萝卜正常生长。
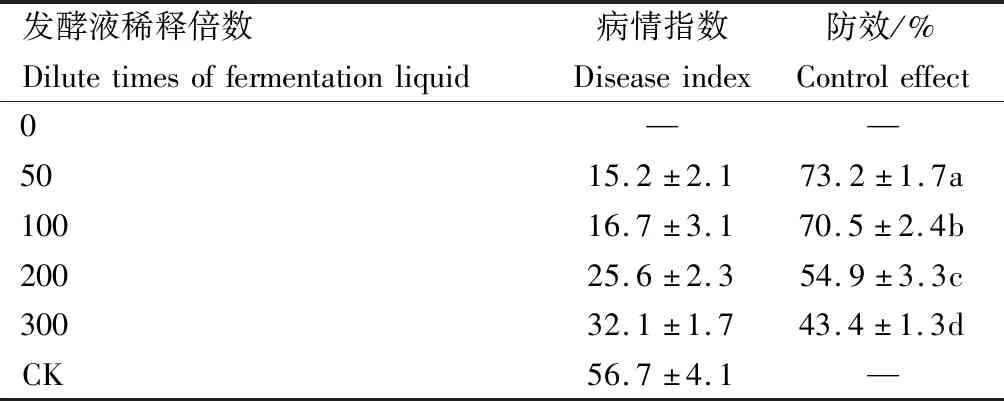
表4 菌株G-1不同稀释倍数发酵液
注:—表示无防效;同列不同小写字母表示差异显著(P<0.05)。
Note: —represent no control effect.Different lower case letters in the same column indicate significant differences(P<0.05).
3 结论与讨论
生物防治作为一种绿色环保的病害防治措施,在减少化学农药使用和缓解化学农药负面问题方面具有明显积极意义,因此,近年来备受人们关注[19]。在众多生物防治措施中利用微生物或其天然产物防治植物病害的研究较普遍,且已取得一定进展,然而放线菌抗病微生物开发研究同细菌和真菌相比较薄弱,这可能与放线菌分离较困难有关。但放线菌作为一类主要抗生素产生菌,应用潜力极为明显[20],因此,针对胡萝卜黑腐病病原有良好抑制效果的拮抗放线菌进行了研究,旨在筛选对该病原具有良好抑制作用的拮抗放线菌,为该病害生物防治奠定理论基础。
本研究通过平板稀释涂布法,对不同种植区胡萝卜表层土中的放线菌进行了分离和纯化,发现不同种植区放线菌数量存在一定差异,证明生长环境对微生物数量和种类具有重要影响[21-22]。随后采用平板对峙法,以胡萝卜黑腐病病原为靶标对分离到的15株放线菌抑菌活性进行了测定,发现15株放线菌中仅有5株表现出抑菌活性,占总数的1/3,但仅菌株G-1抑菌活性达50%以上,同其他病原拮抗微生物筛选比例相比差异较大,再次表明拮抗放线菌分离难度较大。另外,山西省农业科学院农产品贮藏保鲜研究所果蔬采后病害生物防治课题组在前期研究中发现,单独使用平板对峙法筛选会漏筛部分拮抗微生物,这是因为有些微生物在平板上产生抗菌物质的速率较慢,且需要培养一段时间方可产生抗菌物质,而此时病原生长较快,拮抗微生物在发挥作用之前被覆盖。因此,本研究随后还采用发酵培养和生长速率法对15株放线菌的抑菌活性进行了复筛,发现同样仅有菌株G-1表现出良好的抑菌活性,发酵液抑菌率为78.5%,而菌株G-6在复筛过程中发酵液抑菌率(46.1%)明显高于平板对峙法(17.9%)。另外,在菌株G-1作用下胡萝卜黑腐病病原在平板上呈现白色,说明该菌株还对胡萝卜黑腐病病原孢子的产生具有一定抑制作用,推断抑制产孢可能是其防病机制之一。
在明确菌株G-1对胡萝卜黑腐病病原抑菌活性后,采用16S rRNA序列分析对其分类地位进行了研究,发现菌株G-1同模式菌株StreptomycesalbidoflavusDSM 40455T(NR 116634.1)聚在同一支,将其鉴定为微白黄链霉菌(Streptomycesalbidoflavus)。田间试验或盆栽试验是评价菌株应用潜力的必要手段,为明确菌株G-1的应用潜力,随后采用盆栽试验对该菌株无菌发酵液的防病效果进行了测定。结果表明,菌株G-1无菌发酵液的最大稀释倍数为100倍,在该稀释倍数下可保持70.5%的防效。当稀释倍数为200倍时防效出现明显下降,防效低于60%。100倍稀释液防效同已报道的75%百菌清可湿性粉剂600倍液(75.72%)和50%扑海因可湿性粉剂1 500倍稀释液(73.41%)防效接近[5],说明S.albidoflavusG-1发酵液在该病害防治中具有良好应用潜力。另外,试验过程中发现菌株G-1无菌发酵液在稀释倍数为200倍时防效开始下降,可能与无菌发酵液中抗菌物质含量较低有关,而抗菌物质含量较低可能与现有发酵条件有关,后期还需进一步对发酵条件进行优化。
本研究成功筛选出了对胡萝卜黑腐病病原具有良好抑制作用的拮抗放线菌G-1,但所有数据均来自室内平板测定和盆栽试验,有关其抗菌物质种类、发酵条件优化、生物菌剂研发和田间应用效果等后续还需进一步研究,从而为该病害的生物防治和该菌株生防制剂的开发与应用奠定理论基础。
