SPECT/CT评价前列腺癌粒子植入剂量分布与疗效初探
2019-11-19张宏涛刘晓丽周汝明于慧敏隋爱霞边艳珠王娟时高峰
张宏涛 刘晓丽 周汝明 于慧敏 隋爱霞 边艳珠 王娟 时高峰
近30年来,125I放射性粒子在前列腺癌永久性近距离治疗中应用的最为广泛,被美国国立综合癌症网络(NCCN)指南推荐为早期前列腺癌的首选根治手段[1]。除了植入技术,粒子植入的剂量学也受到广泛关注。美国医学物理学家协会(AAPM)建议所有行粒子植入术的患者在术后均需行剂量计算以保证治疗效果[2]。术后剂量验证用于评价靶区和危及器官的剂量,其标准方法为以CT图像为基础应用计算机治疗计划系统(TPS)进行剂量计算[3-5]。但此剂量验证方法存在粒子识别困难、必须预知植入的粒子数目、粒子游走至其他部位影响剂量计算、仅为计算结果并非实际剂量分布、人为计算误差等弊端。如何解决以上问题是困扰粒子植入剂量验证的难题。单光子发射计算机断层成像术/计算机断层成像术(Single-photonemissioncomputedtomography/Computed tomography,SPECT/CT)的γ照相机可以探测从患者体内发射的γ射线并对其成像,本课题组前期研究发现SPECT/CT探测的粒子放射性计数值可准确量化,并与粒子周边剂量有相关性[6]。本研究用SPECT/CT射线探测粒子植入患者的剂量分布情况及其评价前列腺癌粒子植入疗效的可行性。
资料与方法
一、一般资料
选取2014年12月和2018年6月河北省人民医院粒子植入治疗的前列腺癌患者两例。患者1,66岁,前列腺特异抗原(PSA)12.35 ng/ml,前列腺腺泡腺癌,Gleason评分2+3=5分,cT1cN0M0Ⅱ期,中危。患者2,76岁,PSA 12.75 ng/ml,前列腺腺泡腺癌,Gleason评分3+4=7分,cT2aN0M0Ⅱ期,中危,冠心病病史3年。
二、仪器和设备
(1)计算机三维系统治疗计划系统:Prowess Panther Brachy v5.0近距离治疗计划系统,美国Prowess有限公司。(2)18G植入针和Mick200-TPV型粒子植入枪等辅助设备购自美国Mick Radio-Nuclear公司。(3)B&K 超声:Flexfocus800型,购自丹麦B-K公司。(4)6711-99型放射性125I粒子:粒子长 4.5 mm,直径0.8 mm,活度 0.3 mCi,能量27~35 keV,半衰期59.4 d,购自上海欣科医药公司。(5)SPECT/CT:Discovery NM/CT 670型,美国GE公司。(6)3D打印模板:整体厚度5 mm,预设针道孔处厚10 mm,材料为somos11122型树脂,应用sla600型3D打印机打印,北京启麟科技有限公司。(7)放射性活度计:RM-905a型井型电离室,中国计量科学研究院。(8)负压真空垫:大小 120 cm×80 cm×4 cm,淄博天辰医疗器械厂。
三、术前准备
术前1周扫描盆腔CT,层厚5 mm,将CT图像传入TPS行术前计划。处方剂量(PD)给予145 Gy。危及器官的剂量在其耐受剂量以下。患者2术前计划完成后,应用3D打印机打印3D模板。术前1 d对3D打印模板进行消毒。应用放射性活度计测量粒子活度,抽查10%,如误差在5%之内,装仓消毒。
四、粒子植入
患者1采用前列腺癌标准术式植入粒子:患者连续硬膜外麻醉后取截石位,直肠B超探头与模板联合引导,经会阴部穿刺前列腺植入粒子。患者2因有冠心病病史,不能耐受全麻或连续硬膜外麻醉,故在局麻下应用3D打印模板引导粒子植入:患者俯卧位,局部麻醉后将3D打印模板固定在患者臀部皮肤,CT及3D模板联合引导,经臀部皮肤于直肠两侧穿刺前列腺植入粒子。
五、扫描SPECT/CT及图像融合分析
术后第2天应用SPECT/CT行前列腺扫描及显像,患者取仰卧位,扫描过程中避免患者移动,SPECT图像采集条件为:双探头平行采集,分别旋转 180°,10 s/帧,矩阵 128×128,放大倍数 1.0,能量水平为35.5 keV,能量窗宽30%,CT图像采集条件为:120 kV,250 mA,层间隔3.75 mm。将数据传至Xeleris图像后处理工作站进行SPECT图像与CT图像融合。观察等剂量曲线分布范围与靶区及放射性浓聚范围的关系。
六、术后验证计划
将SPECT/CT融合图像传至TPS,层间隔3.75 mm,勾画靶区、危及器官及放射性浓聚范围,识别粒子,做验证计划,得出等剂量曲线分布及剂量体积直方图(DVH),计算靶区体积。首先观察第一例患者粒子射线浓聚范围与前列腺的重合情况。调整融合图像的放射性浓聚范围与术后计划中145 Gy、217.5 Gy等剂量线范围一致。分别记录不同剂量时放射性浓聚计数值,观察此两个计数值曲线包含的靶区和危及器官的范围,计算此两种计数值放射性浓聚所包含的体积与靶体积之比。然后用以上计数值放射性浓聚范围及浓聚体积与靶体积比评价另外一位前列腺癌患者并随访。
结 果
患者1的融合图像可见前列腺周围叶有明显的放射性浓聚,术后验证计划为:D90:146 Gy,D100:102 Gy,V150:49.7% ,V100:90.7% ,V90:96.3%,靶区体积 37.4 cm3。145 Gy(100%PD)剂量线完全包绕靶区,对应的计数值约为200(图1)。此曲线包绕的体积为39.7 cm3。此体积与靶体积之比为106%,其范围累及部分直肠前壁。217.5Gy(150%PD)剂量线对应的计数值约为300(图2),范围未累及尿道和直肠,此曲线包绕的体积为21.9 cm3,此体积与靶体积之比为58%。根据AAPM137号报告评价标准,此患者150%PD对应计数值曲线内体积与靶体积之比略高于50%标准,其他参数均符合要求[2]。此患者随访4年,PSA正常,无排尿相关症状。

图1 患者1放射性浓聚计数值为200时放射性浓聚范围完全包绕前列腺,累及部分直肠前壁

图2 患者1放射性浓聚计数值为300时放射性浓聚范围未累及尿道和直肠前壁
患者 2 术后验证计划为 D90:150 Gy,D100:99 Gy,V150:51%,V100:91.7%,V90:96.4%,靶区体积34.2 cm3。此患者200等计数值曲线完全包绕靶区,累及部分直肠前壁(图3),此曲线包绕的体积为60.1 cm3,此体积与靶体积之比为176%。300等计数值曲线范围累及部分尿道(图4),曲线包绕的体积为25.2 cm3。此体积与靶体积之比为74%。患者术后3个月的PSA降至正常。无排尿排便相关症状。
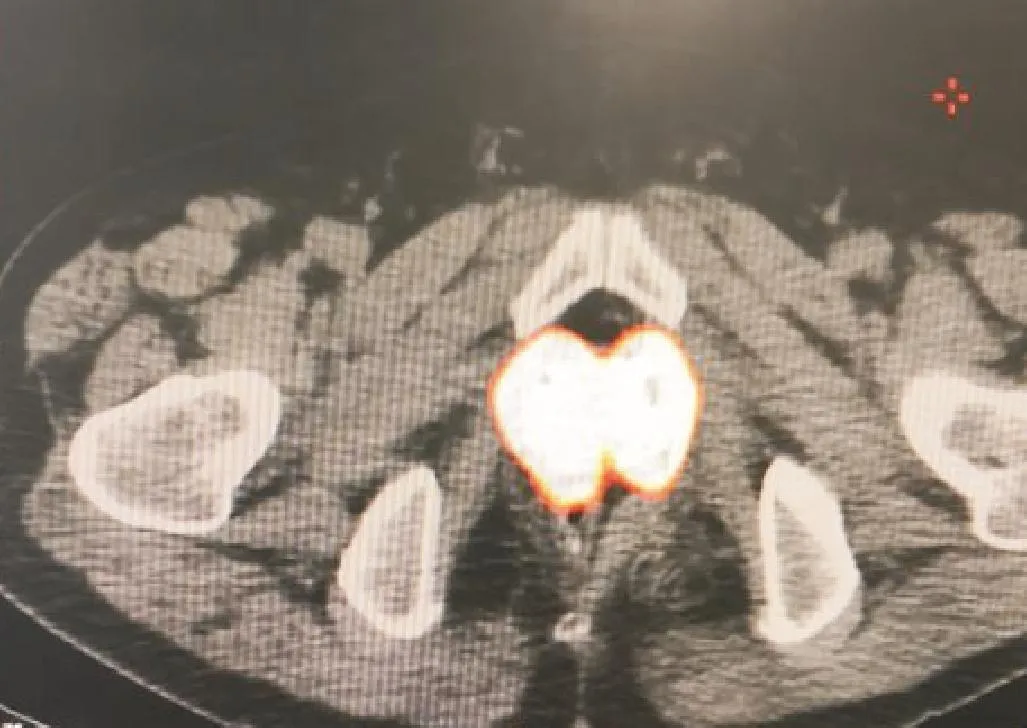
图3 患者2放射性浓聚计数值为200时放射性浓聚范围完全包绕前列腺,累及部分直肠前壁

图4 患者2放射性浓聚计数值为300时放射性浓聚范围累及部分尿道,未累计直肠前壁
讨 论
由于TPS的广泛应用,越来越多的研究证实125I粒子植入治疗早期前列腺癌长期随访疗效确切[7-8]。自从Roy等[9]将CT为基础的剂量计算应用到前列腺癌粒子植入中后,应用CT做剂量计算逐渐被广泛接受。美国近距离治疗协会规定,所有放射性粒子植入治疗的前列腺癌患者必须有术后的验证计划,以评估其剂量[5]。目前以CT为基础的术后剂量计算是验证肿瘤粒子植入术后剂量的金标准,但其只是根据粒子的活度、位置等信息计算出粒子释放多少剂量,所得到的剂量仅为计算结果。且应用CT为基础的术后剂量计算做验证计划过程相对复杂,需要手术医师及物理师同时参与,不能特别准确的识别每颗粒子。如果事先不知道植入多少颗粒子会严重影响剂量计算。如果粒子游走到远处的器官,局部CT不能发现,会造成TPS计算剂量时粒子识别人为误差加大。因此不同物理师做出的验证计划不尽相同,即使同一物理师,不同时间做出的计划也不完全一致,势必造成一定剂量上的误差。只要应用TPS验证剂量,此误差就难以避免。如果应用多种影像手段相互融合又会导致操作复杂,加重患者负担,难以实现。因实际情况限制,目前尚不能将剂量计置入人体探测粒子植入术后的实际剂量。因此计算的结果与实际的剂量分布可能存在一定误差。如何在体外应用某种方式探测粒子植入术后剂量的实际分布目前鲜有研究。

表1 两例患者靶区术前术后剂量参数对比

表2 两例患者术后不同计数值内体积与靶体积之比及对应剂量参数
SPECT/CT的γ照相机探头可以探测从患者体内发射的γ射线并对其成像。2008年Kono等[10]曾用SPECT/CT探测的方法检查125I放射性粒子植入术后患者有无粒子移位。受此启发,本课题组前期应用SPECT/CT探测125I粒子植入区域的125I粒子的γ射线能量分布,发现所植入粒子区域有明显的放射性浓聚,其浓聚范围、程度与CT示粒子分布范围、数目一致,且发现放射性浓聚程度与粒子周围剂量有一定相关性[11-12]。本实验中第一例患者计数值为200的曲线与术后计划中145 Gy剂量线范围基本一致,此体积与靶体积之比为106%,达到了AAPM137号报告中至少接受处方剂量照射的临床靶区(CTV)比例要>95%的要求。根据此结果观察第二例患者,发现200计数值曲线完全包绕前列腺,范围稍大于其145 Gy等剂量线范围,临床随访结果证实第二例患者术后PSA逐渐降至正常。提示前列腺癌粒子植入术后如果应用SPECT/CT做剂量验证,计数值为200的曲线如果完全包绕靶区可能会有较好的疗效。第一例患者中217.5 Gy(150%PD)剂量线对应的计数值约为300,范围未累及尿道和直肠,此体积与靶体积之比为58%。长期随访患者无直肠及尿道并发症,考虑直肠和尿道能耐受小于300计数值代表的剂量。对于第二例患者,300计数值曲线略大于217.5 Gy等剂量线范围,部分累及尿道和直肠,随访3个月未发现直肠及尿道并发症表现。提示直肠和尿道能耐受稍高于300计数值的剂量,但上线为多少尚需进一步研究。对于前列腺癌粒子植入术后剂量评价,200计数值曲线如果完全包绕靶区,可能会有较好疗效,300计数值曲线如果未累及直肠和尿道可能不会出现明显并发症。
应用SPECT/CT做粒子植入术后的剂量验证有明显优势。体外无创探测射线并成像,对患者无损伤。只需一位技术人员即可,放射性浓聚图像与CT图像自动融合,简单易行,不存在粒子识别问题,无人为剂量误差。因为其探测的是实际位于靶区内粒子的剂量,是否预知粒子植入数目及粒子是否游走至其他部位对结果无影响。射线探测让剂量可视化,易于理解,放射性浓聚计数值达到标准的部位剂量充足,放射性浓聚未达标的部位剂量不足,如果在靶区内则需要补充植入粒子。因本文仅为初步临床研究,尚不能得出放射性浓聚程度与肿瘤吸收剂量的准确关系。且随着粒子植入体内的深度增加,能够被SPECT/CT探测到的射线会减少,因此深部肿瘤与浅表肿瘤放射性浓聚与剂量关系会有不同。本团队正在进行相关放射物理学、放射剂量学基础研究,希望将来能找到计数值与剂量之间的确切关系,让SPECT/CT为基础的剂量探测成为放射性粒子植入术后一种客观、准确的剂量验证方法。
