块菌菌根土壤产酸性几丁质酶放线菌Streptomyces omiyaensis SCPW03的筛选及其几丁质酶酶学性质研究
2019-11-14王田田马沁沁苗玉志
王田田,马沁沁,苗玉志 ,周 霞
(四川师范大学生命科学学院,四川 成都 610101)
【研究意义】几丁质来源非常丰富,是自然界中仅次于纤维素的第二大类生物高聚物[1-2],由于其分解非常缓慢而大量堆积造成环境严重污染[3]。几丁质酶能高效降解几丁质,其降解的小分子几丁寡糖在食品保健、医药、饲料添加剂等方面具有广阔的应用前景,因而有关几丁质酶及其产酶微生物的研究非常活跃[4-5]。传统上,几丁质降解的研究主要集中在基于温和条件及减少污染的酶催化降解方法的开发,在这些研究中,常常需要对几丁质原料采用酸或碱预处理,这需要后续发酵降解所需微生物酶能够在酸性或碱性条件下发挥催化作用,在以往报道的微生物中所产几丁质酶以中性居多[6],近来分离得到了产碱性几丁质酶的微生物[7],而产酸性几丁质酶微生物的研究报道极少[8],加之现有微生物的酶学性质仍不能满足工农业应用的需要[9],因此提高几丁质酶的产酶水平和性能已成为该领域研究的热点[10-11]。【前人研究进展】迄今,已有许多几丁质酶的相关报道[12-13],而在产几丁质酶放线菌的研究中,由于放线菌所产几丁质酶具有独特的酶学特征,表现出对热、pH较强的稳定性,但这些酶基本上为中性几丁质酶[14],所以开展高产酸性几丁质酶放线菌的研究具有重要的现实意义。大量研究表明,放线菌广泛分布于不同的土壤生态环境中[15],它们通过产生各种酶高效调节土壤中有机质的分解或合成,改善土壤肥力,促进植物生长[16-18]。【本研究切入点】块菌(Tuberspp.)作为典型的地下外生菌根真菌,同微生物及植物间相互作用、协同共生,具有重要的生态作用,其偏酸性的菌根土壤中丰富的几丁质是块菌生长所需的重要多糖类营养源之一,它们被特定功能的微生物降解后释放单糖物质并促进块菌的生长[19]。此外,在该环境中生活的微生物为适应这种特定生境,必然具备相应的催化活性的酶系,因而块菌根际土壤中富含大量产几丁质酶的放线菌[20-22]。迄今,虽然有关块菌菌根土壤微生物及其功能研究不断有新发现,但极少针对块菌菌根土壤特定功能放线菌多样性的研究。【拟解决的关键问题】本研究从我国西南块菌自然产区特定生境菌根土壤中分离筛选高产酸性几丁质酶的放线菌并鉴定,对菌株的酶学性质进行研究,旨在获得具有特定酶学性质的酸性几丁质酶的放线菌,为几丁质酶的工业化应用提供微生物资源。
1 材料与方法
1.1 材料
1.1.1 样品来源 土壤样本采集于四川攀枝花地区印度块菌自然产区具有代表性的3个生态位点的菌塘(26°35′02N/101°66′76E,26°38′96N/101°67′01E,26°62′66N/101°51′44E)。在每个位点,用无菌小铲于5~8 cm处取约200 g菌根土壤样品混合均匀作为土样,存放于无菌样品袋带回实验室贮藏备用。
1.1.2 培养基 ①放线菌分离培养基(g/L):可溶性淀粉 20、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01、K2HPO40.5、NaCl 0.5、KNO31.0、琼脂15,补充50 mg/L的制霉菌素和50 mg/L萘啶酮酸抑制真菌和其他细菌的生长;②几丁质酶产生菌筛选培养基(g/L):胶体几丁质 12.5、蛋白胨 2、K2HPO40.5、KNO31、NaCl 0.5、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01、琼脂 15.0;③种子培养基(g/L):可溶性淀粉20,K2HPO40.5,KNO31.0,NaCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01;④发酵培养基:粉状几丁质 12.5、蛋白胨 2、K2HPO40.5、KNO31、NaCl 0.5、MgSO4·7H2O 0.5、FeSO4·7H2O 0.01。
1.1.3 主要试剂及仪器TaqDNA 聚合酶和DNA marker:上海英俊生物公司;细菌DNA提取试剂盒:天根生物公司;细粉几丁质:成都康迪生物公司;N-乙酰-D-氨基葡萄糖和大豆粉:博奥维新试剂公司;其他试剂均为国产分析纯。恒温培养箱(THZ-300):上海恒科仪器有限公司;自动压力蒸汽灭菌器(G154DW):厦门致微仪器有限公司;7200型可见分光光度计:上海尼龙柯仪器有限公司;梯度热循环PCR扩增仪:德国耶拿公司;凝胶成像系统:Bio-RAD公司。
1.2 产酸性几丁质酶放线菌的分离和鉴定
1.2.1 产几丁质酶放线菌的分离 取约1.0 g样本土壤用无菌水适度稀释后分别涂布于放线菌分离平板28 ℃培养5 d,挑取单个菌落进行菌株相似性初筛后,涂布几丁质酶产生菌分离平板,于28 ℃培养72 h,挑选透明圈明显的单个菌落分别接入液体筛选培养基,于28 ℃下180 r/min恒温振荡培养发酵72 h,结束后测定发酵液的酶活力。
酶活力测定参考Imoto方法[23]进行:取5 mL发酵液于3000 r/min离心10 min,取上清液1.0 mL加入用磷酸缓冲液(pH 7.0)配制的1.0 %胶体几丁质溶液1 mL,30 ℃水浴30 min,加DNS试剂2.0 mL,沸水浴10 min,迅速冷却至室温,测定OD540,根据N-乙酰-D-氨基葡萄糖标准曲线计算酶活力。酶活单位定义(U):在标准条件下,1 min催化产生相当于1 μmol的N-乙酰-D-氨基葡萄糖的还原糖所需的酶量。
1.2.2 产酸性几丁质酶放线菌的筛选 为获得产酸性几丁质酶的放线菌,在40 ℃条件下,分别测定去重复后的各菌株在pH 2.0~6.0的柠檬酸-柠檬酸钠缓冲液中几丁质酶活力,以酶活力最高者为100 %,计算各菌株在酸性条件下的相对酶活力,获取产酸性几丁质酶菌株。
1.2.3 产酸性酶菌株的16S rDNA鉴定 菌株的16S rDNA基因组采用试剂盒提取;PCR扩增采用通用引物27F(AGAGTTTGATCMTGGCTCAG)和1492R(TACGGYTACCTTGTTACGACTT),扩增体系为:10×Buffer 2.5 μl,模板DNA 1 μl,Taq酶(5 U/μl) 0.2 μl,dNTPs (2.5 mmol/μl) 2 μl,引物 (10 pmol/μl)各1 μl,补水至25 μl。反应条件为:94 ℃ 5 min,94 ℃ 30 s,48 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。将扩增得到的16S rDNA 片段用0.8 %琼脂糖凝胶电泳分离,送成都擎科生物公司测序,所得序列通过GenBank进行BLAST比对,选取参比菌株用MEGA6.0构建系统发育树,通过NCBI获取序列登录号。
1.3 酶学性质研究
1.3.1 几丁质酶的SDS-PAGE检测 几丁质酶的纯化及检测参照张新军等[24]的方法稍作修改:吸取1 mL 3 %胶体几丁质加入到1.5 mL离心管中,8000 r/min 离心5 min,弃上清液,加入几丁质酶发酵上清液1 mL,将胶体几丁质沉淀重悬,于30 ℃恒温10 min(让几丁质酶充分吸附于胶体几丁质颗粒表面),8000 r/min 离心5 min,弃上清液,沉淀用蒸馏水重悬,放入30 ℃恒温培养箱,温育 72 h,让几丁质酶把胶体几丁质充分降解,然后12 000 r/min离心5 min 除去未被降解的杂质,即为待测几丁质酶样品,该样品采用SDS-PAGE电泳检测其大小。
1.3.2 初始pH和温度对酶活力的影响 分别将200 μl纯化几丁质酶液与800 μl不同pH值(pH 3~10)的缓冲液混匀, 在不同温度 (35~80 ℃,间隔5 ℃)条件下测酶活力,以酶活力最高者为100 %,计算不同pH、不同温度条件下的相对酶活力,确定最适反应pH和温度。
1.3.3 金属离子对酶活力的影响 在几丁质酶与底物反应的体系中,分别添加终浓度为50 mmol/L的不同金属离子(Ag+、Cs+、Cu2+、Fe2+、Mn2+、Zn2+、Mg2+、Ca2+、K+、Na+、Al3+和Ni+),最适温度下水浴30 min测酶活力,以不加金属离子反应体系的酶活力为100 %,计算相对酶活。
1.3.4 蛋白抑制剂对酶活力影响 在反应体系中,分别加入终浓度为0.5 mol/L的蛋白抑制剂EDTA、尿素、SDS和β-巯基乙醇,最适温度下水浴30 min,分别测定各反应体系中几丁质酶活力,以不加任何抑制剂的酶活力为100 %,分别计算相对酶活力。
1.3.5 pH和热稳定性试验 将纯化几丁质酶液于pH 3~10的条件下保温60 min取样,于最适pH和温度下测定几丁质酶活力;另将酶液分别置于25、35、45、55和65 ℃的温度下保温10、20、30、40、50和60 min,然后迅速冷却至最适反应温度,在最适pH和温度下测定几丁质酶活力。以未处理的酶液酶活力为100 %,分别计算各pH和温度下几丁质酶的残存酶活力的百分比。
2 结果与分析
2.1 产酶菌株分离
采用放线菌分离培养基,从土壤样本中分离到125株放线菌,经纯化后再平板培养获得各菌株单菌落,对各菌株菌落形态和显微涂片观察,根据各菌株菌落形态和显微结构初筛去重复得到57株放线菌,对这些菌株依次编号为SCPW01-SCPW57,经产酶筛选平板培养后测定透明圈直径,选取透明圈大于5 mm的单菌落,经纯化培养后摇瓶发酵,测定几丁质酶活力,得到17株产几丁质酶活力相对较高的放线菌菌株,结果见图1。
由图1可知,包括有SCPW01、SCPW03、SCPW19、SCPW20、SCPW50和SCPW55等在内的部分菌株的透明圈直径和几丁质酶活呈正相关性,透明圈直径越大几丁质酶活力越高;但是SCPW02、 SCPW10、SCPW30、SCPW39、SCPW49和SCPW54等菌株的透明圈直径和几丁质酶活相关性极小。另外,获得了一些初酶活力相对较高的菌株,如编号为SCPW03的菌株酶活力为30.2 U/mL,菌株SCPW30酶活力为19.1 U/mL。
2.2 产酸性几丁质酶菌株筛选
对17株产几丁质酶的放线菌所产酶酶活采用不同pH缓冲液(pH 2、pH 3、 pH 4、 pH 5和pH 6)处理,酶活测定结果见图2。由图2可知,菌株SCPW31、SCPW49、SCPW53和SCPW54在pH 2~6内均没有活性;菌株SCPW01、SCPW10、SCPW17、SCPW30和SCPW55在pH 2~4没有活性,而在范围pH 5~6内表现出轻微的催化活性,且随pH值增加催化活性逐渐增强;菌株SCPW34和SCPW39在pH值为 5~6范围内有48.1 %~85.2 %的活性外,其它菌株SCPW02、SCPW03、SCPW19、 SCPW20、SCPW38和SCPW50在pH 2~6的范围内都表现出相对较强的酶活性。因此,通过试验共获得了8株酸性几丁质酶产生菌,并对其进行了分子鉴定。此外,我们发现菌株SCPW03所产几丁质酶在pH 3~4范围内催化活性极高,超过95.4 %,而在pH 2的酸性条件下相对酶活性也大于75 %,表明该酶在极低酸值环境条件下能够充分保持其酶活性,为嗜酸几丁质酶。因而拟对该菌株进行了酶学性质研究。
2.3 产酸性几丁质酶菌株的鉴定
对8株产酸性几丁质酶菌株进行16S rDNA基因测序,测序结果同NCBI中的核酸序列比对并进行序列相似度分析,8株放线菌同GenBank数据库中相似性最高的菌株的相似性在97 %~100 %,其中相似度低于98 %的有2株菌,相似度在98 %~100 %的有4株,1株菌的相似度为100 %,但没有相似度低于97 %的菌株获得,基因序列登录NCBI获得登录号(表1)。

图1 产几丁质酶菌株的筛选结果Fig.1 Screening of producing-chitinase strains

图2 17株菌所产几丁质酶在酸性条件下的相对酶活力Fig.2 Relative activity of chitinase from 17 strains under acidic condition
系统发育进化分析显示8株产酶放线菌产生了2个不同的分类单元,这些菌株能够被完全区分开,但所有菌株都归于链霉菌属(Streptomyces),分布于可能的8个种,表明这些菌株间存在不同的遗传多样性,也表明了一个相对较远的遗传关系(图3)。基于进化树分析,8株几丁质酶放线菌产生菌被鉴定和暂命名(表1)。
2.4 S. omiyaensis SCPW03酶学性质
2.4.1 SDS-PAG及酶谱分析 菌株S.omiyaensisSCPW03发酵粗酶液的酶谱分析(图4 Lane 1)和纯化所得几丁质酶蛋白SDS-PAGE电泳(图4 Lane 2)所示。由图4 Lane 1可知,发酵液里包含有至少5个蛋白条带, 图4 Lane 1表明该菌株至少产生并向胞外分泌5种以上不同分子质量的几丁质酶,其中部分条带在SDS-PAG凝胶上显示不是很清晰,但呈现明显条带,推测其具有较高的酶活性。这与块菌生境菌根土壤中该菌株高效降解几丁质有密切关系。经过纯化后得到优势带Lane 2,对照蛋白质 Marker可知该蛋白分子量约为54 kDa的蛋白为S.omiyaensisSCPW03分泌的优势酸性几丁质酶。
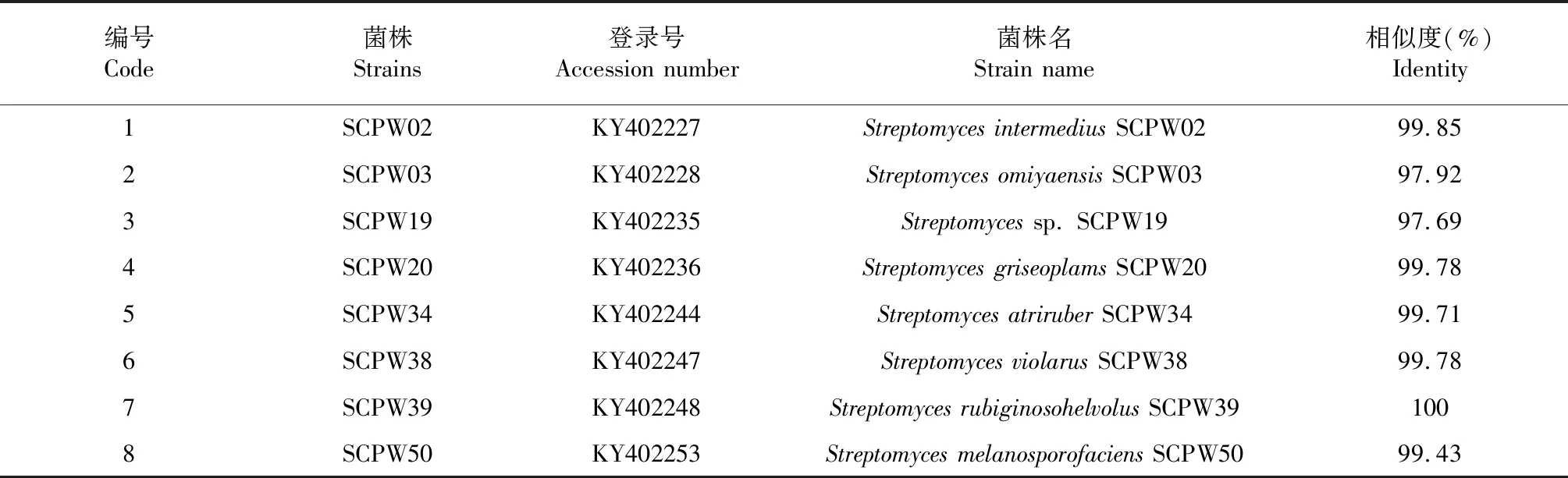
表1 8株产几丁质酶放线菌16S rRNA基因分析及亲缘关系
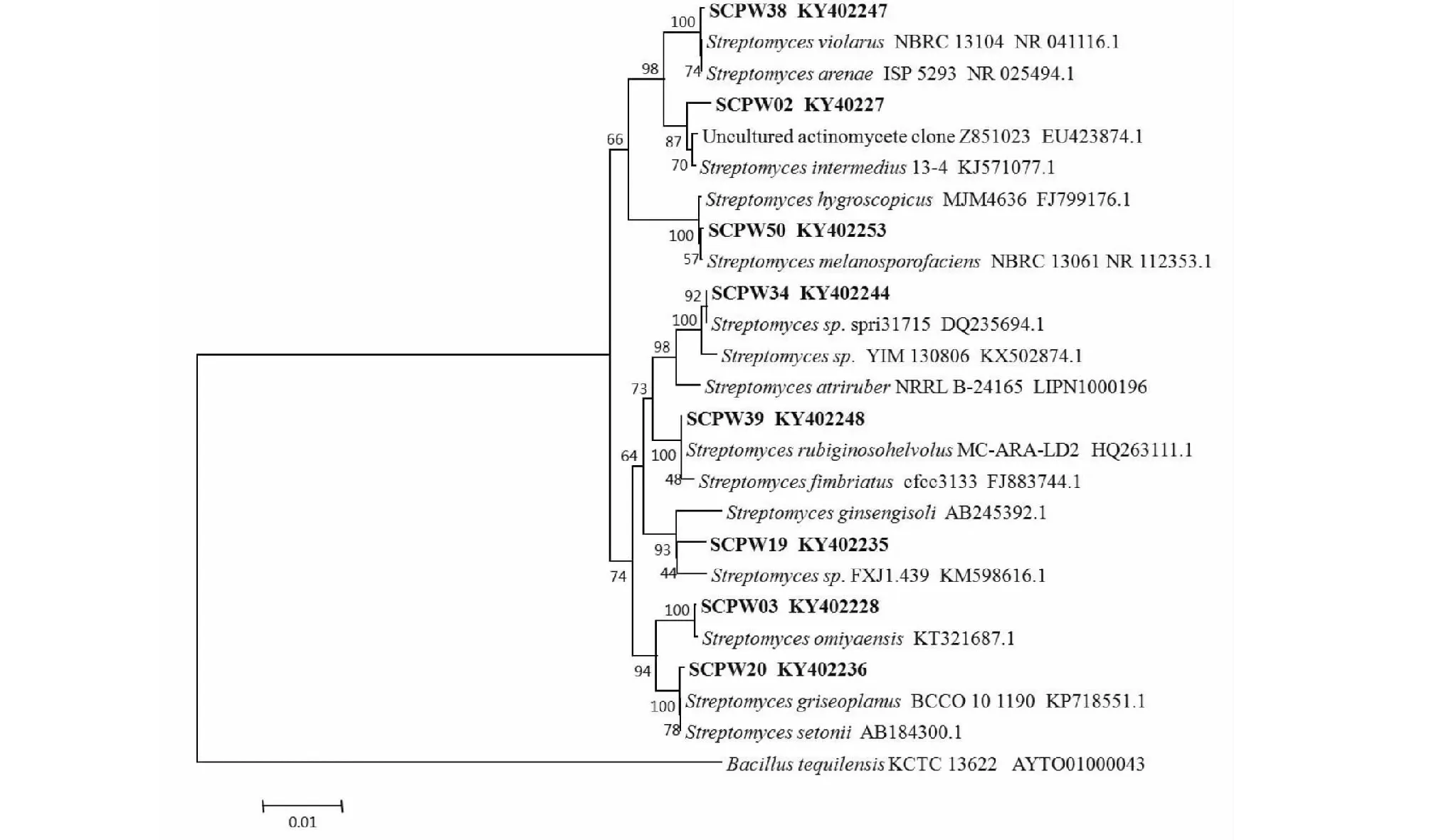
图3 基于8个菌株的16S rDNA 序列同源性的系统进化树Fig.3 Phylogenetic tree of 8 strains based on 16S rDNA sequences between the representative actinobacteria and the nearest type strains
2.4.2 pH和温度对酶活力的影响 如图5-A 所示,菌株S.omiyaensisSCPW03分泌的几丁质酶经不同pH缓冲液处理后,发现该酶在pH 3~9范围内催化活性均>70 %,而在pH 3~4时能够保持极高的酶活,相对酶活性均超过95 %,该酶具有较广泛的保持活性的pH范围,而在较低的pH条件下活性最大,再次表明该酶属于嗜酸性几丁质酶。
如图5B 所示,菌株S.omiyaensisSCPW03产生的几丁质酶在25~45 ℃的温度范围内催化活性最高(>95 %),而在45~65 °C范围内也具有较高的催化活性(>80 %)。继续升高温度酶活性明显降低,这是由于高温能够改变蛋白酶的空间结构,进而影响酶的活性。因此,菌株S.omiyaensisSCPW03具有较宽的催化温度,最适催化温度为25~45 ℃,该酶为中温酶。
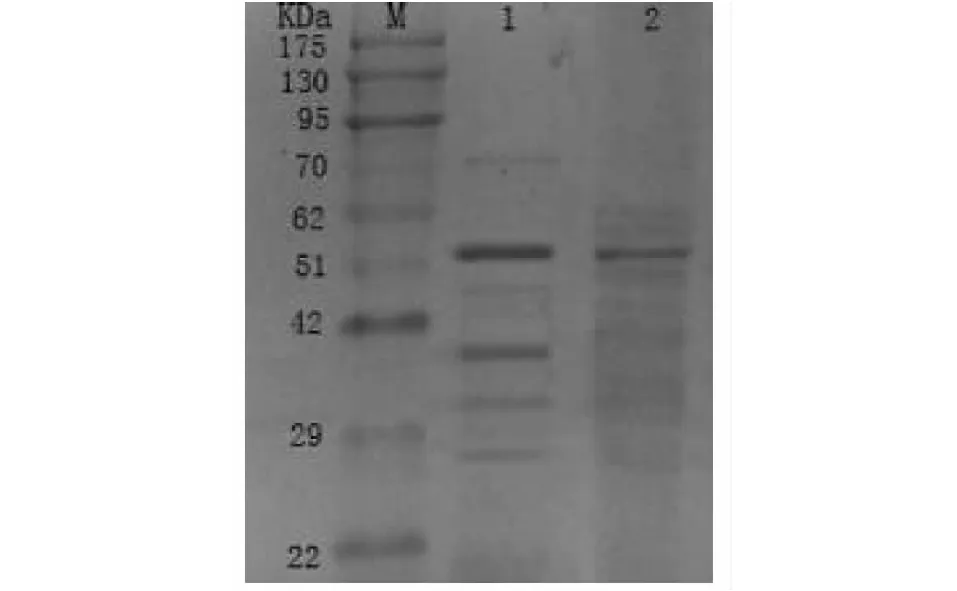
Lane 1:几丁质酶粗酶液的酶谱,Lane 2:纯化几丁质酶M: prestained protein ladder, Lane 1: the zymogram of the crude chintinase of S. omiyaensis SCPW03, lane 2: purified protein图4 菌株SCPW03产几丁质酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of chitinase from SCPW03
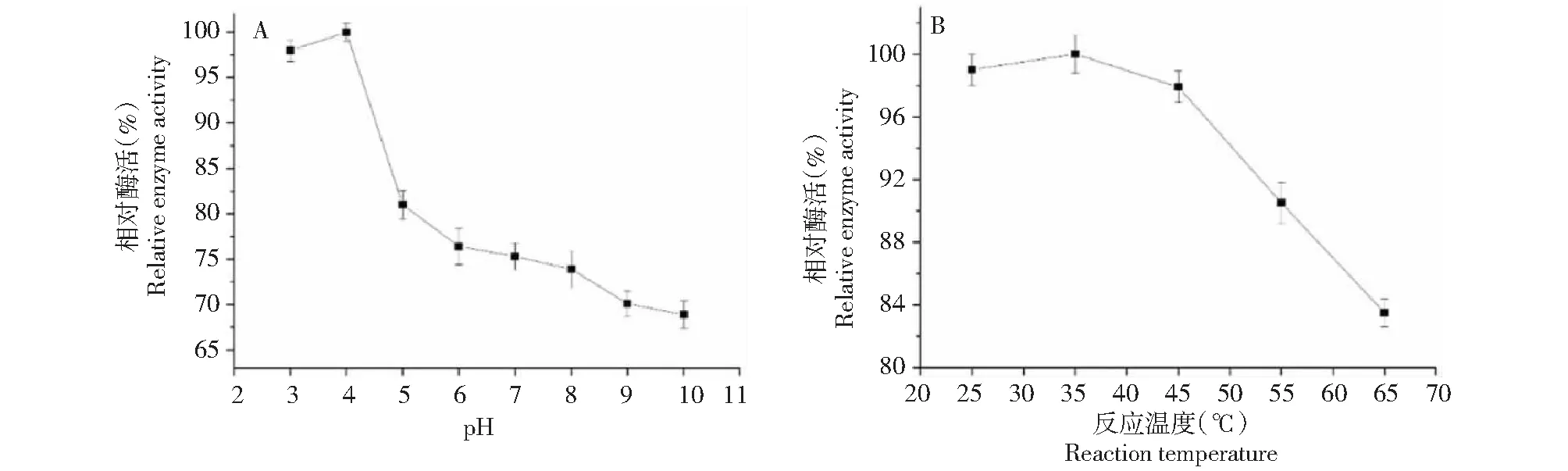
图5 pH和温度几丁质酶活力的影响Fig.5 Effect of pH and temperature on chitinase activity
2.4.3 金属离子和化学抑制剂对酶活力的影响 如图6A所示,终浓度均为50 mmol/L的Ag+,Cs+,Cu2+,Fe2+, Mn2+、Zn2+、Mg2+,Ca2+、K+、Na+、Al3+和Ni+对菌株S.omiyaensisSCPW03产生的酶活性具有明显不同的作用。其中,Ag+、Cs+、Mg2+、Al3+和Ni+对酶活力抑制作用显著(P<0.05),相对酶活性均低于45 %;而Cu2+、Zn2+、Ca2+、K+、Na+对酶活性影响较小,相对酶活性均大于85 %;Fe2+、Mn2+则能够显著促进几丁质酶活性。
化学抑制剂EDTA、SDS和β-巯基乙醇对酶活性影响较小(图6B),表明S.omiyaensisSCPW03对这些化学抑制剂具有较好的抗性;而尿素对酶活性具有一定的抑制作用,这可能是因为尿素破坏了蛋白质分子中的氢键,导致蛋白质分子结构松弛,从而使其变性。
2.4.4 酶的pH和热稳定性 将粗酶液分别于pH 3.0~10.0范围内,在35 ℃条件下保温60 min取样,于最适pH和温度条件下测定几丁质酶活力,结果表明几丁质酶在pH 6.0的偏酸性条件下最稳定,pH低于5.0或者大于7.0后酶活力迅速降低,说明该pH对几丁质酶的稳定性影响很大(图7A);热稳定性实验结果表明(图7B),25和35 ℃保温60 min,相对酶活保持在90 %以上,当温度超过45 ℃,几丁质酶活力在30 min以内其相对酶活仍然保持在90%,当超过30 min后酶活力迅速下降,可见该酶具有较宽的pH和温度作用范围。
3 讨 论
功能微生物的研究有利于人类更好地挖掘和利用微生物资源。特定生境土壤是探索和分离鉴定几丁质降解细菌最具活力的自然资源[25]。细菌几丁质酶是几丁质降解的主要因素,比如芽孢杆菌属细菌是众所周知的产高水平几丁质酶的生产者[26-27]。由于产几丁质酶放线菌潜在的生物活性,近年来得到了大量研究[ 28]。然而,很少关于产酸性几丁质放线菌的研究报道[8]。
当前研究从攀枝花地区块菌菌根土壤中分离到8株产酸性几丁质酶放线菌,其酶产量范围为5.5~30.0 U/mL,这一结果相比来源于其它大多数野生型细菌和真菌所产几丁质酶要高,比如Conidioboluscoronatus(0.26 U/mL)[29]、Streptomycessp. (0.27 U/mL)[30]和Bacillussp. (2.24 U/mL)[31])、Verticilliumlecanii(18.2 mU/mL)[32]、Lecanicilliummuscarium(0.243 U/mL)[33]、Paenibacillussp. (11.86 U/mL)[34]。由于攀枝花地区块菌生境菌根土壤为偏酸性土壤,而来源于块菌菌根土壤的放线菌可能与块菌的生长密切相关,因而从菌株筛选结果来看攀枝花地区块菌菌根土壤是分离产酸性几丁质酶放线菌的理想之地。
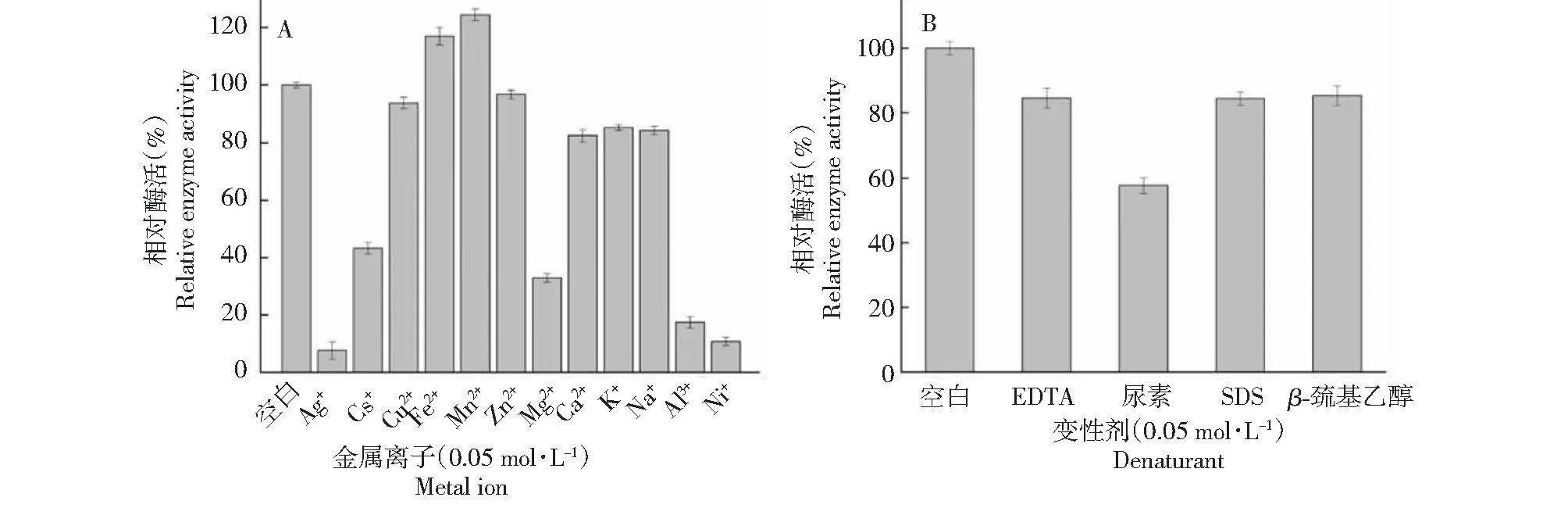
图6 金属离子和蛋白抑制剂对酶催化活性的影响Fig.6 Effect of metal ions and protein inhibitor on chitinase activity

图7 pH(A)和温度(B)对几丁质酶的稳定性影响Fig.7 Effect of pH and temperature on stability of chitinase
通过对高产酸性几丁质酶菌株S.omiyaensisSCPW03的酶学性质研究表明,该菌所产几丁质酶蛋白纯化后的分子大小为54.0 kDa,其大小明显低于其它细菌所产几丁质酶蛋白(70.0、74.0 kDa)[35-36],但是关于该菌所产酸性几丁质酶的基因及其表达后蛋白性质还需要进一步研究。菌株S.omiyaensisSCPW03所产酶对不同金属离子表现出明显不同的作用,其中,Ag+、Cs+、Mg2+、Al3+和Ni+对酶活力抑制作用显著,相对酶活性均低于45 %;而Cu2+、Zn2+、Ca2+、K+、Na+对酶活性影响较小;Fe2+、Mn2+能够显著提高其活性。化学抑制剂EDTA、SDS和β-巯基乙醇对酶活性影响较小,而尿素对酶活性具有一定的抑制作用,这可能是因为尿素破坏了蛋白质分子中的氢键,导致蛋白质分子结构松弛,从而使其变性。
S.omiyaensisSCPW03所产几丁质酶的最佳活性pH值范围为3.0~4.0,该数值比已经报道的来源于Paenibacillussp. D1的酸性几丁质酶(pH 5.0)要低[37],接近于Microbisporasp. V2(pH 3.0)[38],表明该菌株所产酶是嗜酸几丁质酶。菌株S.omiyaensisSCPW03所产几丁质酶的最佳活性pH是6.0,具有较宽的pH稳定范围为4.0~9.0,这和其它酸性几丁质的pH稳定性相近[8]。该菌株所产几丁质酶的最佳活性温度范围为25~45 ℃,最佳温度为35 ℃,该温度明显低于Pseudomonassp. TKU015 (60 ℃)[39]和BacilluscereusIO8 (65 ℃)[40],低温更加有利于工业发酵;对热稳定性表明在低于65 ℃下持续30 min都较稳定。
4 结 论
本研究从四川攀枝花块菌菌根土壤中共分离到17株产几丁质酶放线菌,通过在pH 2.0~6.0的酸性条件下的酶活力检测,得到8株产酸性几丁质酶放线菌。基于16S rDNA基因测序鉴定表明8株菌均为链霉菌属的8个种,并对其命名。从中筛选出一株产酶量最高的S.omiyaensisSCPW03菌株进行酶学性质分析,该菌株所产几丁质酶的分子量约为54 kDa;酶活最适反应温度为35 ℃,在25~65 °C的温度范围内具有较高的催化活性;最适反应pH为4.0,该酶具有较宽的pH稳定作用范围(pH 3.0~9.0);金属离子Cu2+、Zn2+、Ca2+、K+、Na+及化学抑制剂EDTA、SDS和β-巯基乙醇对酶活性影响较小,而Fe2+、Mn2+则能显著促进几丁质酶活性,表明该酶对化学抑制剂较好的抵抗力。该菌所产酸性酶具有较多的优良特征及较高的产量。今后可进一步采用基因工程技术克隆该酸性几丁质酶基因,构建基因工程菌实现几丁质酶的高效表达,提高几丁质酶活力,为工业化生产打下基础。
