阿帕替尼治疗化疗失败的转移性结直肠癌近期疗效及预后分析
2019-11-14
结直肠癌是常见的消化道肿瘤之一,在中国结直肠癌发病率分别占男性和女性肿瘤的第5位和第4位,死亡率均为第5位[1]。化疗是转移性结直肠癌最主要治疗手段,但几乎所有患者均面临化疗失败及进展后的二线甚至三线治疗,治疗效果及生存期不理想。近年随着靶向治疗的发展,无论是一线治疗、维持治疗还是疾病进展后的治疗,临床试验均证实在化疗基础上联合抗血管靶向治疗可以提高患者的总生存期[2-3]。
甲磺酸阿帕替尼片是口服小分子抗血管生成抑制剂,主要通过高度选择性地抑制血管内皮生长因子受体(vascular endothelial growth factor,VEGF)-2酪氨酸激酶的活性,阻断血管内皮生长因子与其受体结合后的信号转导通路,从而抑制肿瘤血管生成,发挥抗肿瘤作用。阿帕替尼作为国家Ⅱ类新药上市,用于晚期胃癌或胃食管结合部腺癌三线及三线以上治疗。本研究对23例经化疗失败的转移性结直肠癌患者应用阿帕替尼的疗效进行分析。
1 材料与方法
1.1 病例资料
选取2016年1月至2017年12月在唐山市人民医院接受治疗的23例经化疗失败的转移性结直肠癌患者。所有患者均经肠镜或手术病理证实,其中男性13例,女性10例;年龄45~79岁,中位年龄64岁;结肠癌11例,直肠癌12例;16例患者为单药阿帕替尼治疗,7例口服阿帕替尼同时给予联合化疗。患者病例资料见表1。
1.2 方法
1.2.1 靶向治疗方案 23例患者给予阿帕替尼为主的综合治疗,其中7例口服阿帕替尼,剂量为250 mg/d,同时接受化疗,方案为:XELOX方案1例,FOLFOX6 2例,FOLFIRI 3例,同期口服S1 1例。16例单药口服阿帕替尼治疗剂量为250~500 mg,口服阿帕替尼治疗直至疾病进展或不良反应不能耐受为止。
1.2.2 疗效评价 治疗后初始3个月每个月行CT检查评价疗效,3个月以后每3个月应用CT检查评价疗效,评估阿帕替尼治疗的有效性及不良反应。按WHO实体瘤近期疗效评价标准评估疗效,按照CTCAEV4.0评价不良反应[4]。
1.2.3 观察主要终点 疾病无进展生存时间(progression-free survival,PFS)是指患者从接受治疗开始,至疾病进展或者因任何原因导致死亡的时间。次要终点为总生存期(overall survival,OS)为从病理确诊日期开始至患者出现死亡或末次随访日期。
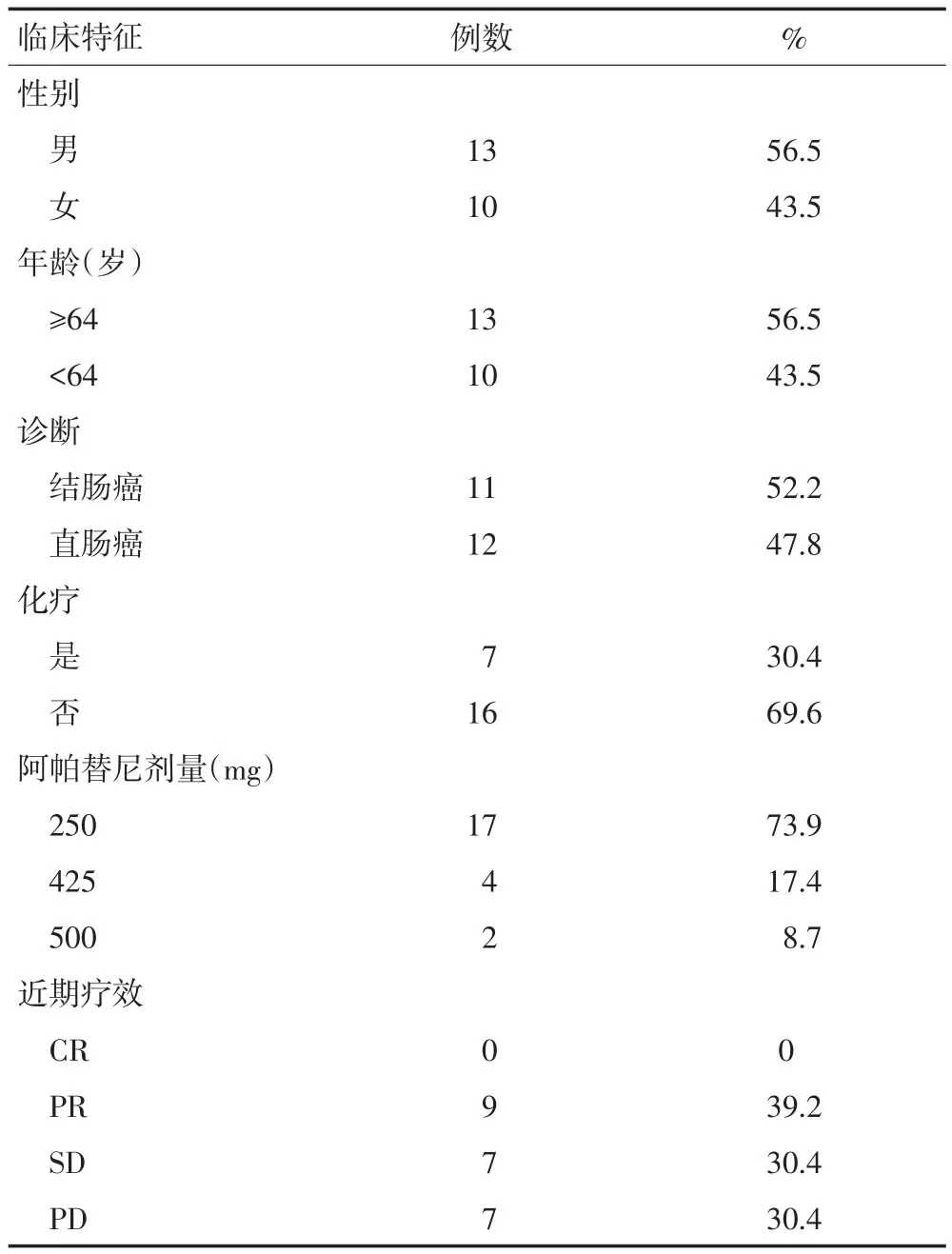
表1 23例转移性结直肠癌患者病例资料
1.3 统计学方法
采用SPSS 25.0软件进行统计学分析,Kaplan-Meier法进行生存分析,Log-rank法进行单因素分析,Cox回归模型进行多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 随访结果
全组患者采用电话、门诊复查或住院治疗观察等方式随访。截至2018年4月,全组随访时间为4~69个月,随访率为100%,11例(47.8%)患者死亡,中位随访时间为20个月。
2.2 近期疗效
所有患者中,无完全缓解(complete response,CR),部分缓解(partial response,PR)9例,病情稳定(stabledisease,SD)7例,疾病进展(progressive disease,PD)7例,客观缓解率(overall response rate,ORR)为39.13%,疾病控制率(disease control rate,DCR)为69.56%,PFS为1~19.0个月,中位PFS为5.0个月。单药阿帕替尼组无CR,PR 5例,SD 5例,PD 6例,ORR为31.25%,DCR为62.50%,中位PFS为4.5个月。阿帕替尼联合化疗组无CR,PR 4例,SD 2例,PD 1例,ORR为57.10%,DCR为85.70%,中位PFS为12.0个月。
2.3 预后分析
2.3.1 Log-Rank单因素分析 分析结果显示同步化疗、阿帕替尼剂量、LDH升高、低蛋白血症及疗效评价与PFS相关(均P<0.05;图1~5,表2)。同步化疗、阿帕替尼剂量、血红蛋白降低、CD4+淋巴细胞下降及疗效与OS相关(均P<0.05,表3)。
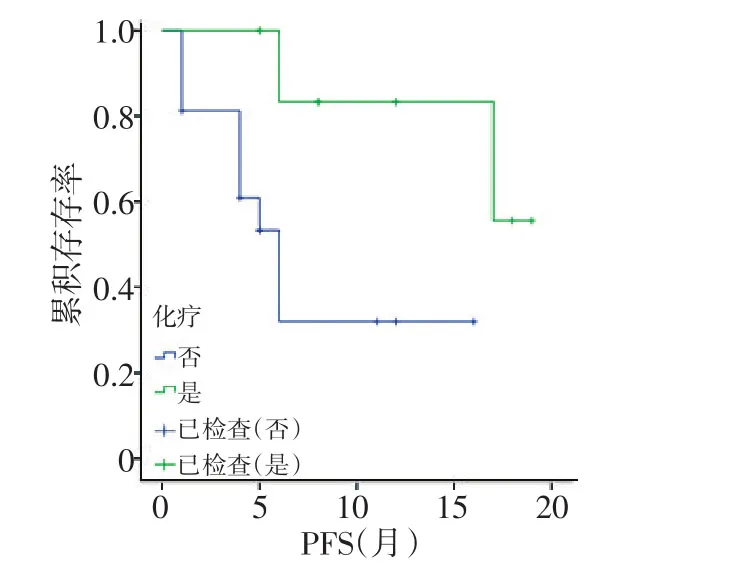
图1 阿帕替尼是否联合化疗对PFS影响的生存曲线
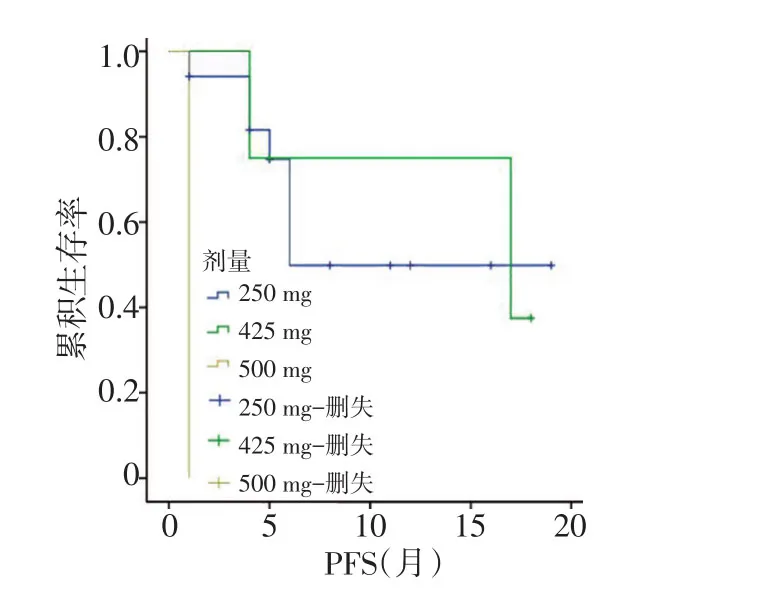
图2 阿帕替尼剂量对PFS影响的生存曲线
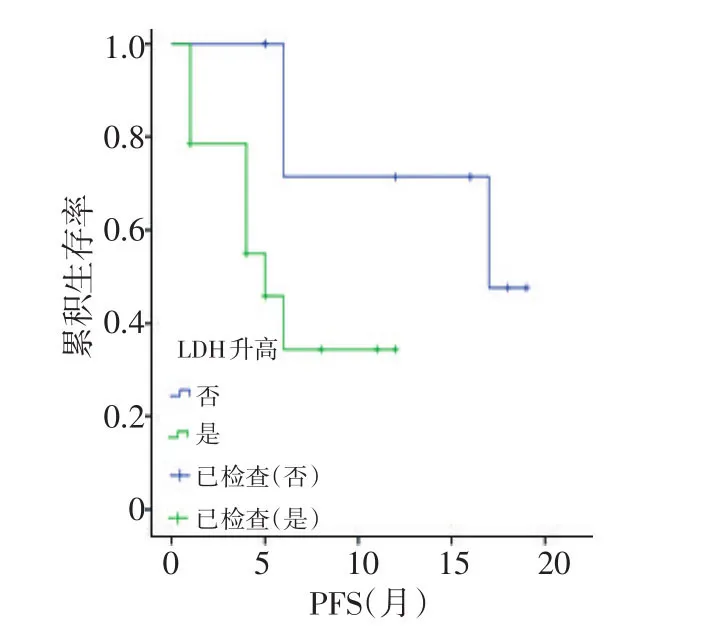
图3 LDH升高对PFS影响的生存曲线
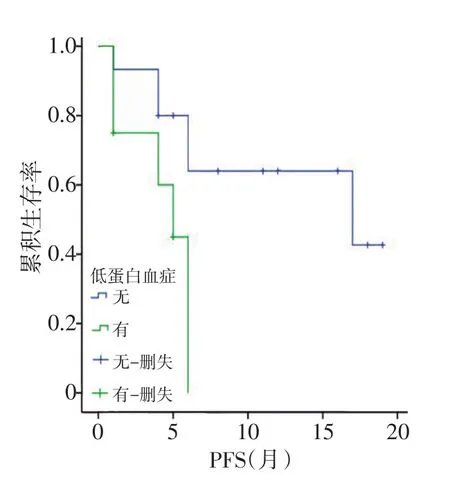
图4 低蛋白血症对PFS影响的生存曲线
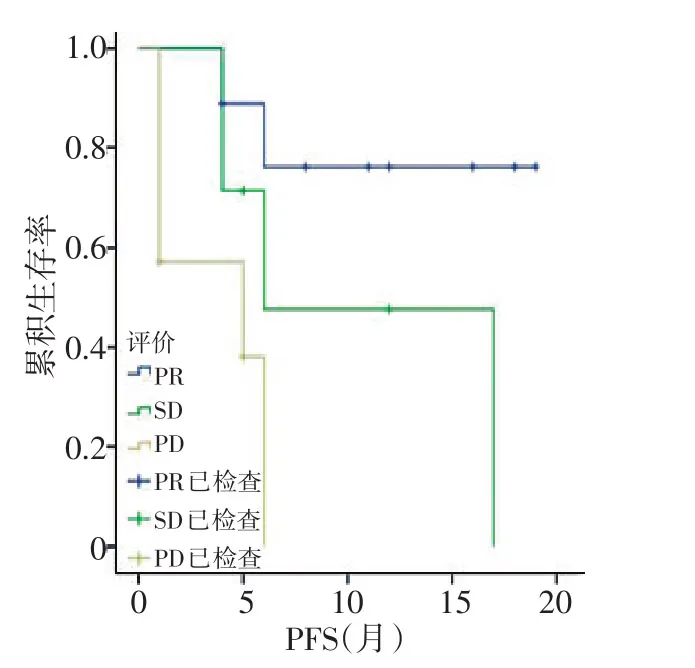
图5 疗效评价对PFS影响的生存曲线
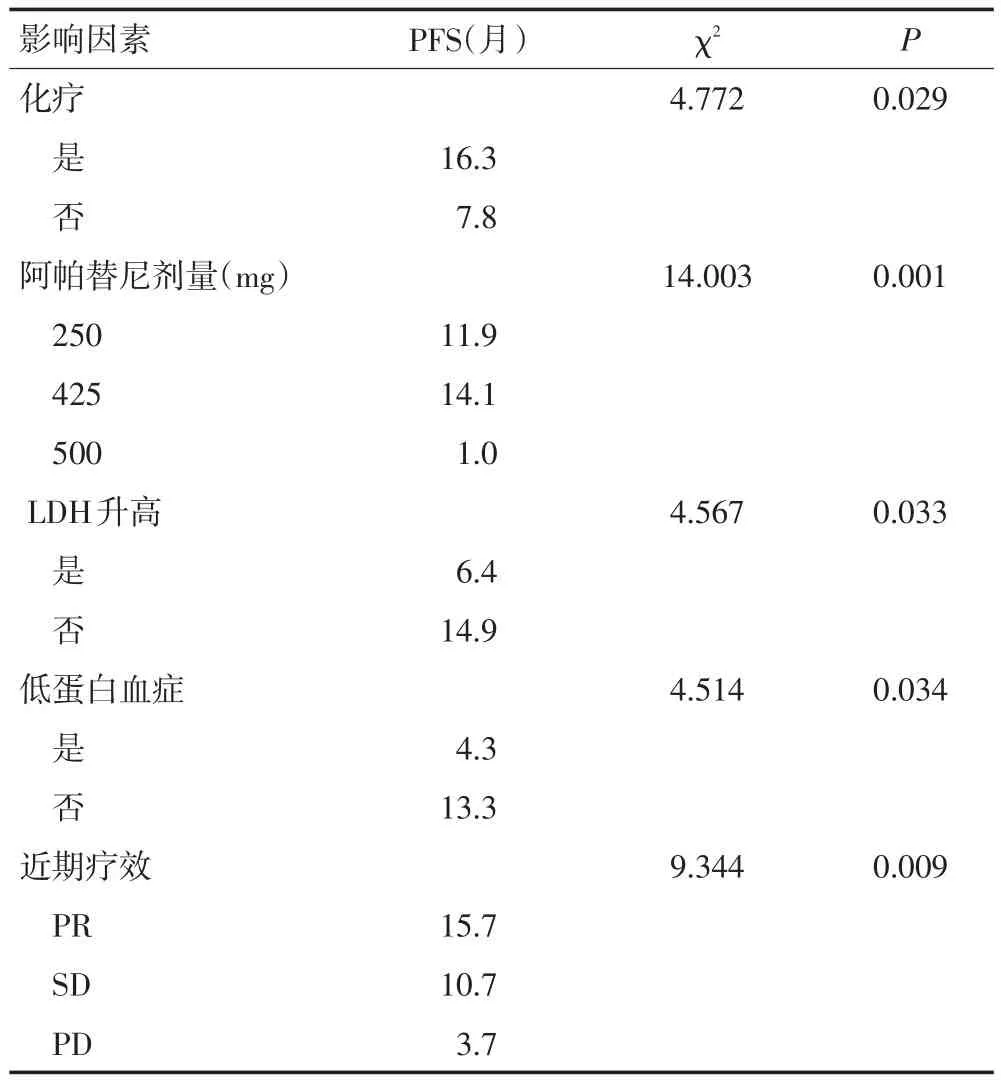
表2 23例转移性结直肠癌患者PFS的单因素分析结果
2.3.2 多因素分析 分析结果显示LDH升高为PFS的独立影响因素(P=0.004,OR=0.742,95%CI:0.065~0.910)。相关因素与OS差异无统计学意义(P>0.05)。
2.3.3 生存率 全组患者的中位OS为19.4个月,全组1、2、3年生存率分别为63.4%、33.8%、18.6%(图6)。
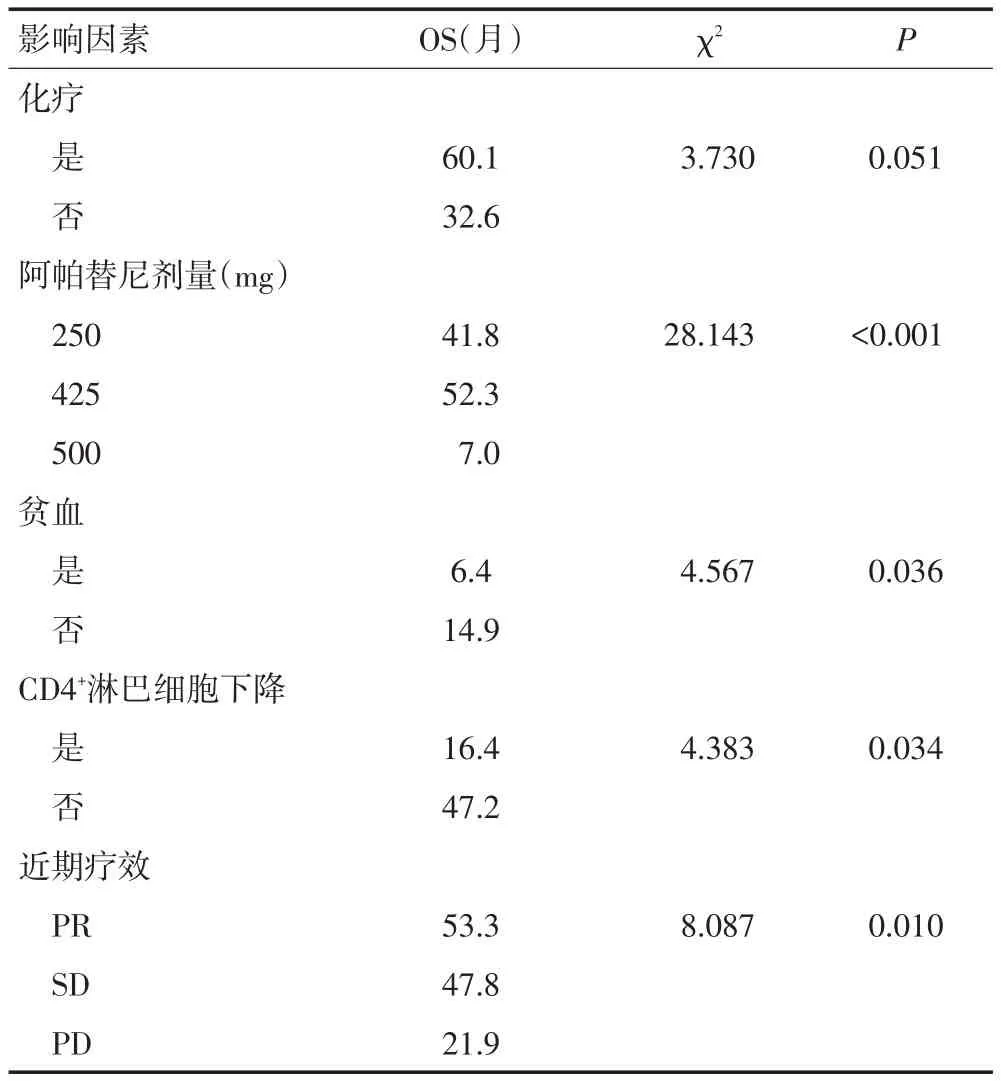
表3 23例转移性结直肠癌患者OS的单因素分析结果
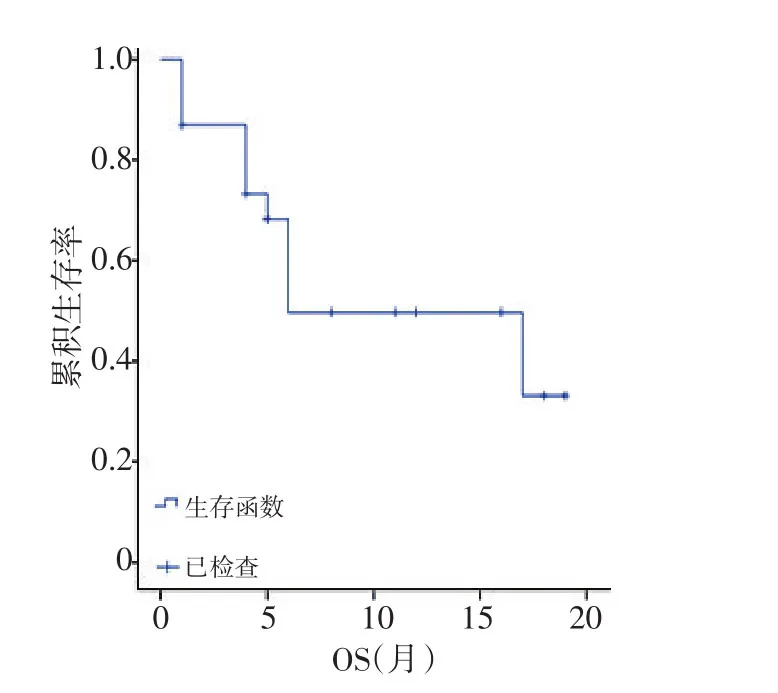
图6 全组患者的OS生存曲线
2.3.4 不良反应 两组患者不良反应以轻度高血压、蛋白尿、手足综合征为主,差异无统计学意义(P=0.618,0.696,0.275,表4)。
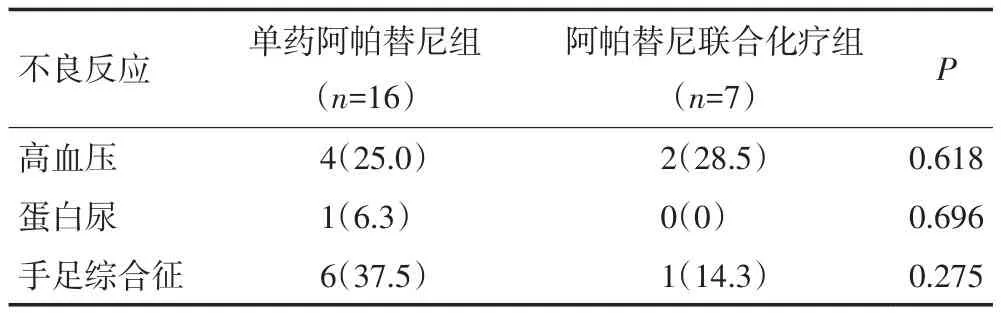
表4 23例转移性结直肠癌患者不良反应
3 讨论
临床上对于无手术指征的一、二线化疗失败的转移性结直肠癌患者,化疗联合抗血管治疗已成为近年研究热点。新生血管不仅为肿瘤提供营养和氧气,更是肿瘤细胞进入系统循环和转移的通路。当实体肿瘤直径>2 mm时需诱导新的血管生成以获取血供,否则肿瘤细胞将会因缺血、缺氧而坏死。阿帕替尼是一种口服小分子抗血管生成药物,可以通过减少肿瘤微血管密度,促进细胞凋亡,从而发挥抗肿瘤作用[5-6]。研究表明,阿帕替尼一定程度上可以通过阻断多腺苷三磷酸结合盒转运蛋白的功能,逆转化疗耐药性[7],并对多种实体瘤有效[8]。
贝伐珠单抗在结直肠癌中作为最常用的抗血管内皮生长因子受体单克隆抗体,与氟尿嘧啶等联合应用于治疗进展期结直肠癌,改善晚期结直肠癌患者的生存。SWOG-80405研究显示对于KRAS野生型的晚期结直肠癌患者,化疗联合贝伐珠单抗将患者OS延长至29个月,PFS延长近11个月[9]。临床前研究显示,阿帕替尼对人结直肠癌的抑瘤率为40%~81.2%,与氟尿嘧啶、奥沙利铂联合治疗抑瘤率分别为60.1%、58.6%,且药效随剂量的增加而提高[10]。在Ⅲ期临床研究中,273例二线及以上化疗失败后的晚期胃癌或胃食管结合部腺癌患者随机分入安慰剂对照组和阿帕替尼组,阿帕替尼组的中位OS为6.5个月,较对照组延长了1.8个月(P=0.014 9),死亡风险降低约30%[11]。本研究显示阿帕替尼联合全身化疗相比单独应用阿帕替尼能够得到更好的PFS,且阿帕替尼选择的初始剂量与DFS相关,250、425、500 mg剂量组中位PFS分别为11.9、14.1、1.0个月。分析原因,本研究入组患者均为多线多周期化疗失败者,ECOG评分较高,身体耐受性变差,大剂量靶向及化疗药物无法耐受。一项阿帕替尼在结直肠癌治疗中的Ⅱ期临床研究推荐剂量为500 mg[12],本研究结果显示425 mg剂量组PFS较长且安全性良好,250 mg及500 mg组疗效稍差,故推荐阿帕替尼临床使用剂量为425 mg。对于阿帕替尼治疗转移性结直肠癌患者,前期的治疗分层及筛选存在混杂偏倚,本研究显示LDH升高是PFS的独立影响因素,对于晚期结直肠癌,高水平LDH反映肿瘤负荷大,提示预后较差,可能对肿瘤的疗效和预后的判断具有重要意义。有研究表明,肿瘤负荷是评价癌症患者预后的另外一个重要因素,与本研究结果一致[13]。
阿帕替尼常见的不良反应包括骨髓抑制、高血压、蛋白尿、手足综合征,其中在Ⅱ/Ⅲ期胃癌临床研究中高血压、腹泻、乏力、蛋白尿的发生率分别为36.32%、10.31%、17.94%、1.79%[11]。本研究显示两组患者不良反应以轻度高血压、蛋白尿、手足综合征为主,差异无统计学意义。本研究中2例患者前期一线、二线化疗时曾使用贝伐珠单抗,后续因病情进展弃用,后线治疗方案选择时患者可接受口服阿帕替尼治疗,耐受性较好,但无法判定治疗过程的潜在获益或毒性的叠加。本研究中2例患者500 mg口服期间出现顽固性头痛,减量至250 mg后头痛症状基本消失,提示阿帕替尼良好的耐受性,并且未明显增加患者全身化疗的不良反应。
综上所述,阿帕替尼联合化疗治疗转移性结直肠癌,在PFS获益上优于阿帕替尼单药方案,且未显著增加不良反应。但本研究样本量较小,需要加大样本量及随访以进一步明确阿帕替尼联合全身化疗在晚期结直肠癌治疗中的疗效及优势。目前仍不能明确抗血管生成治疗确切的疗效预测指标及潜在收益人群,这将是今后的主要研究方向。
