游泳对SHR大鼠血压、心功能及心肌PRMT-1/ADMA-DDAH-2/ Cit-eNOS/NO通路的影响
2019-11-12潘孝贵金其贯
潘孝贵, 金其贯, 李 蕾
(1.西华师范大学 体育学院,四川 南充 637002; 2.扬州大学 体育学院,江苏 扬州 225127; 3.淮北师范大学 体育学院,安徽 淮北 235000)
精氨酸/一氧化氮(L-Arg/NO)途径介导的内皮依赖性血管舒张功能是高血压发生、发展和转归的重要环节。研究[1]表明,仅1%的内皮功能提高,就可将高血压等心血管病人危险性降低13%。含L-Arg残基蛋白质在蛋白质L-Arg甲基转移酶(protein arginine methyltransferase,PRMT)催化下生成的甲基化L-Arg,如不对称性二甲基精氨酸(asymmetric dimethyl arginine,ADMA),对内皮细胞L-Arg/NO通路的关键酶——内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)具有明确的抑制作用,被认为是新的心血管危险因子[2]。ADMA生成后,绝大部分在二甲基精氨酸二甲基氨基水解酶(dimethyl arginine dimethyl aminohydrolase,DDAH)催化下水解成左旋瓜氨酸(L-Citrulline,L-Cit)和二甲胺,少部分通过肾脏进行排泄[3]。Cit也可以作为L-Arg内源合成的前体物质,提高机体L-Arg水平。L-Arg在NOS催化下,生成NO,参与血流动力学稳态调节。研究[4]表明,激活PRMT或抑制DDAH活性,造成ADMA合成增多或水解减少,导致体内ADMA堆积,可以极大地抑制eNOS活性,进而引起NO生物利用度下降;补充L-Arg,或Cit、天冬氨酸、苹果酸等L-Arg前体可以显著提高NO含量[5]。因此,PRMT/ADMA-DDAH/Cit-eNOS/NO组成的通路,成为高血压等心血管疾病重要的干预靶点。流行病学、动物实验、临床报道都证实,运动尤其是规律性有氧运动,可显著降低原发性高血压(essential hypertension,EH)患者血压,改善内皮功能和心功能[6],但PRMT/ADMA-DDAH/Cit-eNOS/NO通路在运动降血压和改善心功能过程中扮演何种角色鲜有报道。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 选用8周龄雄性SHR大鼠50 只,随机分为5组:0周对照组(C-0,n=10)、4周对照组(C-4,n=10)、8周对照组(C-8,n=10)、4周运动组(E-4,n=10)、8周运动组(E-8,n=10),均由北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]提供。常规饲养,自由饮食、活动,室内温度为22~24 ℃,湿度为40%~60%。运动组在最后1次运动结束24 h后处死,禁食12 h。
运动干预采用自主游泳方式。游泳条件:塑钢游泳池(150 cm×60 cm×70 cm ),水深为大鼠身体长度的2倍,水温保持在31~33 ℃。所有大鼠进行3 d适应性游泳训练后,E-4和E-8分别完成连续4周或8周的游泳。训练方案:6 d/周,60 min/d,负重3% bw。对照组不进行任何训练,常规分笼饲养。
1.1.2 主要试剂 SYBR Green Master(ROX)试剂盒(购自Roche Diagnostics),PRMT-1、DDAH-2和GAPDH的引物均由上海生物工程有限公司设计并合成,引物序列见表1。其他试剂为市售分析纯产品。
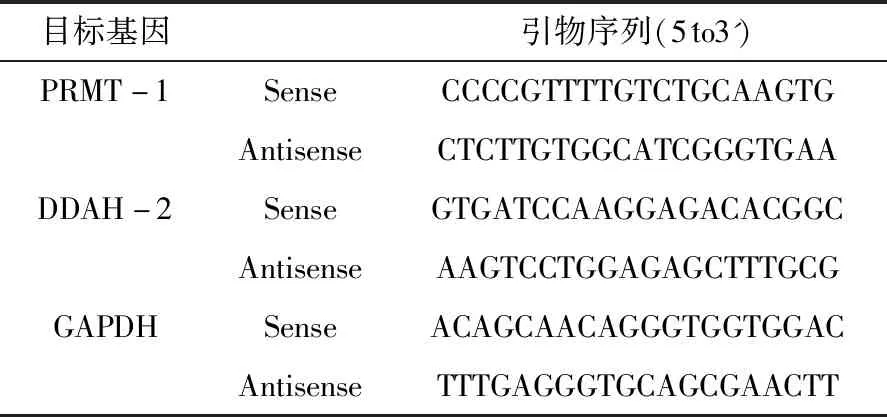
表1 PRMT-1、DDAH-2、GAPDH引物序列
1.2 方法
1.2.1 血压和心功能测定 血压采用体积压力传感器技术(VPR),尾套管法测量大鼠尾动脉,设备为CODATM8多通道无创血压系统( Kent,USA),基本过程见文献[7]。每2周1次,重复2遍,取平均值。
心功能测量采用二维彩超(高分辨率小动物超声系统Vevo 770TM,Canada),由南京医科大学超声医学科专业人员操作,基本过程见文献[8]。根据ASE推荐法测定,经Simpson法换算,最终参数包括射血分数(eject fiction,EF)、短轴缩短分数(fractional shortening,FS)、左心室质量(left ventricle mass,LVM)、左心室舒张末期容积(left ventricle end diastolic volume,LVEDV)、左心室收缩末期容积(left ventricle end systolic volume,LVESV)、每搏输出量(stroke volume,SV)[9]。
1.2.2 心肌ADMA、Cit、L-Arg、NO含量及eNOS活性测定 心肌匀浆制备:取200 mg心肌组织,滤纸吸干,用组织捣碎机在冰水中以10 000~15 000 r/min速度上下研磨,制成10%组织匀浆,低速离心,取上清液待检。心肌ADMA、Cit、L-Arg含量测定:采用高效液相色谱法,仪器为Agilent Technologies 1200 Series 高效液相色谱仪。标准品购自Sigma-aldrich公司(上海),基本过程参照文献[10]。心肌NO含量测定:以组织中硝酸盐和亚硝酸盐总含量间接表示NO含量。检测试剂盒购自南京建成生物工程公司,严格按说明书操作。心肌eNOS活性测定:采用格里斯试剂法,在530 nm波长下比色,检测试剂盒为一氧化氮合成酶(NOS)分型测试盒,购自南京建成生物工程公司,严格按说明书操作。
1.2.3 心肌PRMT-1、DDAH-2及GAPDH mRNA水平测定 取约100 mg的心肌组织放入含有1 mL预冷RNAiso Plus的研磨管中,用组织匀浆器以6 (mol·L-1)/s速度匀浆1 min,提取总RNA后,采用NanoDrop ND-3300微量分光光度计检测260/280吸光度比值,判断RNA纯度。按照cDNA合成试剂盒说明书的要求去除基因组DNA后,使用2720 Thermal Cycler梯度PCR仪(美国)进行cDNA合成,反应结束后,在-20 ℃条件下保存。RNAiso Plus和cDNA合成试剂盒购自宝生物(TaKaRa)工程有限公司。
PRMT-1、DDAH-2 mRNA采用RT-qPCR测定,以cDNA为模板,GAPDH为内参,在ABI 7500 RT-PCR仪中进行基因扩增。扩增程序为:50 ℃预处理2 min,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,共进行40个循环。程序运行结束后,将目的基因的CT值与内参GAPDH进行标准化,计算出目的基因的相对表达量。
1.3 统计学处理使用SPSS 20.0软件进行统计学处理。先进行数据的方差齐性检验,后进行单因素方差分析,采用LSD法进行组间两两比较,结果以MSD表示。统计学显著水平为P< 0.05,高度显著性水平为P< 0.01。
2 结果
2.1 血压和心功能指标如表2所示,与C-0组比较,C-4、C-8组SBP、DBP、LVM、LVEDV、LVESV、SV显著升高(P<0.05),E-4、E-8组SBP、DBP、LVM、LVESV显著降低(P<0.05),EF、FS、LVEDV、SV显著升高(P<0.05);E-4、E-8组SBP、DBP、LVM、LVESV显著低于同周龄的C-4、C-8组(P<0.05),EF、FS、SV显著高于同周龄的C-4、C-8组(P<0.05);E-8组与E-4组比较,SBP、DBP、EF、SV无显著性差异,FS、LVM、LVEDV、LVESV显著升高(P<0.05)。
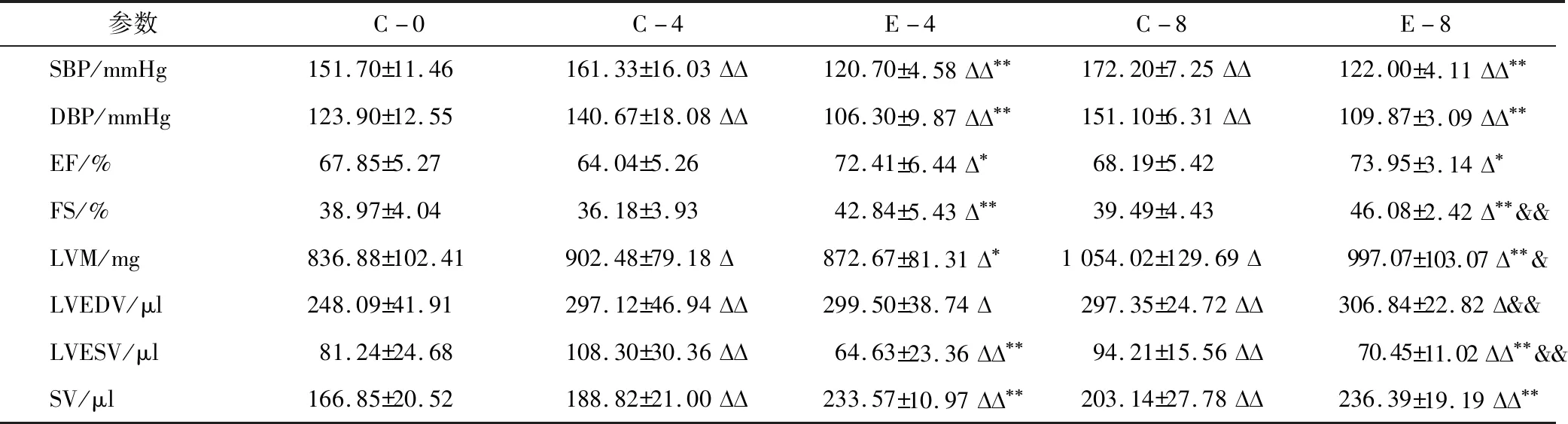
表2 血压和心功能指标比较(M±SD)
注:1 mmHg=133.3 Pa;表示与C-0组比较P<0.05,表示与C-0组比较P<0.01;*表示与同周龄对照组比较P<0.05,**表示与同周龄对照组比较P<0.01;&表示与E-4组比较P<0.05;&&表示与E-4组比较P<0.01。
2.2 心肌ADMA、Cit、L-Arg、NO含量及L-Arg/ADMA比值、eNOS活性如图1所示,与C-0组比较,C-8组心肌ADMA含量显著升高(P<0.05),Cit含量、L-Arg/ADMA比值显著下降(P<0.05),E-4组Cit显著降低NO含量显著升高(P<0.01),E-8组ADMA含量显著降低(P<0.01),L-Arg、NO含量,以及L-Arg/ADMA比值和eNOS活性显著升高(P<0.05)。与同周龄对照组比较,E-4组 Cit含量显著降低(P<0.01),NO含量显著升高(P<0.05),E-8组Cit、ADMA含量显著降低(P<0.01),L-Arg、NO含量,以及L-Arg/ADMA比值和eNOS活性显著升高(P<0.05)。与E-4组比较,E-8组ADMA含量显著降低(P<0.01),Cit、NO含量、L-Arg/ADMA比值和eNOS活性显著升高(P<0.05)。
2.3 心肌PRMT-1、DDAH-2 mRNA表达如图2所示,与C-0组比较,C-8组PRMT-1 mRNA表达显著升高,DDAH-2 mRNA表达显著降低(P<0.05),但E-4、E-8组PRMT-1 mRNA表达显著降低(P<0.01),DDAH-2 mRNA表达显著升高(P<0.01)。与同周龄C-4、C-8组比较,E-4组DDAH-2 mRNA表达显著提高(P<0.01),E-8组PRMT-1 mRNA表达显著降低(P<0.01),DDAH-2 mRNA表达显著升高(P<0.05)。与E-4组比较,E-8组PRMT-1 mRNA表达显著降低(P<0.05)。
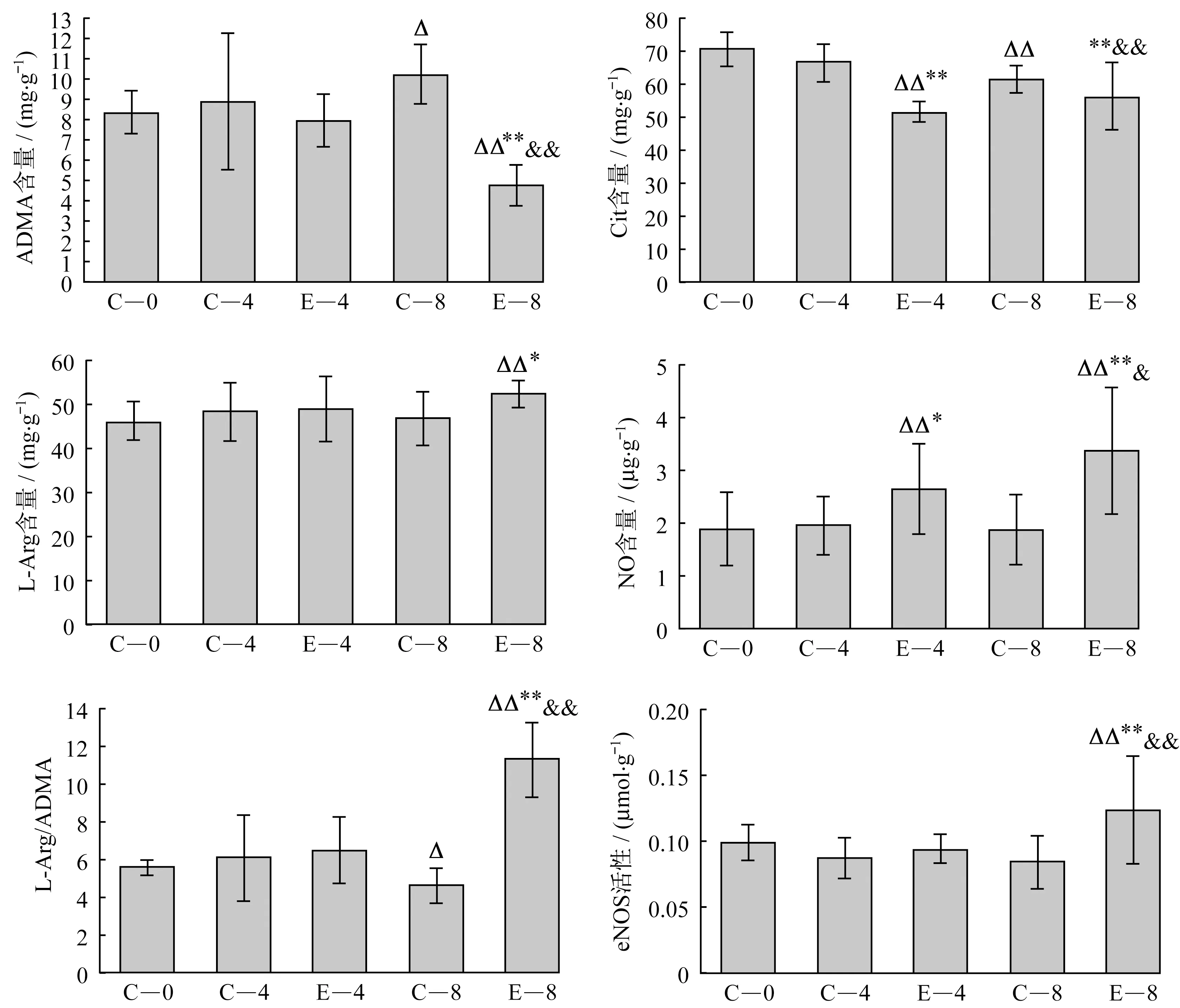
注:表示与C-0组比较P<0.05,表示与C-0组比较P<0.01;*表示与同周龄对照组比较P<0.05,**表示与同周龄对照组比较P<0.01;&表示与E-4组比较P<0.05;&&表示与E-4组比较P<0.01。
图1 心肌ADMA、Cit、L-Arg、NO含量及L-Arg/ADMA比值、eNOS活性
Figure 1 Content of ADMA,Cit,L-Arg,NO and L-Arg/ADMA,eNOS activity in SHR myocardium
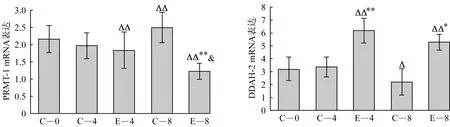
注:表示与C-0组比较P<0.05,表示与C-0组比较P<0.01;*表示与同周龄对照组比较P<0.05,**表示与同周龄对照组比较P<0.01;&表示与E-4组比较P<0.05;&&表示与E-4组比较P<0.01。
图2 心肌PRMT-1、DDAH-2 mRNA表达
Figure 2 Relative expression of myocardial PRMT-1,DDAH-2 mRNA in SHR
3 讨论
本文发现,随着周龄的增加,C-4、C-8组 SHR收缩压、舒张压显著高于C-0组,且C-8组SHR显著高于C-4组,均达到轻中度高血压标准[SBP≥140 mmHg(18.66 kPa)/DBP≥100 mmHg(13.33 kPa)]。研究[11]表明,对轻中度高血压患者而言,仅靠有规律的运动即可有效降低或控制血压。经运动干预后,E-4、E-8组SHR收缩压、舒张压显著低于C-4、C-8组,但E-8与E-4组比较,收缩压、舒张压无显著性差异。提示,4周到8周的游泳运动可以有效降低甚至逆转SHR大鼠血压。本文中,降压幅度较大,可能与SHR周龄较小,靶器官尚无严重的器质性损伤有关。研究[12]表明,运动干预可以有效降低高血压患者血压,但对常压者血压无显著性影响。4周运动干预后,SHR收缩压略高于120 mmHg(15.996 kPa),舒张压略高于100 mmHg(13.33 kPa),属于高血压前期或高值血压,因此,持续更久的8周运动干预并未进一步降低SHR大鼠血压。
心脏既是血压的调节器官,又是高血压损害的靶器官,慢性高血压患者常伴有心功能损伤。临床实验、动物实验、流行病学均证实,运动在降低高血压患者血压的同时,可改善心功能,减轻心肌肥厚程度[13]。本文通过动物无创二维彩超心动图测试发现,C-4、C-8组SHR的LVM、LVEDV、LVESV、SV显著高于C-0组,表明随着周龄的增加,SHR大鼠血压升高,发生心肌肥大,LVEDV和LVESV均扩大,SV显著升高,但EF无显著提高。与同周龄的对照组比较,E-4、E-8组SHR大鼠EF、FS、LVS、SV显著升高,LVM、LVS显著降低,表明运动干预提高了SHR大鼠心肌收缩能力,增强了心脏泵血机能,降低了心肌肥大程度。与E-4组比较,E-8组EF、FS、LVM、LVD、LVS显著升高,但SV无显著性差异,说明坚持更长时间的运动干预,可进一步提高SHR心肌收缩力,并将SV保持在较高水平。
血压的形成与心脏泵血机能和外周阻力密切相关,凡影响这2个方面的因素均可以影响血压。心肌组织血管非常丰富,冠脉系的各级动脉腔面、心内膜表面均覆盖有内皮。心脏内皮通过L-Arg/NO途径合成适量的NO,参与血管舒张、心肌负性变时和负性变力,维持正常心功能,调节血压等血流动力学参数。研究[14]证实,SHR大鼠心血管组织eNOS表达下调,血浆和组织L-Arg、NO含量显著低于野生型Wky大鼠,说明 L-Arg/NO通路抑制是SHR重要的心血管代谢特征。L-Arg/NO通路参与血压调节的关键是NO生物利用度。从物质代谢角度看,NO生物利用度主要受底物(L-Arg)水平、调节酶(eNOS)活性和产物(NO)淬灭的影响[15]。L-Arg作为条件必需氨基酸,是NO内源性合成的唯一前体,消耗的L-Arg约占总量的1%~2%。SHR大鼠心肌组织存在L-Arg合成相关的酶系,可以内源合成L-Arg,也可以通过阳离子氨基酸转运载体-1(cationic amino acid transporter-1,CAT-1)从血液中摄取[16]。ADMA是新发现的eNOS内源性抑制剂,已经被认为是独立的心血管危险因素和内皮损伤因子[3]。ADMA抑制eNOS活性的机制可能与eNOS解耦联、自由基激活有关[17]。研究[18]表明,SHR大鼠血浆和心肌ADMA含量随周龄显著升高。ADMA主要来自蛋白质精氨酸甲基转移酶(PRMT)催化的含L-Arg残基蛋白质水解[2]。ADMA生成后,绝大部分在DDAH催化下水解成L-Cit和二甲胺,少部分通过肾脏排泄[3]。PRMT是促进ADMA合成最主要的酶类,而DDAH是水解ADMA最主要的酶类。这2种酶具有多种亚型,心血管组织主要表达PRMT-1和DDAH-2。NO不断生成的同时,也不断被自由基淬灭。SHR大鼠氧化应激水平显著高于野生型Wky大鼠,是其NO生物利用度低下的重要原因。ADMA与自由基在加速组织NO淬灭方面有协同作用[19]。
本文结果显示,与C-0组比较,C-4组心肌L-Arg、ADMA、Cit、NO含量,以及L-Arg/ADMA比值、eNOS活性、PRMT-1mRNA、DDAH-2表达均无显著变化,但C-8组ADMA含量、PRMT-1mRNA表达显著提高,Cit含量、L-Arg/ADMA比值和DDAH-2mRNA表达显著下降,L-Arg、NO含量无显著变化。提示,在SHR增龄性血压升高过程中,心肌L-Arg水平可能并不是SHR血压升高的限制性因素;随着周龄的增加,到16周龄时,处于轻中度高血压阶段的SHR心肌PRMT-1mRNA表达上调,加速ADMA生成,同时DDAH-2mRNA表达下降,减少ADMA分解,进而造成心肌ADMA堆积,L-Arg/ADMA比值降低。心肌Cit含量下降间接提示,高血流动力学压力下,SHR心肌物质代谢加速,通过Cit途径合成L-Arg,拮抗ADMA的抑制效应,从而代偿性增强eNOS合成NO的能力。综合以上2个方面因素,尽管4周、8周时SHR大鼠血压升高、心功能轻度受损,但心肌eNOS活性和NO含量并未发生显著变化,这与长期、重度高血压个体eNOS活性和NO含量显著降低有着较大不同。这些结果表明,心肌PRMT-1/ADMA-DDAH-2/Cit-eNOS/NO通路在SHR增龄引起的轻中度高血压和心功能损伤过程中扮演着一定的角色,但可能还有其他重要因素参与,如缩血管物质(ET-1、Ang-II等)、交感神经紧张性过高等神经-体液因素,及肾性因素[6]。
运动干预对心血管组织最显著的影响是提高组织器官的血流动力学水平。运动过程中,心肌收缩力增强,心率加快,冠脉扩张,冠脉血流量显著增加,血管内皮反复暴露于高切应力环境,极大地激活和上调eNOS表达,加强NO合成。NO通过抗动脉硬化、抗感染、抗血栓3个途径,参与血流动力学稳态调节。交感神经激活造成的高血压与肾组织ADMA含量存在着密切联系[20]。人脐静脉内皮细胞培养实验表明,氧化型低密度脂蛋白(ox-LDL)损伤内皮的机制可能与抑制DDAH活性,提高ADMA含量有关[21]。降低交感神经紧张性和血浆ox-LDL水平,均是已经得到确认的运动降血压和改善内皮功能的机制,因此,ADMA很可能是运动干预原发性高血压等心血管疾病的重要靶点物质。运动训练对稳定的心血管病人血管内皮具有显著的改善效应,并可部分纠正其心血管失衡,提高左心功能[22]。Graziano[23]发现,坚持每天跑台行走3 000 m,可以显著降低中老年心血管病患者血浆ADMA、SDMA含量,升高血浆L-Arg含量。景志强等[24]发现,持续10周,每周5次,每次40 min的跑台运动,可以极大地降低糖尿病大鼠血浆ADMA水平,且与降糖药——罗格列酮有协同作用,其机制可能与肝脏DDAH表达上调有关。周亮等[25-26]认为中等强度以上的有氧运动改善雄性SD大鼠动脉粥样硬化的机制与降低血清ADMA水平有关,且较长时间、较大强度的有氧运动效果更佳。张靓等[27]也认为运动改善Apo E-/-小鼠动脉粥样硬化的机制可能与降低ADMA水平有关,而与L-Arg水平无关。
本文发现,与C-0组比较,E-4组心肌NO含量显著升高,Cit含量、PRMT-1mRNA表达显著降低,DDAH-2mRNA表达显著升高;E-8组心肌ADMA含量显著降低,L-Arg、NO含量,以及L-Arg/ADMA比值和eNOS活性显著升高,PRMT-1mRNA表达显著降低,DDAH-2mRNA表达显著升高;与C-4组比较,E-4组Cit显著降低,NO显著升高,DDAH-2mRNA表达显著提高;与C-8组比较,E-8组Cit、ADMA显著降低,L-Arg、NO含量,以及L-Arg/ADMA比值和eNOS活性显著升高,PRMT-1mRNA表达显著降低,DDAH-2mRNA表达显著升高。与E-4组比较,E-8组ADMA显著降低,Cit、NO含量、L-Arg/ADMA比值和eNOS活性显著升高,PRMT-1mRNA表达水平显著降低。4周运动干预后,SHR大鼠血压恢复接近正常水平的同时,通过下调心肌PRMT-1mRNA、上调DDAH-2mRNA表达,抵消增龄诱导的心肌ADMA堆积对eNOS的抑制,促进NO合成。继续进行运动干预,尽管血压未能进一步下降,但SHR心肌PRMT-1mRNA表达显著降低、DDAH-2mRNA表达显著提高的同时,ADMA显著下降,L-Arg及L-Arg/ADMA比值显著升高,eNOS活性增强,NO合成显著增加,心功能进一步改善。因此,规律性运动可能通过干预轻中度高血压SHR心肌PRMT-1/ADMA-DDAH-2/Cit-eNOS/NO通路的一个或几个组分,参与血管舒张、心肌负性变时和负性变力,改善心功能,调节血压等血流动力学参数,长期运动干预较短期对该通路的影响更明显、更广泛。本文结果也提示,即使血压恢复正常,继续运动干预可改善原发性高血压个体心肌L-Arg代谢。
长期规律性运动下调心肌PRMT-1mRNA的机制,可能与PRMT-1mRNA催化的L-Arg甲基化过程属于蛋白质翻译后修饰,通过抑制或促进蛋白质之间相互作用而影响信号转导有关[28]。运动训练上调心肌组织DDAH-2mRNA表达的机制,则可能与ADMA堆积诱导的底物激活效应有关[29],也可能与运动训练降低高血压患者心血管组织血管紧张素-II分泌有关。已有研究证实,血管紧张素-II可以诱导ADMA生成[30]。运动过程中氧耗量较高,物质代谢旺盛,神经-体液分泌活跃,蛋白质处于不断合成和降解中,氨基酸特别是L-Arg和谷氨酰胺,大量从骨骼肌中被动员出来,以加强NO和还原型谷胱甘肽(GSH)合成,调整心血管组织的物质代谢通路和信号转导通路,降低组织氧化应激水平,调节心血管患者内皮功能,但具体机制还需要进一步研究。
4 结论
SHR增龄性血压升高和心功能损伤的同时,心肌PRMT/ADMA-DDAH/Cit-eNOS/NO通路受到影响,PRMT-1mRNA表达上调,DDAH-2mRNA表达下降,ADMA堆积,Cit含量和L-Arg/ADMA比值降低。运动通过下调心肌PRMT-1mRNA和/或上调DDAH-2mRNA表达,减少ADMA堆积,升高L-Arg/ADMA比值,增强eNOS活性,提高NO含量,从而改善心功能。
