产地对燕麦种带真菌的影响
2019-11-07聂秀美赵桂琴兰晓君柴继宽金小雯吴文斌蔺豆豆
聂秀美,赵桂琴,兰晓君,柴继宽,刘 欢,金小雯,吴文斌, 蔺豆豆
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
燕麦(Avenasativa)是禾本科(Gramineae)燕麦属(Avena)一年生粮饲兼用作物,主要分布在我国内蒙古、河北、甘肃和山西等地[1]。燕麦种子中淀粉、蛋白质、脂肪等营养物质含量都比较高,是家畜的优质精饲料[2-3],还富含可溶性膳食纤维、维生素、亚油酸、葡聚糖等多种营养成分,具有调节血脂、延缓衰老、降低胆固醇以及促进伤口愈合等功效,具有较高的保健价值[4-5]。
作为植物的繁殖器官和农牧业生产的基础资料,种子健康是提高作物产量和品质的前提,也是种质安全保存的首要条件[6],但田间收获贮藏的种子通常携带大量的真菌,这些真菌吸附于种子表面或侵入组织内部,是许多病害的初侵染源,是病害远距离传播的主要媒介和携带者[7]。种子带菌不仅会影响种子的萌发、幼苗的健康生长,还会降低种子品质、缩短种子寿命,最终导致作物质量和产量降低,造成经济损失[8]。此外,种子在贮藏过程中某些产毒病原真菌还会分泌真菌毒素,严重影响产品安全,对人畜健康造成极大威胁[9-10]。
近年来,随着我国草产业的发展,燕麦的种植面积不断扩大,种子的需求量逐渐增加,异地调种日益频繁,增大了病原菌传播的风险。燕麦种带真菌是病害在时间和空间上传播的主要途径之一,也是其种子安全保存的重大隐患之一。目前,我国对种带真菌的研究主要集中在水稻(Oryzasativa)[11-12]、玉米(Zeamay)[13]、小麦(Triticumaestivum)[14-15]等经济作物方面,对燕麦种子带菌情况的报道较少,仅见荆卓琼等[16]采用平板培养法对甘肃省4个燕麦种子样本的种带真菌进行检测,依据真菌形态特征鉴定出19个属,其中链格孢属(Alternariasp.)为优势菌,检出率达38%~98%;马从[17]通过平板培养法和形态学鉴定从燕麦种子中分离鉴定出6属21种真菌,主要为青霉菌属(Penicilliumsp.)和镰刀菌属(Fusariumsp.)。由于不同生产区域的环境因子(主要是气候条件和栽培制度)不同,因此,真菌种类和数量有很大差异,种子带菌情况也会随之变化。如刘志勇[18]对黑龙江省10个不同地区大豆(Glycinemax)品种的带菌情况进行研究表明,不同地区大豆品种间的带菌率为2%~26%,且不同地区的优势菌和分离率差异较大。高晨轩[19]表明垂穗披碱草(Elymusnutans)种子的带菌率和种带真菌的多样性与环境因子(主要是海拔、年均气温、年降雨量和经纬度等)相关性较大,优势属为镰刀菌属和链格孢属,在各采样点均检出,分离率较高;其它属为常见属或稀有属,分离率较低。而目前有关产地对燕麦种子种带真菌影响方面还未见报道。因此,本研究拟对我国河北省张北县张北镇和甘肃省通渭县华家岭镇两大燕麦主栽培区的相同燕麦品种的种带真菌进行分离和鉴定,旨在明确其携带真菌所属种类以及产地对燕麦种子带菌情况的影响,为燕麦种子的健康保存提供理论依据,为燕麦种传病害的防治奠定基础。
1 材料与方法
1.1 试验材料
试验于2017年10月在甘肃农业大学草业学院实验室进行,供试材料为2015年9月在甘肃省通渭县华家岭镇和河北省张北县张北镇收获后保存于当地燕麦种子库的裸燕麦‘坝莜3号’和‘坝莜9号’,种子贮藏期间的概况见表1。

表1 供试燕麦种子及其产地概况
1.2 种带真菌的分离培养
每份种子样品随机取200粒种子,其中100粒等距离放置于90 mm的马铃薯葡萄糖琼脂(Potato dextrose agar,PDA) 培养基(马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1000 mL,含硫酸链霉素、卡那霉素各100 mg·L-1)上,每皿5粒,5皿为1重复,共4次重复,置于25℃恒温培养箱中暗培养。另100粒种子经75%酒精浸泡消毒1 min,再用1%次氯酸钠消毒2 min,用无菌水充分洗涤3~5次,用灭菌滤纸吸干种子表面的水分后按上述条件培养。每天进行观察,及时挑取菌丝至新鲜PDA培养基上分离纯化。待不再有新的菌落出现时,统计带菌种子数和带某种真菌种子数,并参照徐秀兰等[20]的方法计算种子带菌率和某菌分离率:
带菌率(%)=(带菌种子数/检测种子总数)×100;
某菌分离率(%)=(带某种菌的种子数/带菌种子总数)×100。
1.3 种带真菌的形态鉴定
将纯化后的真菌在新鲜PDA平板上25℃黑暗培养7 d后,参照《植物病原真菌学》[21]和《真菌分类学》[22],在显微镜下观察菌落和分生孢子的形状、颜色和大小等形态学特征进行初步鉴定。
1.4 种带真菌的分子生物学鉴定
1.4.1种带真菌的DNA提取 分离纯化的真菌在PDA培养基上培养7 d左右,采用真菌基因组Omega试剂盒提取菌株DNA。具体步骤为:取约0.1 g新鲜菌丝加入液氮充分碾磨后迅速转移到2 mL离心管中,并立即加入500 μL裂解液CPL和10 μL 2-巯基乙醇,经涡旋振荡混匀后65℃下水浴15 min;加入500 μL氯仿/异戊醇(24∶1)充分混匀后在12000 r·min-1下离心5 min;取上清液300 μL于新的离心管中,加入150 μL洗脱缓冲液CXD和300 μL无水乙醇,混匀后转入带有吸附柱的收集管中,在12000 r·min-1下离心1 min,弃废液;向吸附柱中加入650 μL漂洗液SPW于12 000 r·min-1离心1 min,弃废液;重复上次步骤后于1 2000 r·min-1离心2 min,弃废液;将吸附柱置于新的离心管中室温静置10 min至晾干;向吸附柱中间部位悬空滴加70 μL洗脱缓冲液Elution buffer,室温静置5 min后于12 000 r·min-1下离心2 min,收集到的提取液于—20℃保存备用。
1.4.2种带真菌的PCR扩增和测序 利用真菌特异性引物对ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)进行扩增,其中PCR反应体系为50 μL:2×Taq PCR Master Mix溶液25 μL,10 μmol· L-1引物各1 μL,模板5 μL,补充ddH2O至50 μL。扩增程序为:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,34个循环;72℃下延伸7 min。反应完成后,用1%琼脂糖凝胶电泳检测PCR扩增产物,点样5 μL,用1×TAE电泳缓冲液在100 V的电场下电泳20 min左右,利用紫外凝胶成像仪观察照相并分析,扩增产物送至北京奥科鼎盛生物科技有限公司进行测序。
1.4.3种带真菌的序列分析和系统发育树构建 测序结果经DNASTAR软件包中的SeqMan进行校对拼接,BioEdit软件对每个碱基进行人工校对后,登录NCBI数据库进行Blast同源序列比对,并用Mega 7.0软件中的邻接法(Neighbor Joining,NJ)构建系统发育树,进行1000次重抽样计算系统树中节点的置信度。
2 结果与分析
2.1 产地对燕麦种子带菌率的影响
通过对来自甘肃省通渭县华家岭镇和河北省张北县张北镇的燕麦种子进行真菌培养后发现,两地供试种样的带菌率存在明显差异(表2)。不经表面消毒的样品带菌率为85%~100%,甘肃华家岭的样品带菌率相对较高,平均为98.50%;河北张北镇的平均带菌率为87.50%,两者相差11%。经表面消毒的种子带菌率为7%~19%,其中甘肃华家岭的平均带菌率为16%,河北张北的为8%。另外,品种间差异也比较明显,甘肃华家岭的‘坝莜3号’消毒前后的带菌率分别为97%和13%;河北张北的‘坝莜3号’消毒前带菌率为85%,消毒后仅为7%。‘坝莜9号’在甘肃华家岭消毒前带菌率高达100%,消毒后为19%;在河北张北消毒前后带菌率分别为90%和9%。
2.2 燕麦种带真菌的形态学观察
分离纯化的种带真菌在PDA培养基培养7 d后,观察和描述菌落形态和分生孢子形态特征,部分菌落和孢子形态如图1所示。

表2 供试燕麦材料的带菌率
芸薹链格孢(Alternariabrassicae,图1 A~C)菌落生长速度较快,稍隆起,近似圆形,直径约61 mm,表面绒状,中间颜色较深,呈深褐色,边缘整齐,呈浅褐色,具白色气生菌丝,生长稀疏,背面具有同心圆,中间黑褐色,边缘黄褐色。分生孢子单生,倒梨形或倒棒状,黄褐色,大小为(13.31~24.53)μm ×(3.43~10.65)μm,具横膈膜3~10个,纵斜隔膜0~5个。
芦竹节菱孢(Arthriniumarundinis,图1 D~F)菌落生长快速,平铺,圆形,直径约90 mm,表面绒毛状或棉絮状,呈白色,边缘整齐,气生菌丝浓密,背面白色。分生孢子单生或串生,球形或椭球形,黑褐色,大小为1.12~2.58 μm,无隔膜。
塔兵曲霉(Aspergillustubingensis,图1 G~I)菌落生长速度较快,平铺,近似圆形,直径约65 mm,表面粉状,边缘整齐,整体呈黑褐色,边缘具白色气生菌丝,生长稀疏,有放射状纹理,背面米白色。分生孢子球形,黄褐色至黑褐色,大小为2.37~3.24 μm,无隔膜。
汤姆青霉(Penicilliumthomii,图1 J~L)菌落生长速度缓慢,均匀隆起,近似圆形,直径约32 mm,表面粉状,蓝绿色,可泌出无色水滴,边缘整齐,背面米白色。分生孢子球形,黄绿色或浅绿色,大小为2.42~3.02 μm,无隔膜。
2.3 燕麦种带真菌的分子生物学鉴定
采用真菌rDNA通用扩增引物ITS1和ITS4,对从燕麦种子分离获得的具有形态差异的代表性菌株的DNA进行PCR扩增,从扩增产物的琼脂糖凝胶电泳检测图谱(图2)中可看到扩增条带清晰明亮、无拖尾和杂带现象,各真菌扩增出的目的片段长度在500~750 bp,整体扩增效果良好,符合测序要求。将测序结果在GenBank数据库中进行BLAST同源性比对表明,各被鉴定菌株与其对应的比对菌株相似度均在98%以上。进一步通过Clustal W软件进行碱基序列比对,并通过Mega 7.0软件以邻接法构建系统发育树,如图3所示,不同种的菌株位于不同的分支末端,单独形成一支;除链格孢属的细极链格孢(Alternariatenuissima)和链格二孢(Alternariarosae)未能与其它链格孢属的菌株明显聚为一支,其它同一个属的菌株都聚在一个较大的分支。这些菌株被鉴定为13属30种,其中链格孢属8种,青霉菌属6种,节凌孢属(Arthriniumsp.)2种,曲霉菌属(Aspergillussp.)3种,枝孢菌属(Cladosporiumsp.)3种,德氏霉属(Drechslerasp.)2种,附球菌属(Epicoccumsp.)、根霉属(Rhizopussp.)、毛霉属(Mucorsp.)、棒囊壳菌属(Corynascussp.)、镰刀菌属和色串孢属(Torulasp.)各1种。

图2 PCR扩增产物的电泳检测结果
2.4 产地对燕麦种子带菌种类和分离率的影响
不同来源的种子样本所带真菌的种类和分离率差异较大(表3),分离率介于0.15%~59.85%之间。从甘肃华家岭和河北张北的种子样本中分别检测到11属22种和11属23种真菌,其中葱链格孢菌(Alternariaporri,分离率8.05%)、芦竹节菱孢(分离率4.02%)、冻土毛霉(Mucorhiemalis,分离率4.02%)、离生青霉(Penicilliumsolitum,分离率3.76%)、黑曲霉(Aspergillusniger,分离率1.15%)、多孢枝孢(Cladosporiumpseudocladosporioides,分离率0.75%)和枝孢菌(Cladosporiummichoacanense,分离率0.15%)7种真菌仅在甘肃华家岭燕麦样本中检出。赤曲霉(Aspergillusruber,分离率11.11%)、链格孢菌(Alternariaslovaca,分离率6.06%)、藜生链格孢(Alternariachenopodiicola,分离率5.26%)、橘灰青霉(Penicillumaurantiogriseum,分离率3.97%)、棒囊壳菌(Corynascusverrucosus,分离率3.03%)、链格二孢(Alternariarosae,分离率1.59%)和昏暗色串孢(Torulacaligans,分离率0.79%)7种真菌仅在河北张北燕麦种子中检出。两个产地均能分离到的真菌有细交链孢(Alternariaalternate)、芸薹链格孢、细极链格孢、苹果链格孢(Alternariamali)、塔宾曲霉、芽枝状枝孢(Cladosporiumcladosporioides)、燕麦内脐蠕孢(Drechsleraavenae)、黑附球菌(Epicoccumnigum)、梨孢镰刀菌(Fusariumpoae)、燕麦核腔菌(Pyrenophoraavenae)、金青霉(Penicilliumaurantiocandidum)、产黄青霉(Penicilliumchrysogenum)、波兰青霉(Penicilliumpolonicum)、汤姆青霉和米根霉(Rhizopusoryzae),其中甘肃华家岭样品中细交链孢的平均分离率最大,为40.05%;其次是芽枝状枝孢(分离率21.36%);枝孢菌的平均分离率最小,仅有0.04%。河北张北样品中细交链孢的平均分离率也最高,为37.11%;其次是产黄青霉,分离率为13.45%;波兰青霉的分离率最低为0.19%。
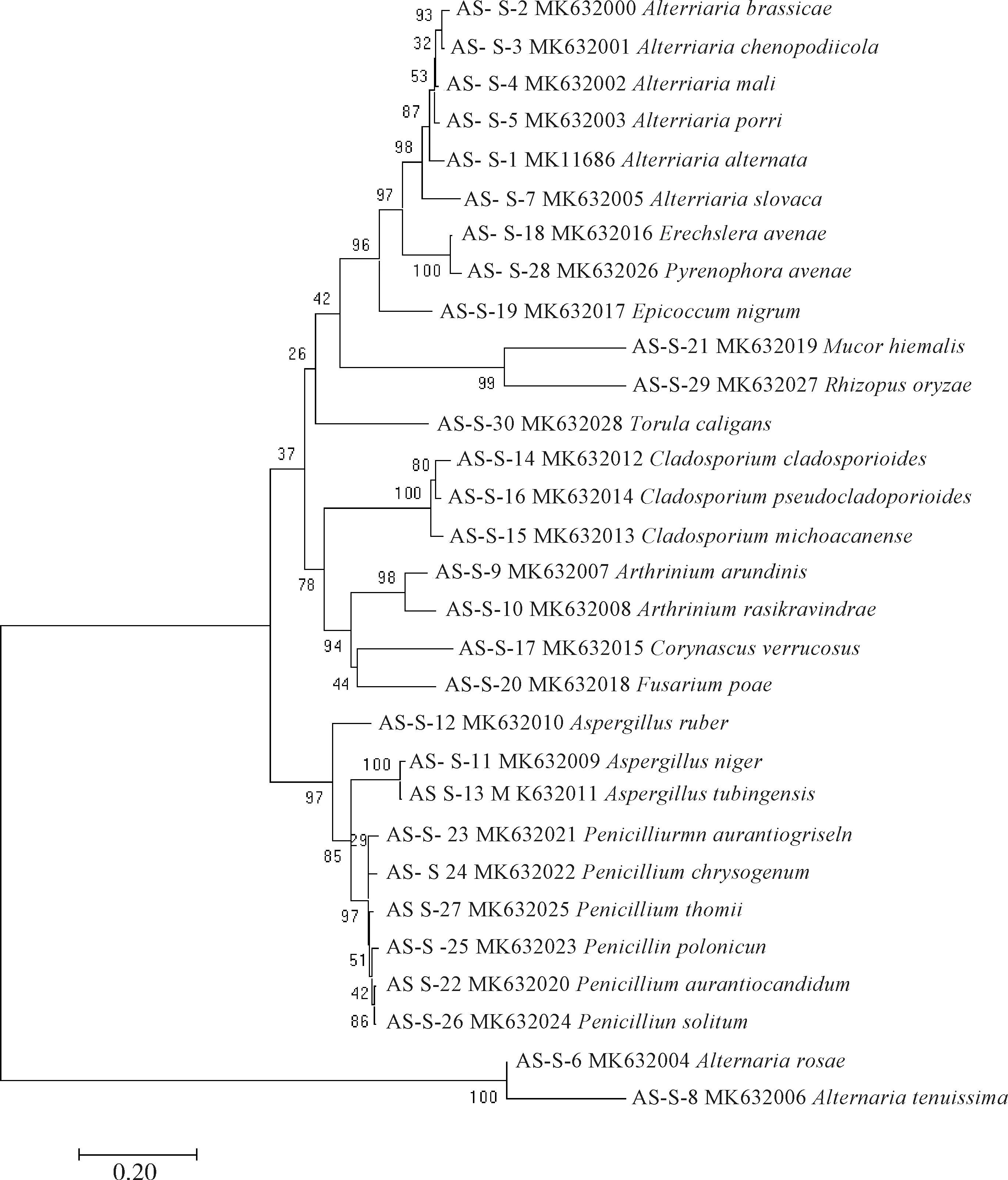
图3 基于rDNA-ITS序列构建的燕麦种带真菌系统发育树
另外,不经表面消毒的样品所携带的真菌共有12属28种,分离率为0.15%~59.85%。其中细交链孢的平均分离率最大,为53.73%;其次是黑附球菌(分离率8.73%)、芸薹链格孢菌(分离率7.54%)和芽枝状枝孢(分离率5.09%)。与未经表面消毒的材料相比,消毒处理后真菌的种类和分离率存在明显差异,共检测出8属12种,分离率为5.26%~38.46%,4份样品中共同携带的真菌只有细交链孢,分离率最高为38.46%。经表面消毒的种子携带的真菌除节菱孢菌(Arthriniumrasikravindrae,分离率15.79%)和藜生链格孢(分离率5.26%)外,均可以在未消毒种子上检测到;而赤曲霉(分离率11.11%)、葱链格孢菌(分离率8.05%)、链格孢菌(分离率6.06%)、芦竹节菱孢(分离率4.02%)、冻土毛霉(分离率4.02%)、橘灰青霉(分离率3.97%)、离生青霉(分离率3.76%)、链格二孢(分离率1.59%)、黑曲霉(分离率1.15%)、昏暗色串孢(分离率0.79%)、多孢枝孢(分离率0.75%)和枝孢菌(分离率0.15%)仅存在于未消毒的种子中。

表3 燕麦种带真菌种类和分离率
注:B3G,B9G分别表示甘肃华家岭的‘坝莜3号’、‘坝莜9号’,B3H、B9H分别表示河北张北的‘坝莜3号’、‘坝莜9号’
Note:B3G and B9G represent ‘Bayou No.3’ and ‘Bayou No.9’ from Huajialing Town of Gansu Province,B3H and B9H represent ‘Bayou No.3’ and ‘Bayou No.9’ from Zhangbei Town of Hebei Province,respectively
3 讨论
本研究通过对来自甘肃省通渭县华家岭镇和河北省张北县张北镇产区的燕麦品种进行真菌培养后发现,不同产地来源的燕麦种子带菌率差异较大。甘肃华家岭样品消毒前后的带菌率都高于相同处理下河北张北样品的带菌率,‘坝莜3号’在甘肃消毒前后的带菌率分别高出河北11%和6%,‘坝莜9号’在甘肃消毒前后的带菌率较河北均高出10%,这说明不同真菌对燕麦种子的侵染能力不同,产地环境的差异可能是引起燕麦种子带菌差异的关键因子。李春杰等[23]研究指出,不同产地种子收获和贮藏期间的气候条件是影响种子带菌率高低的关键因素,湿润度越高,种子带菌率越大。本研究中,种子贮藏期间甘肃通渭县华家岭镇的年均降雨量(465 mm)和平均湿度(75.6%)明显高于河北张北县张北镇(降雨量341 mm,湿度58.1%),这为霉菌的滋生提供了有利条件,使得甘肃省燕麦种样的带菌率高于河北省。种子带菌率高,不仅会致使种子生活力和贮藏寿命下降,还会对幼苗的萌发生长等产生不同程度的影响[17]。因此,为降低真菌在种子贮藏期间的侵染和增殖,应选择在晴朗干燥的天气快速收获种子,及时进行晾晒,在贮藏时注意通风透气,以保证种子的安全贮藏。
采用经典形态学分类法和rDNA-ITS序列分析法鉴定真菌种类,不仅可以克服传统分类方法中真菌数量大、形态特征复杂和易受外界环境条件影响等不稳定因素,还能避免因基因库完善程度低、已知物种相似性序列数量少而得出假阳性或假阴性结果,从而提高真菌分类鉴定的准确性[24-25]。因此,本研究对从燕麦种子中分离获得的菌株通过形态学初步鉴定后,进一步利用了rDNA-ITS序列分析法进行分子鉴定,从参试材料中共检测到13属30种真菌,其中链格孢属8种,青霉菌属6种,曲霉属和枝孢菌属各3种,其它真菌属1~2种,这说明链格孢菌和青霉菌是燕麦种子贮藏期间的主要侵染菌,对当地贮藏环境的生存能力较强。这跟已有的研究[26-27]结果相符,链格孢属、青霉菌属和曲霉属等真菌是种子携带的主要真菌类群,这些真菌在适宜的环境条件下,具有较强的孢子萌发能力和菌丝生长能力。罗光明等[28]对不同产地来源的蔓荆子(Vitextrifoli)种子进行带菌研究表明,不同产地间种子携带的真菌种类差异较大,曲霉属在大多数产地的种子均可检测到,镰刀菌属仅在山东省荣城市和威海市检出,毛霉属仅在江西省南昌市检出。南志标等[29]研究表明,沙打旺(Astragalusadsurgens)种子携带的优势菌为多主枝孢(Cladosporiumherbarum),在7个产地的种子上均有发现;其次是细交链孢和匍柄霉(Stemphyliumbotryosum),在大多数产地中均有检出,而镰刀菌、长蠕孢(Helminthosporiumsp.)和茎点霉(Phomasp.)真菌仅能在某一地发现。本试验结果表明,不同产地来源的燕麦带菌种类存在明显差异,细交链孢、塔宾曲霉、黑附球菌和产黄青霉等真菌在2个产地均能分离到,而葱链格孢菌、芦竹节菱孢和黑曲霉等仅存在于甘肃燕麦样本中;赤曲霉、棒囊壳菌和昏暗色串孢等仅在河北的燕麦样本中检出,这可能是因为不同真菌对燕麦种子的侵染能力不同,而且不同产地间气候因子间的差异也会影响真菌的存活力和繁殖率,进而影响对种子的侵染。
先米西努尔·肉孜等[30]研究发现,苜蓿(Medicagosativa)种子未经表面消毒时的带菌率为13.50%~87.50%,而经消毒后为3.50%~46.50%,且经消毒处理后各种真菌的检出率较未经处理的种子显著降低。赵辉等[31]研究表明,芝麻(Sesamumindicum)种子消毒前后的带菌率和真菌检出率也存在显著差异,种子消毒前的带菌率最高为40.70%,真菌分离率最高为87.50%;消毒后带菌率最高为10.70%;真菌分离率最高是25%。本试验结果表明,不进行表面消毒处理的燕麦种子带菌率可高达100%,而经过表面消毒后种子带菌率显著降低(最高为19%),这说明表面消毒处理能够抑制某些真菌的生长,显著减少种子的带菌率。有研究[32-33]表明,未消毒的干种子含水量通常很低,不能满足某些真菌的生长条件,会影响某些真菌的检出,本研究也证实了这一点,不经表面消毒样品携带的真菌有12属28种,消毒样品携带的真菌有8属12种,其中消毒种子中携带的节菱孢菌和藜生链格孢没有在未消毒种子上检测到,这很可能跟这2种菌需要较多的水分才能生长有关,因对不消毒的燕麦干种子直接进行带菌检测,会使一些对湿度要求较高的真菌不能很好地生长。先米西努尔·肉孜等[34]研究表明,枝孢霉(Cladosporiumsp.)、粘鞭霉(Gliomastixmurorum)和簇孢匐柄霉(Atemphyliumbotryosum)等真菌仅在消毒种子上检测到,而桃色拟青霉(Paecilomycespersicinus)、根腐离蠕孢(Bipolarissorokiniana)和高大毛壳(Chaetomiumelatum)等真菌在消毒处理的种子中未检测。本研究中葱链格孢、冻土毛霉和芦竹节菱孢等菌种仅在未消毒的种子中分离到,推测可能与该类菌对表面消毒剂次氯酸钠比较敏感而失去活性有关。这与垂穗披碱草[19]种子和三叶草(Trifoliumsubterraneum)[35]种子的带菌研究结果类似,认为种子经次氯酸钠表面消毒后会影响某些真菌的分离效果,降低分离真菌的多样性。
本试验结果表明,燕麦种子携带的真菌多为链格孢属和青霉菌属等腐生真菌。多数情况下,这些腐生菌可在潮湿的环境中迅速繁殖,甚至侵入种子内部使种胚死亡,降低发芽率或造成出苗前的烂种和烂根[36-38],而且大多数腐生菌的寄主范围都非常广泛,可以通过侵染田间杂草完成其生活史或者越冬,在适宜条件下发生病原菌的再次传播,成为病害的初侵染源[39-41]。但种子在贮藏过程中所产生的腐生真菌并不都是致病菌,本文检测到的种带真菌是否具有致病性,还需要进一步根据柯赫氏法则进行验证。
4 结论
同一品种在不同产地的带菌率、带菌种类和分离率差异显著,不同品种在同一产地的带菌情况也存在明显差异,甘肃华家岭燕麦种子消毒前后的带菌率都较高于河北张北的种子,其中葱链格孢、离生青霉和多孢枝孢等真菌仅在甘肃华家岭种样中检出;而赤曲霉、棒囊壳菌和橘灰青霉等仅存在于河北张北的种样中。种子是否经表面消毒对其带菌情况也有显著影响,未消毒种子带菌率明显高于消毒种子,消毒处理会影响某些真菌的检出。
