一种侧流试纸结合FAM重组酶聚合酶扩增(RPA)诊断布鲁氏菌感染的方法
2019-11-05葛志毅周建华尚佑军李学瑞刘永生孙晶晶曹小安
葛志毅,周建华,尚佑军,李学瑞,刘永生,赵 鹭,孙晶晶,曹小安
布鲁氏菌病(Brucellosis)简称布病,是由布鲁氏杆菌(Brucella)引起的细菌性人兽共患病,有急性,亚急性和慢性几种形式[1]。其病原布鲁氏菌为革兰氏阴性兼性细胞内寄生菌[2],可由口、鼻、咽喉、结膜等途径侵害易感动物,造成妊娠母畜流产、死胎,及公畜睾丸炎等主要症状,同时伴有发热、关节疼痛、淋巴结肿大等症状,对养殖业发展造成了巨大经济损失。同时作为一种典型的人兽共患病,对人类的健康也存在着极大的威胁[3]。
目前实验室布鲁氏菌病主要诊断技术为血清学检测和PCR检测,血清学检测由于抗原蛋白分离纯化的不同,其检测抗体不同,易与其他检测结果出现分歧[4];PCR 检测是目前有效的检测方法,已经发展出多种PCR检测方法,如多重PCR、实时荧光定量PCR等,具备特异性高、检测快速等优点,但是由于各种PCR结果判断标准的不同,还是存在着一定的误差。本实验所研究的方法为布病检测提供了新的方法,增加了检测的多样性,同时该方法只需要在恒温器中加入基因组短暂扩增后,取扩增产物在侧流试纸上进行检测即可。该方法相比于传统RPA扩增产物荧光检测而言[5],更加方便,使得野外田间检测成为一种可能。
1 材料与方法
1.1实验试剂及仪器 试剂:RPA引物探针,Rehydration Buffer,RNase Inhibitor的dH2O,乙酸镁,5×Extration Buffer,TaKaRa MiNiBEST Universal Genomic DNA Extraction Kit Ver.5.0。侧流试纸购自ABINGDON HEALTH公司,其商品名为Nucleic Acid Detection-Nucleic Acid Detection-PCRD。仪器:恒温扩增仪、单道移液器、涡旋器,小型离心机。
1.2基因组提取 基因组提取参照TaKaRa MiNiBEST Universal Genomic DNA Extraction Kit Ver.5.0试剂说明书提取,主要原理是对组织进行研磨裂解,利用无水乙醇,Buffer RWA和Buffer RWB洗脱去除杂质,离心洗脱DNA。其中特异性实验中细菌基因组提取不需要组织研磨,只需将菌液离心后按照后续步骤继续提取即可,同时标准布鲁氏杆菌基因组为实验室保存的M5基因。具体方法参考试剂说明书。
1.3引物与探针 根据布鲁氏杆菌的特异基因为omp25(Accession:AY484523.1)保守序列设计引物与探针,具体见表1。
表1 针对布鲁氏杆菌特异基因的保守序列设计的引物与探针
Tab.1 Primers and probes designed for conserved sequences of Brucella-specific genes

引物/探针名称 引物/探针序列RPAFggtgttgaaggtgatgcaggttattcctgggccaaRPARbiotin-ccgcaataccagccgtgaggtacggcataacRPA-oligoFAM-ggcctggaagtcaagcagggctttgaaggctc(THF)ct-gcgtgcccgcgtcgg-C3space
1.4RPA侧流试纸反应条件的优化 RPA加样体系:上、下游引物(10 μmol/L)各2.1 μL,RPA探针(10 μmol/L)0.6 μL,Rehydration Buffer 29.5 μL,RNase Inhibitor的dH2O 11.2 μL,DNA样本2 μL,混合后加入RPA酶管中震荡混匀,再加入2.5 μL的乙酸镁在加热器上反应,反应后取扩增产物侧流试纸检测。
1.4.1最佳反应温度确定 加样完成后,分别取标准阳性M5和沙门作为阴性的样品在36 ℃、38 ℃、40 ℃ 3个温度条件下反应,反应时间为常规标准的10 min,反应后取扩增产物侧流试纸检测。
1.4.2最佳反应时间确定 同样加样完成后,分别取标准阳性M5和沙门作为阴性的样品在5~30 min范围内反应,(阳性分别设置5 min、10 min、20 min 3个时间梯度,阴性分别设置10 min、20 min、30 min 3个时间梯度),反应温度为常规温度38 ℃[6],反应后取扩增产物侧流试纸检测。
侧流试纸检测加样体系为:取6 μL扩增产物,加入84 μL的5×Extration Buffer,充分混匀后,取75 μL滴至侧流试纸反应孔中,10 min内读取结果。
1.5特异性实验 分别用沙门氏菌、大肠杆菌、衣原体、肠球菌、金色葡萄球菌以同样基因组提取试剂盒以同样的方法提取基因组,加入体系以最优反应条件扩增,反应结束后用侧流试纸检测,验证引物与探针的特异性。
1.6敏感性实验 用布鲁氏杆菌的M5基因组作为RPA的标准品,以10倍的梯度稀释,加入体系以最优反应条件扩增,反应结束后用侧流试纸检测,来验证引物与探针的敏感性,布鲁氏杆菌的M5基因组的初始浓度为4×104基因拷贝/μL(通过QPCR定量获得)[7],阴性对照为沙门氏菌基因组。
1.7临床验证 检测104份样品,37份为绵羊乳汁提取DNA,67份为羊组织提取DNA,经过QPCR检测,63个阳性,41个阴性(扩增没有Cq值),用RPA侧流试纸进行检测,验证其与QPCR检测结果的符合率。
2 结 果
2.1 RPA侧流试纸反应条件的优化
2.1.1最佳反应温度的确定 按照上述方法进行检测,侧流试纸结果表明M5阳性样品在36 ℃就能出现阳性条带,38 ℃时阳性条带很明显,40 ℃同样明显。而阴性样品检测结果显示在36 ℃,38 ℃条件下只出现质控带,不出现任何阳性条带,但是在40 ℃条件下,会出现一条很弱很弱的阳性条带。实验结果如图1所示。

In the test results from top to bottom on the left is the M5,36℃,38℃,and 40℃; From top to bottom on the right is a salmonella 36℃,38℃,and 40℃.图1 最佳反应温度实验侧流试纸检测结果Fig.1 Lateral flow test strips detect results of the optimal reaction temperature experiment
综合考虑,为了充分保证实验特异性,避免假阳性出现,以38 ℃为最佳反应温度。为了进一步说明实验结果的真实性,对不同温度的RPA扩增产物进行核酸电泳,其结果与侧流试纸结果一致,在100~200 bp之间,阳性38 ℃和40 ℃有一条很明显条带,阴性40 ℃有一条很浅的条带。实验结果如图2所示。
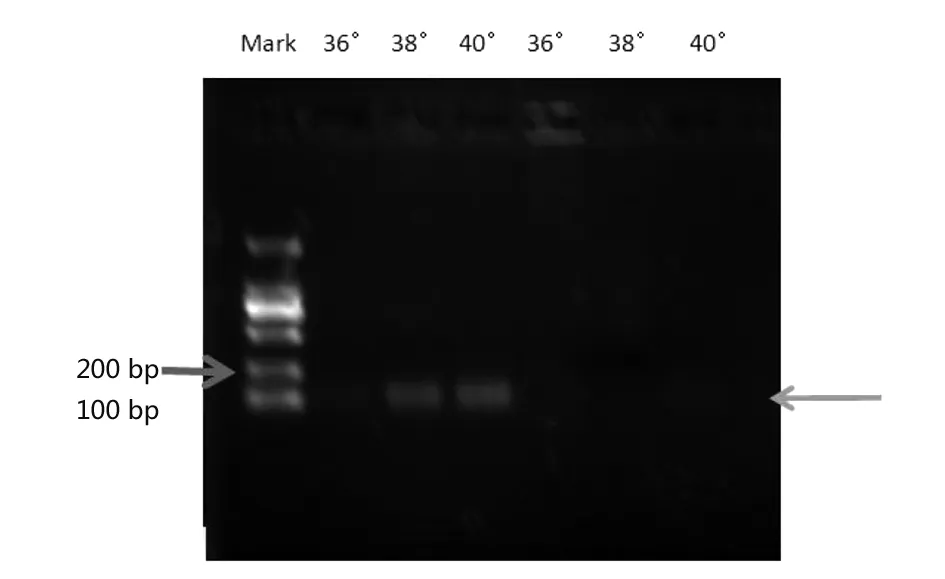
Note:From left to right is the Mark,M5 36℃,38℃,and 40℃, salmonella 36℃, 38℃,and 40℃.图2 最佳反应温度实验核酸电泳结果Fig.2 Nucleic acid electrophoresis detect results of optimum reaction temperature experiment
2.1.2最佳反应时间的确定 同样按照上述方法进行检测,侧流试纸结果表明M5阳性样品在10 min就能出现明显阳性条带,20 min同样如此。阴性样品检测结果显示在10 min内只出现质控带,而20 min和30 min时有一条很弱的阳性条带。综合考虑,还是以最大程度保证特异性为主,避免假阳性的存在,以反应时间10 min作为最佳反应时间。同样用核酸PCR检测扩增产物进行佐证,其结果与侧流试纸检测结果一致,结果如图3所示。因此,本实验为了确保最大程度检测出阳性样品,同时避免阴性样品出现假阳性情况,将反应条件38 ℃ 10 min作为最佳反应条件。
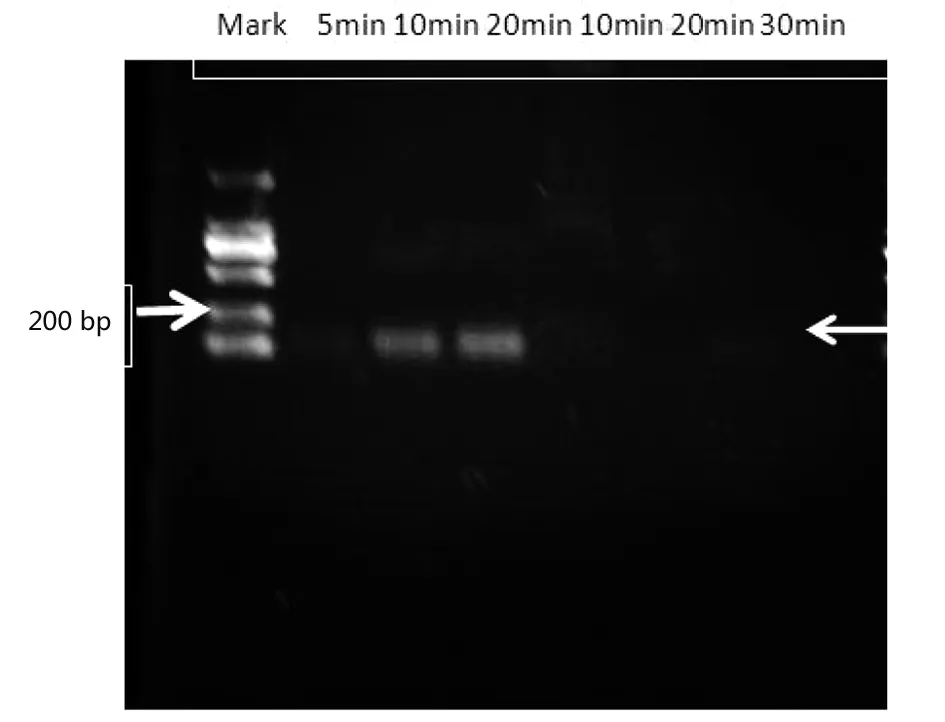
Note:From left to right is the Mark,M5 5 min,10 min, and 20 min, salmonella 10 min, 20 min, and 30 min.图3 最佳反应时间实验核酸电泳检测结果Fig.3 Nucleic acid electrophoresis detect results of optimum reaction time experiment
2.2特异性实验 特异性实验结果表明:滴加至侧流试纸10 min内,只有M5阳性出现明显阳性条带,其他菌株及阴性均只出现质控条带,证明引物和探针存在高度特异性。同样对其扩增产物进行核酸电泳,结果与侧向流动试纸检测结果一致。
2.3敏感性实验 敏感性实验结果表明:将标准DNA稀释到10-4后(80个基因拷贝数),侧流试纸仍有一条可见阳性带,而到了10-5后(8个基因拷贝数),阳性条带已经很弱,所以其敏感性以达到10-4(80个基因拷贝数)为准,存在良好的敏感性。同样扩增产物电泳,结果与侧向流动试纸检测结果一致。
2.4临床验证 用QPCR检测了104个不同样品,63个阳性,41个阴性(扩增没有Cq值),部分检测结果如图4所示。
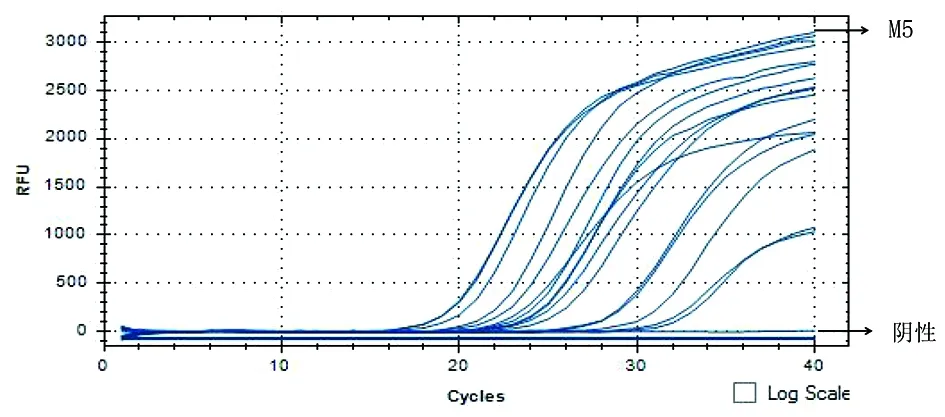
图4 QPCR部分检测样品结果Fig.4 Partial results of QPCR detection of samples
对这些样品进行RPA扩增,侧流试纸进行检测,其检测结果为75个阳性,29个阴性,总的检测结果统计如表2所示。
可知QPCR检测出63份阳性,41份阴性;RPA检测出75份阳性,29份阴性,即所有样品中63份两种方法检测结果都为阳性,29份两种检测方法结果都为阴性,但部分QPCR检测为阴性的样本RPA检测结果为阳性,RPA对临床样本的检查更加敏感。
表2 两种方法检测结果统计
Tab.2 Test results of the two methods
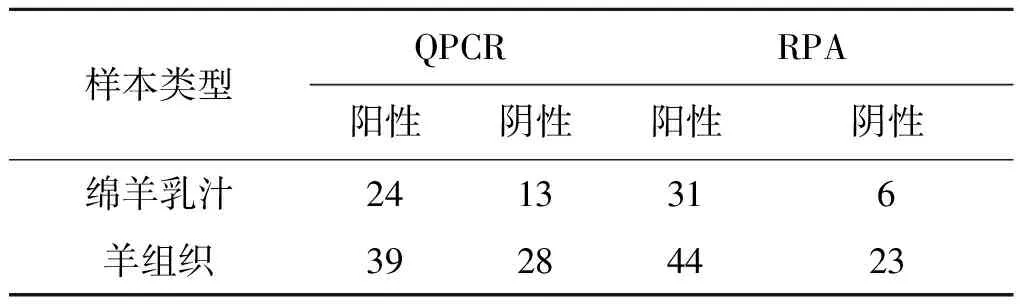
样本类型QPCRRPA阳性阴性阳性阴性绵羊乳汁2413316羊组织39284423
3 讨 论
布鲁氏菌病一直以来对我国的养羊业、养牛业造成很大的经济损失,同时其作为一种重要的人兽共患病,严重威胁着牧民、养殖户以及相关科研工作人员的健康安全。对其检测和防控一直以来是一个主要的课题,目前,实验室布鲁氏病主要检测诊断技术为血清学检测和PCR检测,两种检测方法各有优缺点。本实验所研究的方法为布病检测提供了新的方法,增加了检测的多样性。
本实验旨在提供一种新的布病快速检测方法,同时为野外田间检测提供一种可能,通过反应体系条件优化,特异性实验,敏感性实验以及与临床QPCR检测比较,最终确定该方法。平时只需要配置好RPA扩增体系,分装到小管中,检测时只需加入样本DNA和醋酸镁,恒温器38 ℃反应10 min后,混入侧流试纸体系中,取适量加入侧流试纸读取结果即可,这为田间检测提供了一种可能。
本实验在不同反应温度、不同反应时间内判断最佳反应结果,设计特异性,敏感性实验及临床验证实验,最终确定该方法。需要指出的是,加样体系是目前最常规的加样体系,对实验结果不会有太大影响,无需过多调整,最主要的是反应体系调整,反应时间和温度的不同往往会影响到实验的结果,出现假阳性的情况,所以确定一个最适的反应条件至关重要。本实验确定最佳反应时间和最佳反应温度时,是以考虑最大程度保证阳性样本的检出,同时避免假阳性的出现为准,因此本实验具有很强的特异性,但是同时也造成敏感性不是特别高,同时检测样品时有出现漏检的情况,因此可以根据实际情况调整反应条件,同时注意样品体系的充分混匀。
本方法特异性强,操作简单、快速、不过多依赖实验仪器,提供了一种新的布病快速检测方法,同时为田间布病检测提供一种可能,但是实验规程标准化方面还需要进一步完善。
利益冲突:无
