不同氧浓度下C2C12细胞的Nrf2抗氧化系统对H2O2刺激的反应*
2019-11-05姬卫秀
姬卫秀, 张 缨
(1.北京体育大学, 北京 100084; 2.天津体育学院, 天津 301617)
众所周知,模拟低氧训练或高原训练可以提高运动员骨骼肌的耐力水平。有研究显示,人和大鼠在低氧耐力训练后,骨骼肌中氧化物的产生减少,抗氧化酶表达增加,其效果比常氧训练更佳[1]。这些结果暗示,运动耐力的提高至少部分与低氧引起的骨骼肌抗氧化能力增强有关。然而,不同氧浓度的低氧环境刺激可能对骨骼肌氧化还原状态影响不同。已有研究发现,不适宜的低氧刺激,可诱发机体骨骼肌的氧化损伤,引起骨骼肌超微结构的改变,而适宜氧浓度的低氧刺激提高其抗氧化能力,降低脂质过氧化水平[2]。不同氧浓度的低氧环境下如何影响骨骼肌的抗氧化作用机制,目前并不十分清楚。
转录因子NF-E2相关因子(NF-E2-related factor 2,Nrf2)是细胞氧化应激反应中的关键转录因子。在正常生理状态下,Nrf2与Keapl耦联,被锚定于胞浆中,使Nrf2处于抑制失活状态。缺氧时,细胞线粒体代谢异常, “电子漏”增加,使活性氧(reactive oxygen species,ROS)生成大量增加,使细胞处于氧化应激状态。当受到外界氧化应激刺激后,Keap1蛋白的构象会发生一些变化,使得与Nrf2的偶联作用发生解离,Nrf2转位进入细胞核,与核内的小分子Maf蛋白形成杂化二聚体,然后与DNA序列上的抗氧化反应元件(antioxidant response element,ARE)结合, 启动下游抗氧化酶基因如超氧化物歧化酶1(superoxide dismutase 1,SOD1)、超氧化物歧化酶2(superoxide dismutase 2,SOD2)、过氧化氢酶(catalase,CAT)、醌氧化物还原酶(NADPH: quinine oxidoreductase-1,NQO-1)、血红素氧化酶(heme oxygenase-1,HO-1)、谷胱甘肽过氧化物酶1(glutathione peroxidase-1,GPX-1)等的转录,成为许多抗氧化基因的开关[3]。
Nrf2-ARE介导的抗氧化信号通路,目前被认为是细胞抗氧化防御系统的核心部分[4]。对低氧敏感的盲鼹鼠的基因检测发现,Nrf2与低氧适应密切相关[5]。在不同氧浓度下的C2C12细胞中Nrf2介导的抗氧化系统发挥怎样的作用,目前并未见相关报道。因此,本研究采用小鼠骨骼肌C2C12细胞系,在常氧和不同氧浓度低氧环境中培养,探讨不同氧浓度下C2C12细胞中Nrf2介导的抗氧化系统对H2O2刺激反应的变化,为低氧在生活中的应用和低氧训练提高运动员成绩提供理论依据。
1 材料与方法
1.1 试剂与设备
小鼠骨骼肌卫星细胞系(C2C12细胞),国家实验细胞共享平台北京总部; CellTiter 96 Aqueous One Solution Cell Proliferation Assay(G3580)试剂盒, Promega公司;抗荧光淬灭封片剂,中杉金桥,ZLI-9557; BCA Protein Assay Reagent,美国Thermo Scientific公司;Bolt 4%~12% Bis-Tris Plus凝胶,美国life technologies公司;NuPAGE MOPS SDS(20×)电泳缓冲液,美国life technologies公司;TaKaRa MiniBEST Universal RNA Extraction Kit,Cat#9767; SYBR Green Realtime PCR Master Mix,Toyobo公司; GENMED的ROS试剂盒,GMS10016.1。
常氧恒温培养箱,日本 SANYO 公司;荧光共聚焦显微镜,德国LeicaSP8;iBlot 2转膜仪,美国Invitrogen公司;BIO-RAD凝胶显影仪;荧光定量PCR仪,美国ABI7500。
1.2 C2C12 细胞培养
小鼠骨骼肌卫星细胞系(C2C12细胞)购于国家实验细胞共享平台北京总部。细胞复苏后,加入在含有10%胎牛血清的DMEM高糖培养基(青霉素106U/ml,链霉素100 U/ml),置于37°C、5%CO2的常氧恒温培养箱。两天换液一次,待细胞生长至融合度为80%~90%时, 用0.25%胰蛋白酶进行消化1 min后,用含血清的培养基终止消化,轻轻吹打,置于显微镜下观察均为单个细胞后,进行传代至3代后,进行正式实验。本实验在北京体育大学教学实验中心细胞培养实验室完成。
1.3 H2O2浓度及作用时间的选择
取对数期的C2C12细胞,消化后吹打制备成单细胞悬液,接种于96孔细胞培养板,接种密度约为2.5×105cells/ml,置于37°C、5%CO2的常氧恒温培养箱24 h后,弃旧培养基,PBS清洗每孔,将细胞分为7组,每组复孔8个,其中对照组不做任何处理,继续用10%的完全培养基培养,其余6组分别加入含不同浓度H2O2的(0.1 mmol/L、0.25 mmol/L、 0.5 mmol/L、0.75 mmol/L、1 mmol/L、2 mmol/L)完全培养基,100 μl/孔,置于37°C、5%CO2常氧恒温培养箱中孵育。经1和2 h后分别取一块96孔细胞培养板测细胞活力。
使用Promega公司CellTiter 96 Aqueous One Solution Cell Proliferation Assay(G3580)试剂盒测细胞活力。具体操作如下:细胞经过一定时间的处理后,将其细胞培养基吸出,用PBS清洗两次,加入含MTS的完全培养基,置于37°C、5%CO2常氧恒温培养箱中培养1 h,用酶标仪在490 nm下测每孔的OD值。
1.4 不同氧浓度条件下C2C12细胞对H2O2刺激的实验设计
在现有实验条件下,将细胞分为不同氧浓度组,即21%、12%、8%和5%O2组。将处于对数期生长的C2C12细胞,按2.5×105cells/ml的密度接种于培养皿或细胞培养板上,每组复孔8个,待细胞融合度达到约80%时,转移入氧浓度分别为21%、12%、8%和5%的37°C、5%CO2的恒温培养箱中进行继续培养。待8组细胞各自培养12 h后,弃掉旧培养基,PBS清洗2次,加入含有0.5 mmol/L的H2O2完全培养基作用1 h后,收集细胞或继续进行其他测试。
1.5 测试指标及方法
1.5.1 培养C2C12细胞免疫荧光 取出已爬好细胞的玻璃底培养皿,常温PBS洗3次,用4%的多聚甲醛固定30 min,PBS洗3次,0.5% Triton X-100(PBS配制)室温通透5 min,在小皿中间加入BSA(2.5%,PBS稀释)封闭液,室温封闭30 min后,加入一抗(Nrf2,sc-365949,Santa Cruz),放入湿盒,4℃过夜。第2日,去除一抗,加入荧光二抗(兔抗鼠bc-0296R-AF488,博奥森),避光室温孵育30 min,PBS避光洗3次后,吸干液体,加入含DAPI的抗荧光淬灭封片剂,盖上盖玻片,在荧光共聚焦显微镜下观察采集图像。
为了确保基层农村河道清淤施工的质量,在确定清淤施工所用施工技术的基础上,需要做好必要的施工准备工作,为后续的施工奠定良好条件。具体准备工作要点如下,一是做好施工布置。要本着因地制宜、经济合理和可靠安全等原则,立足于基层农村河道清淤的实际情况,严格依据施工招标文件等来做好施工布置工作。二是组织设计单位、建设单位及监理单位等做好水准点和控制点等的施工测量与放样工作,确保相关淤泥清除表面标高等控制的准确性。三是要做好河道清淤施工中所用设备的良好运行和维护管理,确保设备运行状态良好,为后续的河道清淤奠定良好的施工基础。
1.5.2 Nrf2蛋白表达的Western blot检测 对提取的蛋白进行BCA蛋白浓度测定,根据浓度计算配样,上样量为10 μg。采用Bolt 4%~12% Bis-Tris Plus凝胶和NuPAGE MOPS SDS(20×)电泳缓冲液进行电泳。用iBlot 2将蛋白从电泳凝胶转移至NC膜。目的条带标记后用5%的脱脂牛奶或BSA封闭1 h后,进行一抗孵育:Nrf2(sc-722,1∶200)、总蛋白内参β-actin(sc-47778,1∶1 000),于4°C摇床孵育过夜。次日洗脱一抗后进行二抗孵育1 h:Nrf2(羊抗兔,中杉金桥,ZB-2301,1∶2 000)。最后洗脱二抗后加发光液用BIO-RAD凝胶显影仪器进行显影,用其配套软件进行条带检测与分析。读取灰度值,计算结果,公式如下:

1.5.3 培养C2C12细胞相关基因表达的RT-PCR检测 采用TaKaRa公司的试剂盒(TaKaRa MiniBEST Universal RNA Extraction Kit,Cat#9767)提取细胞RNA。按照反应体系为65℃,5 min; 37℃,15 min; 98℃,5 min的反应体系进行逆转录成cDNA。然后取2 μl cDNA加入荧光染料反应体系(Toyobo公司,SYBR Green Realtime PCR Master Mix)及一定量的引物,采用荧光定量PCR仪,进行实时荧光定量PCR,其中引物分别为Nrf2(QT00095270)、SOD1(QT00165039)、SOD2(QT00161707)、CAT(QT01058106)、NQO-1(QT00094357)、HO-1(QT00159915)、GPX-1(QT01195936)、18S rRNA (QT010036875)反应完成后使用PCR仪自带的软件对实时荧光定量CT值进行读取,用比较 CT 法对目的基因表达结果进行相对定量。具体计算公式如下:
目的基因=2-△△CT
1.5.4 培养C2C12细胞产生ROS测定 采用GENMED的试剂盒(GMS10016.1)产地公司测定细胞产生的ROS,实验操作严格遵循试剂盒说明书进行。
1.6 统计学处理
2 结果
2.1 H2O2浓度及作用时间的选择
采用独立样本t检验比较与对照组之间细胞活力的差异,得知:H2O2作用于C2C12细胞1 h,浓度为0.5 mmol/L,0.75 mmol/L,1 mmol/L,2 mmol/L中的C2C12细胞活力均出现显著性降低(P<0.05,表1);将H2O2作用时间延长到2 h,与对照组相比,H2O2浓度为0.5 mmol/L时,C2C12细胞活力即出现非常显著降低(P<0.01),且随H2O2浓度的升高C2C12细胞活力出现急剧降低。综合比较,选择H2O2作用时间相对较短的1 h组中,浓度0.5 mmol/L,作为本实验的H2O2刺激。


Group1H2HControl0.869±0.1020.997±0.1170.1 mmol/L0.864±0.0960.812±0.148∗∗0.25 mmol/L0.783±0.1670.735±0.126∗∗0.5 mmol/L0.663±0.111∗∗0.679±0.229∗∗0.75 mmol/L0.652±0.050∗∗0.403±0.075∗∗1 mmol/L0.746±0.108∗0.358±0.061∗∗2 mmol/L0.649±0.078∗∗0.304±0.033∗∗
1H: cell cutured in H2O2for 1 hour; 2H: Cell cutured in H2O2for 2 hours; 0.1 mmol/L: H2O2concentration was 0.1 mmol/L; 0.25 mmol/L: H2O2concentration was 0.25 mmol/L; 0.5 mmol/L:H2O2concentration was 0.5 mmol/L; 0.75 mmol/L: H2O2concentration was 0.75 mmol/L; 1 mmol/L: H2O2concentration was 1 mmol/L; 2 mmol/L: H2O2concentration was 2 mmol/L
*P<0.05,**P<0.01vscontrol group
2.2 不同氧浓度下C2C12细胞对H2O2刺激的Nrf2蛋白免疫荧光的影响
由图1可知,21%O2组C2C12细胞Nrf2蛋白(绿色)主要位于细胞核(蓝色)外的胞浆。与21%O2组相比,12%O2组C2C12细胞Nrf2蛋白荧光强度高,8%O2组细胞Nrf2蛋白荧光无变化,5%O2低氧组的细胞Nrf2蛋白荧光弱。说明,氧浓度不同细胞Nrf2蛋白表达量不同(图1见彩图页Ⅱ)。

2.3 不同氧浓度下C2C12细胞对H2O2刺激的Nrf2 mRNA和蛋白表达的影响


GroupNrf2 mRNA/18S rRNANrf2 protein/β-actin21%O21.000±0.2071.005±0.15212%O21.394±0.486∗1.321±0.407∗8%O21.178±0.4191.031±0.2155%O20.740±0.210∗0.729±0.274∗
21%O2; Concentration of O2was 21%; 12%O2; Concentration of O2was 12%; 8%O2; Concentration of O2was 8%;5%O2; Concentration of O2was 5%; Nrf2: NF-E2-related factor
*P<0.05vs21% O2group
12%氧浓度低氧可促进Nrf2表达,5%氧浓度低氧则会抑制Nrf2表达。
2.4 不同氧浓度下C2C12细胞对H2O2刺激的抗氧化酶mRNA表达的影响
由表3可知,与21%O2组相比,12%O2组C2C12细胞抗氧化酶SOD1(P<0.05)、SOD2(P<0.01)、CAT(P<0.05)、NQO-1(P<0.05)、HO-1(P<0.05)、GPX-1(P<0.01)的mRNA显著增加;8%O2组细胞抗氧化酶SOD1、SOD2、CAT、NQO-1、HO-1 mRNA略有增加但均无显著性变化,只有GPX-1(P<0.05)mRNA显著增加;而5%O2组细胞抗氧化酶SOD1(P<0.05)、SOD2(P<0.01)、NQO-1(P<0.01)、GPX-1(P<0.01)的mRNA则显著降低,CAT和HO-1 mRNA无显著变化。说明,12%氧浓度低氧可促进Nrf2介导的下游抗氧化酶mRNA表达,5%氧浓度低氧则对抗氧化酶mRNA表达具有抑制作用。
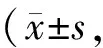
Tab. 3 Changes of the mRNA relative expressions of antioxidant enzyme in cells of each group n=8)
21%O2: Concentration of O2was 21%; 12%O2: Concentration of O2was 12%; 8%O2;Concentration of O2was 8%; 5%O2: Concentration of O2was 5%; SOD1: Superoxide dismutase 1; SOD2: Superoxide dismutase 2; CAT: Catalase; NQO-1: NAD(P)H: quinine oxidoreductase-1; HO-1: Heme oxygenase-1; GPX-1: Glutathione peroxidase-1
*P<0.05,**P<0.01vs21%O2group
2.5 不同氧浓度下C2C12细胞对H2O2刺激的ROS水平的影响
由表4可知,与21%O2组相比,12%O2组C2C12细胞ROS水平非常显著性降低(P<0.01),8%O2组细胞ROS水平无显著性变化,5%O2组的细胞ROS水平则非常显著升高(P<0.01)。


GroupROS (fluorescence intensity)21%O2103468.9±3635.512%O265987.8±15168.0∗∗8%O2125976.7±26214.25%O2116144.5±5085.0∗∗
21%O2: Concentration of O2was 21%; 12%O2: Concentration of O2was 12%; 8%O2: Concentration of O2was 8%; 5%O2: Concentration of O2was 5%; ROS: Reactive oxygen species
**P<0.01vs21%O2group
3 讨论
低氧引起自由基的产生增多,激活抗氧化酶活性,低氧预适应可上调抗氧化酶等基因的表达,从而预防因缺氧而导致的损伤。对人类细胞实验发现,绒毛外滋养层细胞在10%氧浓度低氧条件下24 h,Nrf2 mRNA表达显著升高[6];癌细胞在极限低氧环境(氧浓度小于0.05%)出现Nrf2蛋白表达增加,Keap1表达降低[7]。SD大鼠在氧浓度为6%的低氧环境中暴露1 h和低氧暴露后又复氧均可增加其脑部微血管Nrf2的易位[8]。研究发现,低氧刺激可使人血液中SOD、GSH-PX、CAT等抗氧化酶基因的表达量增加,且世居高原者血液中抗氧化酶SOD水平较世居平原者高[9]。在细胞实验中也发现,小鼠视网膜神经节细胞RGC-5在化学性低氧后,抗氧化酶SOD和CAT mRNA表达增加[10]。在本研究中,12%氧浓度低氧处理C2C12细胞12 h后,细胞Nrf2 mRNA和蛋白表达水平升高,下游抗氧化酶SOD1、SOD2、CAT、NQO-1、HO-1和GPX-1的mRNA表达量也均显著增加,C2C12细胞ROS水平则出现非常显著降低。表明12%氧浓度低氧可以刺激C2C12细胞Nrf2表达增加。Nrf2的表达增加,可能使Nrf2转位入核增加,与ARE结合作用增强,进而使下游抗氧化酶的转录水平提高,mRNA表达水平上调,抗氧化作用增强,对细胞内自由基的清除能力增强,最终使得C2C12细胞ROS水平降低。说明C2C12细胞可能为了对氧浓度为12%的低氧环境产生适应,发生了一系列代偿性反应,对细胞产生了一种保护作用。
有人发现,10%氧浓度低氧处理大鼠心肌H2C9细胞4 h,细胞死亡率基本无变化[11]。SD大鼠在模拟海拔高度5 000 m低压氧舱中持续暴露4周,心肌中抗氧化酶SOD活力也未发生显著性变化[12]。而在本研究中氧浓度为8%的低氧刺激,对C2C12细胞Nrf2 mRNA和蛋白表达变化影响不大,对其下游抗氧酶的表达也基本无影响,只有GPX-1的mRNA表达增强,且细胞ROS水平也未发生显著变化。说明在本实验中的8%O2对C2C12细胞的Nrf2抗氧化系统影响不大,可能由于C2C12细胞对氧浓度为8%的低氧刺激不敏感,或者可能已发生了耐受作用,产生了适应,故Nrf2抗氧化系统未发生显著变化。
陈然发现,SD大鼠在氧浓度为5%的低氧舱中,间歇低氧作用3周后,主动脉和肾组织胞浆、胞核中Nrf2蛋白的表达均显著下调[13]。人类绒毛外滋养层细胞在3%氧浓度低氧条件下24 h,Nrf2 mRNA表达显著降低[6]。HT22细胞在氧浓度2.5%低氧处理24 h后复氧,其细胞核内Nrf2蛋白表达降低[14]。有报道指出,在1%氧浓度低氧下,骨骼肌细胞系横纹肌肉瘤细胞中抗氧化酶GSH、SOD、CAT、GST、GPx的蛋白表达非常显著性降低[15]。视网膜神经节转化细胞RGC-5在5%氧浓度低氧中培养,抗氧化酶GSH含量明显降低,MDA显著升高[16]。成人心肌细胞经1%氧浓度低氧处理后,ROS水平也显著升高[17]。本研究中,C2C12细胞在氧浓度为5%的低氧环境中Nrf2 mRNA和蛋白表达均降低,抗氧化酶SOD1、SOD2、NQO-1和GPX-1的mRNA表达量也出现显著下降,细胞ROS水平则呈现显著增加。氧浓度5%的低氧抑制了C2C12细胞Nrf2的表达,而抗氧化酶的表达随Nrf2表达的变化而发生变化,氧浓度为5%的低氧环境可能由于氧浓度太低抑制了Nrf2的表达,进而对下游抗氧化酶的表达也产生了抑制作用,使细胞抗氧化能力降低,自由基清除能力降低,细胞ROS水平升高,说明氧浓度为5%低氧可能引起了细胞氧化损伤,这可能与细胞的代谢失常或功能紊乱有关[15]。
生理条件下,机体本身也会产生自由基,但在自由基产生的同时,体内也存在着清除自由基的抗氧化酶等防御系统,两者共同发挥作用,就会使机体内自由基的生成和消除处于一种动态平衡;但是,当机体处于低氧环境中时,这种氧化和抗氧化系统间的动态平衡就有可能被打破。在本研究中,C2C12细胞处于12%氧浓度低氧时,低氧强度适宜,产生新的平衡,机体产生适应,则抗氧化能力提高;而C2C12细胞处于5%氧浓度低氧时,低氧强度过大,会使氧化和抗氧化一直处于失衡状态,最终使得机体的抗氧化能力下降。之前有研究也曾发现,Nrf2/ARE通路的激活与细胞氧化应激有关[18]。人类绒毛外滋养层细胞在10%氧浓度低氧条件下24 h,Nrf2 mRNA表达显著升高;在3%氧浓度低氧条件下,Nrf2 mRNA表达则显著降低[6]。PC12细胞在适度低氧(10% O2)24 h后,细胞数目升高,总抗氧化能力有上升趋势;而严重低氧(0.3% O2)24 h后,细胞数目显著降低,总抗氧化能力明显降低[19]。此外,实验还发现,不同细胞对不同氧浓度低氧的反应不同,其调控的机制可能也不尽相同,有待进一步研究。
综上所述,不同氧浓度下C2C12细胞中Nrf2介导的抗氧化系统对H2O2刺激反应不同,12 h的12% O2浓度可促进C2C12细胞Nrf2的抗氧化作用,而5% O2浓度的严重低氧则作用相反。
