MicroRNA对周围神经损伤施万细胞调控的研究进展
2019-11-04赵庭琪薛秋爽董姝妍郝瑞瑞赵怡文李文媛
赵庭琪,薛秋爽,董姝妍,郝瑞瑞,赵怡文,李文媛,王 莹
(1.牡丹江医学院2016级学生;2.牡丹江医学院神经组织工程研究所,黑龙江 牡丹江 157011)
MicroRNA (miRNA)是内源性的非编码RNA,长度约为22个核苷酸的RNA双转录体。miRNA调控真核细胞中的mRNA[1],首先RNA聚合酶II或III产生初级转录物(pri-miRNA),然后通过Drosha-Digeorge综合征关键区域基因8 (Drosha DiGeorge syndrome critical region gene 8,DGCR8)复合物形成前体miRNA (pre-miRNA),pre-miRNA通过结合出核转运蛋白Exportin 5输出到细胞质。最后由Dicer介导miRNA成熟,Dicer是一种III型核糖核酸酶,它介导miRNA形成22个核苷酸的双链。然后将成熟miRNA加载到RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)上,通过与靶向miRNAs的3-UTR不完全互补性结合,调节基因表达,导致mRNA翻译抑制或降解,进而调控肿瘤、细胞发育和神经系统疾病。周围神经系统由大脑和脊髓外的神经和神经节组成,施万细胞(SCs)在周围神经系统的发育和维持中发挥重要作用。在成熟周围神经中,SCs以髓鞘化和非髓鞘化形式存在[2]。SCs功能障碍或损伤能够导致脱髓鞘性神经疾病,同时丧失运动和感觉能力。SCs的突变可通过调控特定基因如髓鞘蛋白22(peripheral myelin protein22,PMP22)或髓鞘蛋白0(myelin protein zero,MPZ)功能而导致疾病[3]。神经横断或挤压损伤后,SCs发生脱髓鞘和Wallerian退行性改变。miRNA与周围神经损伤SCs密切相关[4]。现将miRNA在周围神经损伤SCs调控作用的研究进展予以综述,重点剖析其家族成员miRNA与SCs增殖和迁移的调控作用。
1 SCs的增殖和迁移
SCs增殖受血小板衍生生长因子、转化生长因子(transforming growth factor,TGF)、层粘连蛋白、Notch和神经调节蛋白1(neuregulin 1,NRG-1)的调节[5-6]。Notch和NRG-1是轴突相关信号,促进体内SCs增殖。Notch受体定位于SCs,配体存在于轴突,Notch信号通路是SCs增殖重要正调节因子,Notch信号失活显著降低SCs数量。NRG-1存在于轴突上,其受体erbB2和erbB3存在SCs中。NRG-1治疗能够刺激体外SCs增殖[5]。TGF-β治疗SCs能够增强SCs体外增殖,研究表明II型TGF受体突变小鼠SCs的DNA合成显著降低[6]。层粘连蛋白也能够促进SCs增殖,研究表明层粘连蛋白缺失的SCs中磷脂酰肌醇3(phosphatidylinositol 3,PI3)激酶活性显著降低,导致增殖活性降低[7]。生长因子刺激的磷脂酰肌醇3kinase(phosphatidylinositol 3kinase,PI3K)/Akt信号通路下游的mTORC1(mammalian target of rapamycin complex 1)通路能够促进SCs增殖。周围神经损伤后,SCs通过调节细胞外基质(extracellular matrix,ECM)和ECM底物(如纤维蛋白和层粘连蛋白)向再生轴突迁移。此外,细胞外信号相关蛋白激酶(extracellular signal-related kinase,ERK)1/2和蛋白激酶B(protein kinase B,PKB)是神经变性过程中SCs迁移的重要调节信号[8],NRG-1在神经损伤后通过erbB2和erbB3及局部黏着斑激酶(focal adhesion kinase,FAK)信号途径增强SCs迁移[1]。
2 miRNAs在周围神经SCs再生中的作用
大量研究证实miRNAs调节周围神经髓鞘形成。Dicer基因敲除小鼠抑制坐骨神经髓鞘形成,降低髓鞘关键转录因子早期生长反应蛋白2(Early growth response protein 2,EGR-2)表达水平[2]。Bremer等研究[9]发现Dicer基因敲除小鼠髓鞘化上调多种miRNA表达,包括:miRNA-34a、miRNA-146、miRNA-30a、miRNA-195、miRNA- 140、miRNA-27b和miRNA-204。研究表明在周围神经髓鞘形成过程中,microRNA基因谱有225个miRNAs表达。其中miRNA-106a、miRNA-20b、miRNA-338、miRNA-92b、miRNA-19b、miRNA-363、miRNA-350、miRNA-17和miRNA-340能够调控髓鞘基因Sox10表达[10]。
2.1 Let-7 miRNAlet-7(lethal-7)在肿瘤发生中发挥重要作用。此外,有研究表明let-7 miRNA能够通过调节神经生长因子(Nerve growth factor,NGF)表达,调控神经元细胞生长和再生[11]。研究发现在坐骨神经横断损伤1 d,近端神经中let-7c、let-7d、let-7e、let-7f、let-7i和miRNA-98表达增高,神经损伤4 d和7 d表达下降。Transwell迁移实验发现let-7模拟物转染显著抑制SCs的迁移能力。目前已经证明[11]let-7miRNA通过直接结合NGF mRNA的3-UTR进行调节NGF表达。因此周围再生过程中,let-7 miRNA能够调控SCs迁移和轴突生长。
2.2 miRNA-1坐骨神经损伤后4d、7d和14d,miRNA-1表达显著降低,而脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达显著增高,与miRNA-1呈显著负相关[4]。原代SCs中microRNA-1高表达显著抑制SCs的迁移和增殖。RNAi BDNF实验验证miRNA-1对SCs增殖和迁移抑制作用[7]。
2.3 miRNA-9miRNA-9已被证明是调节SCs迁移的重要因子[12],它对神经损伤SCs再生反应至关重要。miRNA-9高表达可以降低SCs迁移,而抑制miRNA-9表达,可通过直接靶向作用胶原三螺旋重复序列包含蛋白1(collagen triple helix repeat containing protein 1,CTHRC1),进而增强SCs迁移[12]。
2.4 miRNA148-3PmiRNA148-3P通过调节SCs迁移在周围神经再生中发挥作用[13]。miRNA 148-3P高表达能够增强SCs的迁移能力,而抑制miRNA 148-3P能够降低SCs体外迁移。此外,miRNA 148-3P通过靶向清选蛋白关联和neddylation解离1(Cullin-associated NEDD8-dissociated protein1,Cand1)增强SCs迁移,Cand1对前列腺中淋巴结癌细胞增殖具有抑制作用[13]。
2.5 miRNA-sc8应用miRNA-sc8模拟物转染能够降低SCs迁移,而沉默miRNA-sc8表达则增强SCs的增殖和迁移。此外,沉默表皮生长因子受体(epidermal growth factor receptor,EGFR)基因能够降低miRNA-sc8抑制剂对SCs增殖和迁移的增强作用[14],因此证明miRNA-sc8通过靶向EGFR基因调控SCs的增殖和迁移。
2.6 miRNA-210研究表明miRNA-210能够通过增强SCs迁移和增殖,促进周围神经再生[15]。在坐骨神经损伤后14d,miRNA-210表达水平上调。此外,miRNA-210高表达增强SCs的迁移和增殖。同时miRNA-210转染增加生长相关蛋白43(Growth associated protein-43,GAP43)的表达。因此,坐骨神经损伤后上调miRNA-210能够促进周围神经再生。
2.7 miRNA-221/222通过对坐骨神经损伤后神经近端残端miRNA表达谱芯片分析发现,神经损伤后1 d,miRNA-21、miRNA-31、miRNA-221、miRNA-222和miRNA-132表达水平显著增高[16]。原位杂交结果显示坐骨神经损伤后4 d,miRNA-221/222表达水平较高。Transwell迁移结果表明miRNA-221/222高表达能够增加原代SCs迁移能力,而miRNA-221/222抑制剂则降低SCs迁移。miRNA-221/222通过直接结合长寿保障基因2(longevity assurance homolog 2,LASS2)mRNA的3-UTR来调节SCs。因此miRNA-221/222能够通过靶向调节LASS2表达增强SC迁移[16]。
2.8 miRNA-sc3研究表明坐骨神经横断后,miRNA-sc3在受损神经中表达增高[17]。miRNA-sc3表达上调能够促进原代SCs增殖和迁移,而沉默miRNA-sc3则抑制SCs增殖和迁移。miRNA-sc3直接靶向作用Astrotactin 1(Astn1),抑制Astn1翻译,表明miRNA-sc3通过Astn1信号调控原代SCs迁移和增殖。
2.9 miRNA-132研究发现坐骨神经损伤后,miRNA-132表达上调。此外,miRNA-132促进原代SCs迁移。在低氧条件下,miRNA-132也能够促进SCs迁移,应用miRNA-132抑制剂能够抑制SCs迁移[18]。研究证明miRNA-132通过结合蛋白激酶AMP激活的非催化亚单位γ3(protein kinase AMP-activated noncatalytic subunit gamma 3,PRKAG3) mRNA的3-UTR,调节SCs迁移。
2.10 miRNA-182坐骨神经切除后miRNA-182表达增强[19]。Transwell迁移和增殖分析表明,miRNA-182高表达显著抑制原代SCs的迁移。此外,miRNA-182通过调控成纤维细胞生长因子(fibroblast growth factor 9,FGF9)和神经霉素,抑制原代SCs增殖和迁移,表明miRNA-182周围神经修复相关。
2.11 miRNA-146bLi等研究发现[20],提高miRNA-146b高表达可显著降低SCs增殖和迁移,而抑制miRNA-146b则可促进SCs增殖和迁移。miRNA-146b通过与3-UTR结合直接靶向作用KLF7,抑制KLF7表达,进而促进SCs增殖和迁移、轴突再生、髓鞘形成。
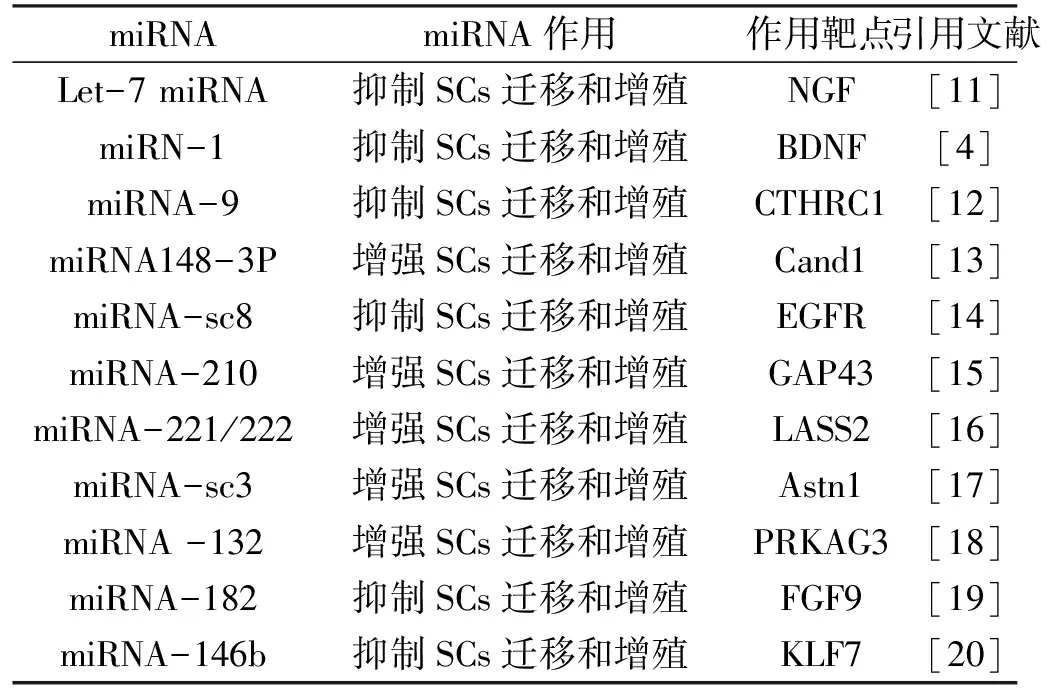
表1 miRNA对SCs调控作用
3 总结
miRNA通过调节正常状态下靶点来调控SCs的增殖、迁移和髓鞘形成。miRNA表达及其靶点改变可能导致SCs分化或神经再生功能障碍。因此,在神经发育过程和疾病状态下识别miRNA表达至关重要,这可能为治疗和诊断提供重要信息。因此,周围神经miRNA的调控可能是周围神经损伤或神经病变的潜在治疗靶点。
