我国仿制药质量和疗效一致性评价后应关注的几个问题
2019-10-28陈志东张毅张勤
陈志东 张毅 张勤
摘 要 在我国,通过质量和疗效一致性评价的仿制药(简称为“过评仿制药”)已用于临床。应关注这些过评仿制药的疗效不等、药品不良品、不良反应和不合格品等问题。
关键词 仿制药质量和疗效一致性评价 疗效不等 药品不良品 不良反应 不合格品
中图分类号:R95 文献标志码:C 文章编号:1006-1533(2019)17-0056-04
Refocus on some issues after consistent assessment of generic drugs in China
CHEN Zhidong1*, ZHANG Yi1, ZHANG Qin2
(1. Department of Pharmacy, the 6th Peoples Hospital, Shanghai Jiao Tong University, Shanghai 200233, China; 2. Department of Medical Ultrasound, Dachang Community Health Service Center of Baoshan District, Shanghai 200442, China)
ABSTRACT Many generic drugs passed consistent assessment have been clinically used in China. Some issues should be refocused on, such as therapeutic inequivalence, medical product defects, adverse drug reaction and unqualified drugs.
KEy WORDS consistent assessment of generic drugs; therapeutic inequivalence; medical product defects; adverse drug reaction; unqualified drugs
我国仿制药质量和疗效一致性评价(以下简称为“一致性评价”)要求对仿制药的组方(处方)、原辅料、制备工艺和包装材料等进行“升级”,以使仿制药的质量和疗效与原研药一致[1]。目前,部分通过一致性评价的仿制药(以下简称为“过评仿制药”)已陆续进入各级医疗机构,且在“带量采购”政策的影响下正逐渐在临床用药中占据主导地位。但通过一致性评价是通过局限于药代动力学/药效学终点生物等效性研究的一致性评价,至于过评仿制药用于疾病治疗时疗效能否与原研药一致、能否让医生和患者满意等,仍有待临床的观察与分析,因为药代动力学/药效学终点生物等效性试验与临床试验是两个完全不同的概念,无法相互替代。本文探讨对过评仿制药应关注的几个问题,供相关同仁参考。
1 过评仿制药的疗效不等(therapeutic inequivalence)
疗效是我国仿制药一致性评价的两大内容之一,也是临床最关注的结果。即使抗癌药不良反应明显、安全性相对较差,临床上注重的依旧是其疗效。表1汇总了上海市某三甲医院自2019年3月起“带量采购”的11种过评仿制药(包装盒和说明书上都印有通过“仿制药一致性评价”标志)与原研药说明书相关内容的比较结果及其通过一致性评价网上信息公示的要義。尽管其中有两种过评仿制药的说明书中列有临床试验项,但内容完全类似于原研药,而11种原研药的说明书中却有8种列有临床试验项。没有经过临床对照研究,疗效评价又从何说起。所以,近期内过评仿制药的引入或许仍难提升临床对仿制药的用药信心。与原研药相比,用于疾病治疗时,仿制药的疗效是一致、更优或不等,这只有经过临床对照研究才能得出结论。即使研究结论是与原研药疗效一致,仿制药在常规使用时也可能出现疗效不等,这在临床上并不少见。美国就曾发生过安非他酮缓释片仿制药(Budeprion XL 300 mg)与原研药(Wellbutrin XL 300 mg)的疗效不等事件[2],也曾出现过头孢呋辛仿制药(Normafenac)与原研药(Zinacef)在预防冠状动脉旁路移植术后感染时的疗效不等现象[3]。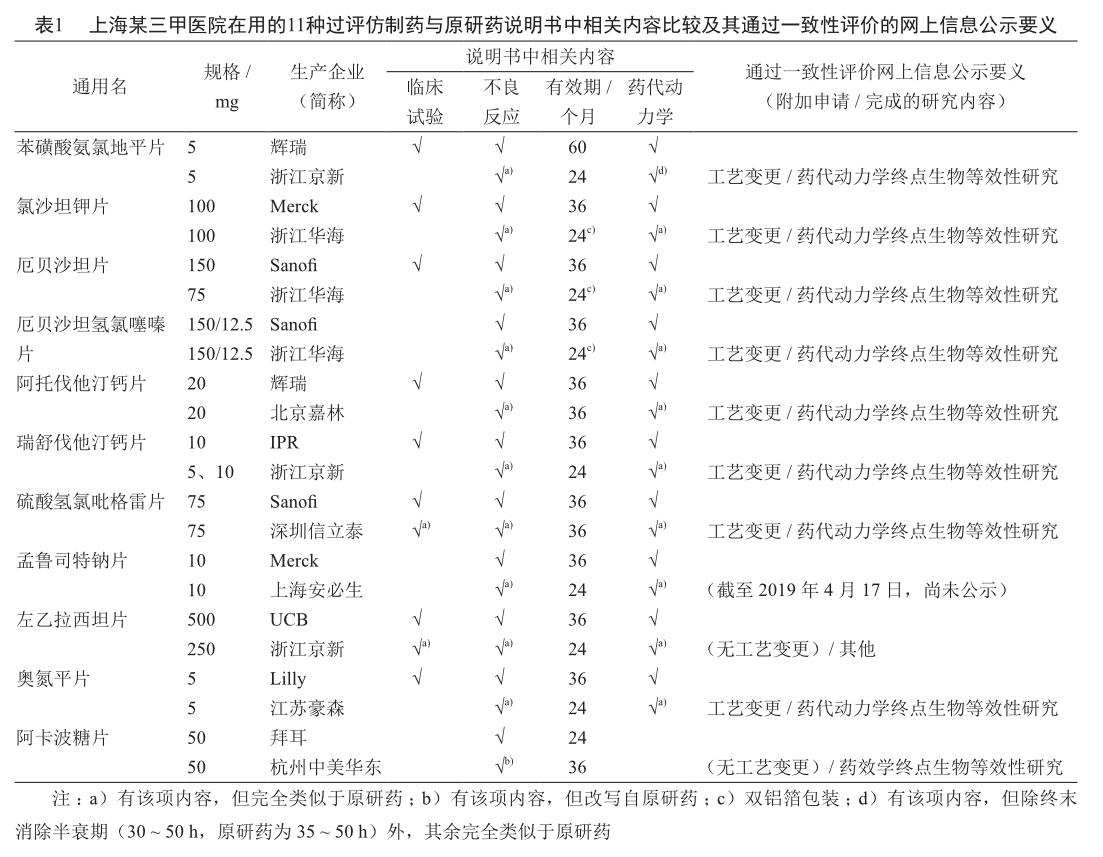
疗效不等是指具有相同主成分、剂型、剂量及给药途径的药品(包括呈现体内生物等效性的药品)在相同用药剂量及用法下产生的不相等的临床反应,这种不相等的临床反应包括疗效增强或减弱以及产生意料之外的不良反应或不良反应的强度、频率增加[4],通常发生在换用不同生产企业的相同药品或同一生产企业的不同批号药品时。疗效不等现象不仅影响疾病治疗、延误病情,且还会造成人、物、财力的浪费,甚至引发医疗纠纷,故应对疗效不等进行监测。通过收集疗效不等疑似事件并进行汇总分析,有利于及时防止疗效不等现象的蔓延。有必要从国家层面来制定相应的疗效不等监测机制,如疗效不等监测报告表设计、监测流程制定、疑似事件的评估与防控等。我国台湾地区于2009年开始建立疗效不等报告和评估机制,至2017年底共收到疗效不等报告598件[4-9],年均66件(图1中下方曲线为疗效不等的年报告件数),并于2010年确认了德国Aspen Bad Oldesloe公司生产的左甲状腺素片的疗效不等现象[4, 10]。对过评仿制药进行疗效不等的常规监测,这是发现疗效不等现象的最有效的办法。
2 过评仿制药的药品不良品(不良药品,medical product defects)
药品不良品是指有瑕疵或缺陷的药品,包括外观异常、异物混杂等[11]。医疗机构内部的药品质量监测结果显示,国内生产企业的药品不良品明显多于进口或合资生产企业的药品不良品[12-13],主要表现为药品颜色差异、变质、含有异物、破损、漏液,包装材料上无标签、无生产日期、无批号、无效期等。针对药品不良品,早在2004年国内即已有医院开始内部监测,但至今我国还缺乏国家层面的药品不良品监测机制,极不利于药品不良品的及时管控,因为假如开展药品不良品监测的医院发现了药品不良品(如某药品中含有异物),而同生产企业同批号的同药品仍在其他医院正常使用,无形中就会增加临床用药的风险或潜在造成危害。寄希望仿制药一致性评价能消除药品不良品现象并不现实,进口和合资生产企业的药品也无法避免药品不良品。建立药品不良品监测机制才能降低药品不良品给临床用药带来的风险。
我国台湾地区食品药物管理署于2004年开始委托药害救济基金会设立药品不良品报告系统,制定药品不良品报告填写原则和药品不良品报告中心工作流程,以后又按危害程度对药品不良品进行分级,如非高风险(高报告率、低报告率)、高风险(高风险A、特高风险A+)。截至2017年底,我国台湾地区共收到药品不良品报告8 644件,年均617件(图1中上方曲线为药品不良品的年报告件数)。
3 过评仿制药的不良反应
不良反应未被列入我国仿制药一致性评价内容,但事关临床用药安全,应予以关注。表1中11种过评仿制药的说明书尽管都列有不良反应项,但其中10种过评仿制药的不良反应内容完全类似于原研药,余下1种的不良反应内容也是改写自原研药,这种缺乏科学态度的做法肯定会影响临床医生、药师和患者对过评仿制药的用药信心。不同生产企业以各自不同的处方、原辅料、工艺生产的相同药品的不良反应是不可能完全一致的。国家应针对过评仿制药不良反应出台相应的监测措施,同时明确要求生产企业立即建立起自己生产的药品的不良反应监测计划,并将监测结果及时列入其药品说明书。
4 过评仿制药的不合格品
这里说的不合格品是指国家药品监督管理部门对过评仿制药进行质量抽检检出的不合格品,有别于上述使用单位或个人发现的药品不良品。表1中11种过评仿制药的有效期有8种明显短于原研药,2种相同,1种明显长于原研药,说明大多数过评仿制药的保质期不如原研药那么长。另外,我国药品的不合格品分布情况一直存在经营、使用环节明显高于生产环节的现象[14-16],提示不合格品距患者更“近”,因此也须加大对经营、使用环节的过评仿制药质量抽检力度。对此,国家药品监督管理局已明确提出,将把过评仿制药纳入下一年度药品质量抽检计划,并加大对相关企业的监督检查力度[17]。但无论是到生产企业现场检查,还是对经营、使用环节的药品抽检,都切忌形式主义,更不宜沿袭过去的事先通知的做法,让受检生产、经营、使用单位在检查/抽检前准备、检查/抽检时紧张、检查/抽检后恢复原样。此外,对查出/检出的问题应及时整改,这样才有利于过评仿制药质量的持续提升,真正降低过评仿制药的不合格品率。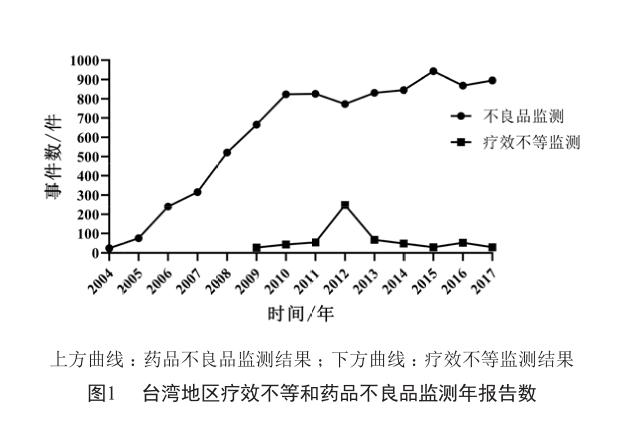
5 结语
我国仿制药一致性评价工作还刚起步,有待改进与完善。今后应提高仿制药的一致性评价标准,尽早从低标准(单项评价)向高标准(多项或全项评价)转变,力争使过评仿制药的疗效和质量取得突破性的进展甚至超越原研药,并及时将真实的评价数据列入药品说明书。对过评仿制药还应尽快建立疗效不等、药品不良品、不良反应和不合格品的监测机制。
参考文献
[1] 国务院办公厅. 国务院办公厅关于开展仿制药质量和疗效一致性评价的意见[EB/OL]. (2016-03-05) [2019-04-17]. http://www.gov.cn/zhengce/content/2016-03/05/ content_5049364.htm.
[2] FDA update: Budeprion XL 300 mg not therapeutically equivalent to Wellbutrin XL 300 mg [EB/OL]. (2012-10-03)[2019-04-17]. https://www.fda.gov/drugs/postmarket-drugsafety-information-patients-and-providers/update-bupropionhydrochloride-extended-release-300-mg-bioequivalencestudies.
[3] Mastoraki E, Michalopoulos A, Kriaras I, et al. Incidence of postoperative infections in patients undergoing coronary artery bypass grafting surgery receiving antimicrobial prophylaxis with original and generic cefuroxime [J]. J Infect, 2008, 56(1): 35-39.
[4] 陳志东. 中国台湾地区的药品疗效不等监测[J]. 中国药物警戒, 2016, 13(1): 28-31.
[5] 衛生福利部食品藥物管理署. 2015年食品藥物管理署年報[M]. 臺北: 衛生福利部食品藥物管理署, 2015: 29.
[6] 衛生福利部食品藥物管理署. 2016年食品藥物管理署年報[M]. 臺北: 衛生福利部食品藥物管理署, 2016: 36.
[7] 衛生福利部. 2017年版衛生福利年報[M]. 臺北: 衛生福利部, 2017: 88.
[8] 衛生福利部. 2018年版衛生福利年報[M]. 臺北: 衛生福利部, 2018: 95.
[9] 李自立. 藥效變差,健保署建通報機制[EB/OL]. (2018- 05-17) [2019-04-17]. https://www.rti.org.tw/news/view/ id/410666.
[10] 黃靖雅, 何虂菁. 某醫學中心評估藥品療效不等安全方法探討[J]. 藥物安全簡訊, 2011, 35: 12-17.
[11] 陈志东. 中国台湾地区药品不良品监测的现状[J]. 中国药物警戒, 2015, 12(8): 476-478.
[12] 张丽, 杜淑娴. 从我院药品质量问题分析看药品质量安全的重要性[J]. 实用药物与临床, 2010, 13(6): 473-475.
[13] 崔蔚, 董迪, 陈宁, 等. 北京积水潭医院口服药品质量问题分析及管理对策[J]. 临床药物治疗杂志, 2018, 16(3): 89-92.
[14] 周晶, 于浩. 2010~2015年我国药品评价抽验情况分析[J].药学与临床研究, 2018, 26(1): 74-76.
[15] 中国食品药品检定研究院. 2016年国家药品抽检年报[EB/OL]. (2017-10-09) [2019-04-17]. http://www.nifdc.org. cn/nifdc/fwzn/ypchytsxyj/9872.html.
[16] 中国食品药品检定研究院. 2017年国家药品抽检年报[EB/OL]. (2018-06-05) [2019-04-17]. http://www.nifdc.org. cn/nifdc/fwzn/ypchytsxyj/11119.html.
[17] 国家药监局. 国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)[EB/ OL]. (2018-12-28) [2019-04-17]. http://www.nmpa.gov.cn/ WS04/CL2138/334161.html.
