35株临床分离的大肠埃希菌耐药性与tem基因的鉴别
2019-10-28虞春华高建华潘斌辉杨林柯慧
虞春华 高建华 潘斌辉 杨林 柯慧
摘 要 目的:对临床分离的大肠埃希菌的耐药性与编码TEM型β-内酰胺酶基因(简称tem基因)的研究情况进行分析探讨,为今后的临床治疗工作提供有价值的参考依据。 方法:选择2017年6月—2018年6月间送检的临床标本作为研究对象,对其采用全自动微生物鉴定药敏分析仪进行分离鉴定及药敏分析,并对其中的35株耐药大肠埃希菌展开tem 基因及 tem-1、tem-2 基因亚型检测 。结果:药敏试验发现,35株大肠埃希菌对氨苄西林的耐药率为100.0%、对头孢唑林的耐药率为74.3%、对头孢呋辛的耐药率为 71.4%。经PCR扩增检测发现,它们均为tem基因阳性。结论:目前临床上分离的大肠埃希菌存在严重的耐药性,tem基因携带率高,在今后的临床用药过程中,应对其给予足够的重视。
关键词 大肠埃希菌 耐藥性 tem基因
中图分类号:R181.32 文献标志码:A 文章编号:1006-1533(2019)17-0047-03
Study on drug resistance and tem gene of 35 clinical isolates of Escherichia coli*
YU Chunhua1**, GAO Jianhua1, PAN Binhui2, YANG Lin1, KE Hui3(1. Department of Pathogens and Immunology, Jiangxi Medical College;2. Computer Teaching and Research Department of Jiangxi Medical College;3. Laboratory Department, the Peoples Hospital of Shangrao, Jiangxi Shangrao 334000, China)
ABSTRACT Objective: To analyze the drug resistance of clinical isolates of Escherichia coli and the genes coding for TEM type b-lactamase (tem gene), and provide valuable reference for future clinical treatment. Methods: Clinical specimens obtained from June, 2017 to June, 2018 were selected as subjects. The analysis of isolates and drug sensitivity were performed by automatic microbial identification drug sensitivity analyzer and gene identification of 35 resistant E.coli strains were carried out by PCR amplification. Results: The drug sensitivity test showed that the ratio of resistance strains against ampicillin reached to100.0% in 35 strains of Escherichia coli detected, in which the resistance rate accounted for 74.3% to cefazolin, and 71.4% to cefuroxime. They all were tem gene positive by PCR amplification. Conclusion: The clinically isolated Escherichia coli has serious drug resistance and high tem gene-carrying rate at present, to which great attention should be paid in the future clinical medication.
KEy WORDS Escherichia coli; drug resistance; tem gene
大肠埃希菌是寄居在人和动物肠道中的菌群,生物学性状与革兰阴性菌相似,在遗传学上与肠杆菌属于亲缘关系,在自然界是广泛存在的,属于条件致病菌[1]。若是机体免疫力低下或者是细菌侵入,会导致大肠埃希菌成为致病菌,诱发肠道外感染、消化道感染、呼吸道感染、泌尿系统感染、败血症等,范围比较广泛。大肠埃希菌为临床常见的一种革兰阴性菌,位居肠杆菌科细菌分离的第一位,会增加医源感染发生率,对一些临床常用的抗菌药物呈现出明显的多重耐药性[2]。本次研究中,以对临床分离的大肠埃希菌的耐药性与tem基因的研究情况进行分析探讨为目的,对我院收集到的送检标本进行了细菌分离、鉴定以及tem基因检测,并对检测结果进行了统计分析,结果汇报如下。
1 材料与方法
1.1 菌株来源
菌株来源于2017年6月至2018年6月间我院收集的送检标本,包括中段尿、血液、痰、分泌物、脓液、胸腹水等。取标本接种于麦康凯及 SS 平板培养,革兰染色镜检进行初筛,以全国临床检验操作规程为依据,凡符合氧化酶阴性、发酵葡萄糖的菌株,接种肠杆菌科细菌生化编码鉴定管 ( GYZ-11e) 鉴定大肠埃希菌,保存于营养琼脂斜面。选择分离出的35株大肠埃希菌展开tem基因检测,无重复菌株。
1.2 仪器与试剂
ABI 9700型PCR扩增仪(Techne公司); 凝胶成像分析系统(上海领成生物科技有限公司);Vitek2-Compact全自动微生物鉴定药敏分析仪(法国BioMérieux公司)。
1.3 菌株鑒定与药敏试验
菌株经Del96Ⅱ全自动细菌鉴定仪鉴定和药敏分析。
1.4 基因扩增
从GenBank寻找并下载tem-1、tem-2 和tem 基因序列,通过DNA序列比对找到其共有序列,并设计引物:P1:5-GAGTATTCAACATTTCCGTGTC-3,P2: 5-TAATCAGTGAGGCACCTATCTC-3 ,扩增片段长度为535 bp。PCR扩增试剂购自中山大学达安基因股份有限公司,引物合成也委托其完成。
质粒的提取:参照UNIQ-10柱式小量抽提试剂盒提取细菌质粒DNA [3]。
PCR反应体系:10 ml DNA模板,25 ml 2×MasterMix, tem-1或tem-2上下游引物各2 ml,Taq DNA聚合酶(5 U/ml)0.5 ml,加ddH2O至50 ml。PCR扩增条件:95 ℃预变性 5 min,然后95℃ 1 min,65℃ 30 s,72 ℃ 1 min,循环35次,最后72 ℃ 延伸10 min。2%琼脂糖凝胶电泳法分析扩增片段[4],用凝胶成像仪采集图像。
2 结果
2.1 药敏试验结果
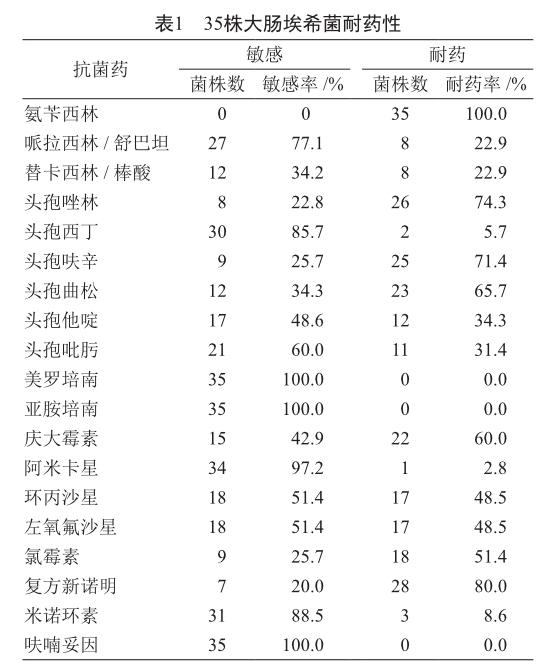
药敏试验发现,大肠埃希菌对氨苄西林、头孢唑林、头孢呋辛、头孢曲松、左氧氟沙星、环丙沙星及复方新诺明均具有较高的耐药性,对阿米卡星的耐药率较低,对呋喃妥因、美罗培南及亚胺培南的耐药率均为0(表1)。
2.2 耐药基因检测结果
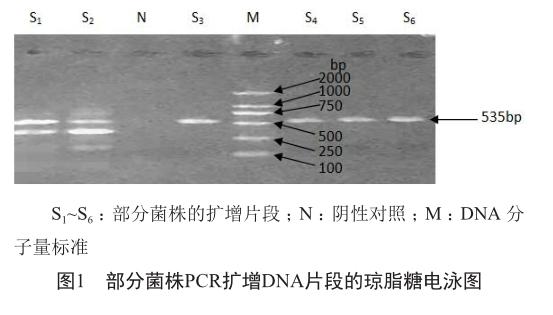
35株大肠埃希菌TEM型b-内酰胺酶基因检测全部呈现为阳性,部分菌株(S1~S6)PCR扩增片段的电泳图见图1。
3 讨论
大肠埃希菌是院内感染监测中非常重要的病原菌之一,有资料显示该菌株在医院感染标本中分离率达到30~60%,其中产超广谱b-内酰胺酶(ESBLs)的分离率更高,非常容易引起暴发流行,此外ESBLs易在菌株间传播,导致耐药菌产生和扩散从而影响治疗效果[5-6]。
本研究结果发现,大肠埃希菌对氨苄西林的耐药率已经达到100%,对头孢呋辛、头孢唑林、头孢曲松等一代、二代、三代头孢菌素类存在明显耐药性,耐药率均超过了65%,并且会对复方新诺明的耐药率也达到了80%,提示这些药物无法作为临床治疗大肠埃希菌诱发的感染性疾病[7]。此外,研究表示大肠埃希菌对碳青霉烯类药物具有显著敏感性,提示碳青霉烯类药物对大肠埃希菌、ESBLs大肠埃希菌均有较高的稳定性,与Han等[8]的报道结果基本一致。 病原菌基因型检测也是提高用药针对性和治疗有效性的关键[9-10],本研究应用TEM型b-内酰胺酶基因展开检测,耐药菌株tem基因均呈现为阳性,说明菌株对b-内酰胺类抗生素耐药性多是tem基因编码[11]。
综上所述,本地区大肠埃希菌耐药率非常高,尤其是对常见的广谱抗生素耐药率极高,本次实验中所选取的药物种类有限,细菌对其他药物的耐药机制尚需展开进一步的研究,旨在为大肠埃希菌的院内感染治疗提供帮助。
参考文献
[1] 李海英, 王炯, 白雅红, 等. 连续5年临床分离大肠埃希菌耐药性的变迁[J]. 中华医院感染学杂志, 2015, 25(3): 511-513.
[2] 游树林, 汪文明, 刘利航, 等. 327株产广谱b-内酰胺酶大肠埃希菌的耐药性分析[J]. 检验医学与临床, 2015, 12(11): 2810-2812.
[3] 邢国胜, 孔瑞华, 马忠慧,等. 临床分离产超广谱b-内酰胺酶大肠埃希菌耐药基因分型研究[J]. 中国卫生检验杂志, 2017(6): 109-111; 114.
[4] 姚建平. TEM型b-内酰胺酶在耐多药大肠埃希菌中的作用分析[D]. 四川泸州: 西南医科大学, 2016.
[5] 李君, 王倩青, 李力, 等. 妇科住院患者腹腔镜手术切口感染大肠埃希菌耐药性及耐药基因检测[J]. 中国病原微生物学杂志, 2015, 10(6): 563-567.
[6] 李海英, 王金波, 白雅红, 等. 产超广谱b-内酰胺酶大肠埃希菌b-内酰胺酶基因研究[J]. 中华医院感染学杂志, 2014, 24(19): 4699-4701.
[7] 杨君洋, 卢洪洲. 大肠埃希菌肠道外感染及其治疗的研究近况[J]. 上海医药, 2016, 37(7): 21-24.
[8] Han JH, Nachamkin I, Tolomeo P, et al. Temporal changes in resistance mechanisms in colonizing Escherichia coli isolates with reduced susceptibility to fluorequinolones[J]. Diagn Microbiol Infect Dis, 2013, 76(4): 491-496.
[9] 茆海丰, 刘洪书, 赵勇, 等. 大肠埃希菌对喹诺酮类抗菌药物耐药机制研究[J]. 中华医院感染学杂志, 2015, 25(15): 3375-3377.
[10] Izdebski R, Baraniak A, Fiett J, et al. KPC-like carbapenemase-producing Enterobacterianceae colonizing patients in Europe and Israel[J]. Antimicrob Agents Chemother, 2015, 60(3): 1912-1917.
[11] Ballus J, Lopez-Delgado JC, Sabater-Riera J, et al. Surgical site infection in critically ill patients with secondary and tertiary peritonitis: epidemiology, microbiology and influence in outcomes [J/OL]. BMC Infect Dis, 2015, 15: 304. doi: 10.1186/s12879-015-1050-5.
