拟松材线虫纤维素酶活性与其致病性关系
2019-10-25薛美静高泽文吴文涛喻盛甫
薛美静, 李 英, 张 靖, 高泽文, 吴文涛, 王 扬, 喻盛甫
云南农业大学植物保护学院,云南 昆明650201
拟松材线虫Bursaphelenchus mucronatus Mamiya& Enda 是松材线虫B. xylophilus 的近缘种,两者的遗传背景十分相似,形态上很难区分,且生活习性、生活史和侵染循环等都相近(杨宝君等,2003)。 长期以来,松材线虫被认为是松树萎蔫病的唯一病原(Fukuda et al.,1992; Kiyohara & Tokushige,1971;Tamura,1983)。 研究表明,用无菌松材线虫及带菌松材线虫接种,均能使赤松和湿地松无菌苗发生萎蔫,而松材线虫体表细菌单独接种未能使无菌苗发病,这为松材线虫是引起松树萎蔫的唯一病原提供了直接证据(叶建仁和黄麟,2012; Zhu et al.,2012)。 作为松材线虫的近缘种拟松材线虫,学术界长期以来认为其致病力极弱或根本不致病(汤勤和昌世翠,1989; 吴广超等,2006; Futaik,1980;Mamiya & Enda,1979)。 魏素珍等(2010)认为,拟松材线虫的致病性易受环境影响,一定条件下也能造成大片松树的死亡,且分布范围比松材线虫更广,在同一地区常常是拟松材线虫先出现,然后才有松材线虫出现。 因此,拟松材线虫的致病性问题及其致病机制值得进一步探索。 近年来,对云南、贵州等地的拟松材线虫的研究发现,拟松材线虫种群间存在明显的致病性分化,室内接种中部分拟松材线虫对3 年生松苗的致死速度甚至接近松材线虫,在云南和贵州的部分林区也发现了拟松材线虫单独危害引起松树萎蔫枯死的现象(李丹蕾,2005)。 但拟松材线虫的致病力弱于松材线虫却是一个勿庸置疑的事实。 因此,研究拟松材线虫和松材线虫的致病性差异,对于全面认识松树线虫萎蔫病的致病机理有重要意义。
线虫对植物的致病性主要体现在2 个方面:一是线虫在植物组织内移动时引起植物的机械损伤,二是线虫通过口针注入植物细胞的食道腺分泌物诱发植物生理代谢改变。 线虫食道腺分泌物被认为是植物线虫致病的关键因素,其中包含的物质除碳水化合物外,主要是一些高浓度的蛋白,如各种水解酶类(纤维素酶、果胶酶、蛋白酶和木质素酶等)。 酶被认为是松材线虫病的主要致病因子,它直接参与树木薄壁组织细胞死亡过程,影响整个形成层,导致树木枯萎死亡(吴云和程柳,2018)。 这些酶的种类和数量在不同寄生阶段和不同食道腺中均有差别,对植物细胞及其内含物具有修饰作用,有利于线虫的取食与移动(Davis et al.,2000;Hussey,1989)。 纤维素酶具有分解纤维素的能力,能破坏松树的细胞壁,使松树内部水分无法传输,从而导致松树死亡(武琼,2016)。 已有研究证明,线虫食道腺分泌的纤维素酶在根结线虫和胞囊线虫的侵入和诱导取食点的形成中起了关键作用(Chen et al.,2005; Davis et al.,2004; Vanholme et al.,2004)。 松材线虫的致病力也与虫体分泌的纤维素酶活性相关(Kojima et al.,1994)。 在树木早期出现病害阶段,松材线虫分泌出来的纤维素酶在其中起到决定性作用(王敏敏等,2006)。 从松材线虫的提取液中也发现了纤维素酶的存在,且线虫的毒性越强,纤维素酶的活性就越强。
拟松材线虫是否分泌纤维素酶,以及纤维素酶与其致病力是否有关至今仍不清楚。 已有研究表明拟松材线虫的遗传多样性高于松材线虫,但松材线虫和拟松材线虫的致病力与地理距离和遗传距离之间没有必然的联系(谢艳丽,2013),这也间接表明拟松材线虫致病力差异是由其他因素造成。鉴于此,本文在前期拟松材线虫种群致病性测定的基础上,以松材线虫为对照对具有不同致病力的拟松材线虫种群进行纤维素酶活性测定,以期为拟松树线虫的致病机理研究提供参考。
1 材料与方法
1.1 供试线虫
供试线虫采自云南、贵州林区萎蔫枯死松树上,经过纯化培养保存的7 个拟松材线虫种群和1个松材线虫种群(表1),其中7 个拟松材线虫种群对5 种4 年生松苗的致病力强弱排序为YLX(云南泸西)>GY(贵州贵阳)>YES(云南峨山)>YSL(云南石林)>YLP(云南罗平)>YJC(云南江川)>YXP(云南新平)(李丹蕾,2005)。

表1 供试线虫及来源Table 1 Tested nematodes and sources
1.2 供试线虫虫体的蛋白提取液及分泌液的制备
将表1 中8 个线虫种群经纯化后,依据严东辉和杨宝君(1997)的方法在灰葡萄孢Botrytis cinera Pers.上扩大繁殖,收集线虫并对其反复冲洗,最后浓缩成约105条线虫悬浮液,置于M9 液体培养基中,25 ℃培养5 h 后,用M9 液体培养基冲洗3 次,所得的线虫悬浮液分成2 份。 一份放入2 mL 的离心管中,加入1 mL M9 液体培养,放入-80 ℃冰箱中保存,低温处理5 h 后放入冷冻干燥器中干燥7 h制成干粉,用少量0.01 mol·L-1pH7.2 的磷酸盐缓冲液(含0.15 mol·L-1氯化钠)稀释制成匀浆液,匀浆液在12000 r·min-1下离心15 min,上清液即为虫体蛋白提取液;另一份线虫液重悬浮在1 mL M9液体培养液中,室温下培养48 h 后在12000 r·min-1下离心15 min,上清液即为分泌液。 上述虫体蛋白提取液和分泌液存贮于-20 ℃冰箱内备用。
1.3 纤维素酶活性测定
1.3.1 线虫提取液及分泌物中的蛋白质含量测定
用分光光度计测出松材线虫及拟松材线虫提取液和分泌液在波长280 nm 处的光密度值,根据光密度值从标准曲线中查对应的蛋白值含量,做BAS 蛋白质标准曲线图。
1.3.2 琼脂扩散法比较纤维素酶活性 依据Mateos et al.(1992)的方法用0.2%的羧甲基纤维素(CMC)、1%的琼脂和磷酸盐缓冲液制成大约7 mm厚的反应板,待反应板冷却后用打孔器打直径为9 mm 的5 个孔,并编号按顺序加入相同蛋白质量的提取液、分泌液或1000 条活虫,将反应板入28 ℃温箱中保温反应48 h,取出反应板,用0.1%的刚果红(80%的乙醇配制)染色6 min,用1 mol·L-1的氯化钠漂洗30 min,拍照比较晕圈大小。 透明圈直径越大,则表明其纤维素分解能力越强,即纤维素酶活性越高(张宇昊等,2004)。
1.3.3 DNS 法测定纤维素酶活性 依据索风梅等(2004)的方法,以1%羧甲基纤维素作底物测定内切β-l,4-葡聚糖酶(Cx 酶)的活性,底物均用柠檬酸缓冲液(pH 值5.6,0.2 mol·L-1)配制。 取上述底物0.2 mL、酶液0.01 mL 混匀,在45 ℃水浴保温1 h 后,加入DNS 显色剂0.2 mL,立即在沸水浴中显色5 min,流水冷却,稀释定容至2.5 mL。 于490 nm 处测D 值,每处理重复3 次,同时设空白对照。以实验条件下单位虫体数量(条)、单位时间(min)酶促反应生成的还原糖(葡萄糖)量(mg)计算Cx酶活性,即:Cx=葡萄糖含量(mg)/线虫量(条)×时间(h)。
1.4 纤维素酶同工酶分析
分别取各线虫种群的虫体蛋白提取液、分泌液、各100 条成虫和幼虫的虫体蛋白提取液,采用聚丙烯酰胺凝胶垂直板电泳进行纤维素同工酶分析(5%积层胶,分离胶10%,含0.2%羧甲基纤维素)(Rosso et al.,1999)。 电泳时积层胶电压80 V分离胶电压150 V。 然后将胶放入30 ℃的温箱中保温反应7 h,再用0.1%的刚果红(去离子水配制)染色30 min(胡凯基和杨宝君,1995),最后用1 mol·L-1的氯化钠漂洗退色至适当,拍照。
2 结果与分析
2.1 线虫虫体提取液、分泌液纤维素酶活性的琼脂扩散反应
在反应板上松材线虫及拟松材线虫虫体蛋白提取液、分泌液和1000 条线虫样点周围出现了典型的反应透明圈,其余部分呈现底物的红色(图1),表明2 种线虫虫体都含有纤维素酶并向体外分泌。 测量发现,松材线虫虫体蛋白提取液、分泌物的样点周围出现的透明圈比拟松材线虫分泌物的透明圈大,且具有显著差异,说明相同单位体积的松材线虫(YWD)虫体蛋白提取液和分泌液中的纤维素酶活性高于拟松材线虫。 7 个不同致病性的拟松材线虫虫体蛋白提取液、分泌物的样点周围出现的透明圈大小也存在差异,同样致病力最强的的YLX 种群的透明圈显著大于其他拟松材线虫种群,致病力最弱的YXP 种群产生的透明圈最小(表2)。
2.2 线虫虫体蛋白提取液、分泌物纤维素酶活性的DNS 法定量测定
取相同蛋白质含量的线虫虫体蛋白提取液、分泌物测定对羧甲基纤维素的内切活性,结果如图2所示。 松材线虫种群YWD 的虫体蛋白提取液、分泌物中的纤维素酶活性均远高于对应所有的拟松材线虫种群;各拟松材线虫种群间纤维素酶活性差异较小,7 个拟松材线虫种群虫体蛋白提取液中纤维素酶活性的强弱顺序依次为:YLX >GY >YES >YSL>YLP>YJC>YXP,其中致病性最强的2 个拟松材线虫种群YLX 种群和GY 种群在拟松材线虫中表现出最强的纤维素酶活性,致病力最弱的YXP种群纤维素酶活性最弱。
2.3 纤维素酶同工酶分析
松材线虫(YWD)和拟松材线虫(GY、YLX、YXP)虫体蛋白提取液和分泌液的纤维素酶同功酶电泳结果显示,2 种线虫均有3 条迁移率不同的谱带C1、C2 和C3,其种内同工酶谱型一致,而种间则有一定差异,拟松材线虫的C2 谱带宽于松材线虫(图3)。 对不同虫态的纤维素同工酶分析发现,松材线虫和拟松材线虫的成虫和幼虫间均表现出一致的谱型(图3B),表明2 种线虫纤维素酶基因的表达无阶段性差异,纤维素酶基因的表达为各虫态所必需。

图1 琼脂扩散法测定线虫纤维素酶活性Fig.1 Determination of nematode cellulase activity by means of agar diffusion

表2 琼脂糖扩散反应对不同致病性线虫种群形成的透明圈大小Table 2 Determination of the transparent circle size of agarose diffusion reaction on different pathogenic nematode populations
3 讨论
关于纤维素酶在松材线虫致病过程中的作用,国内外已有较多的研究。 Odani et al.(1985)首先证明松材线虫可以产生纤维素酶,并认为松材线虫产生的纤维素酶在松树发病的早期至关重要;另研究证实,松材线虫的体外分泌物中可以检测到蛋白酶、过氧化物酶、淀粉酶和纤维素酶的活性(严东辉和杨宝君,1997);在此基础上,汪来发等(2005)分别用市售的上述4 种酶和松材线虫分泌物接种3年生的黑松苗,发现只有纤维素酶和松材线虫分泌物能够导致松苗产生类似松树萎蔫病的症状;Kojima et al.(1994)也发现松材线虫强致病性株系的纤维素酶含量及活性比弱致病性株系的高。 根据上述研究结果可以初步认为,松材线虫分泌酶中最主要的是纤维素酶,是纤维素酶导致了松树萎蔫病。而有关纤维素酶在拟松材线虫致病过程中的作用研究较少,蒋丽雅和王晓芸(1995)用纤维素酶扩散法进行纤维素酶的定性检测,结果表明,松材线虫虫体含纤维素酶,并向体外分泌;拟松材线虫不含纤维素酶,且不向体外分泌,因此认为可以用检测纤维素酶活性的方法来区分松材线虫和拟松材线虫。 而张奇等(2006)对松材线虫分泌的纤维素酶进行了分离纯化,并制备了其特异性抗体,通过免疫学方法研究纤维素酶的生产和线虫到松树的入侵途径,但是得到的纤维素酶特异性抗体对拟松材线虫也存在一定的交叉反应,其特异性还需进一步证实。
本文通过对拟松材线虫的虫体蛋白提取物、分泌液和1000 条活虫的纤维素酶琼脂扩散实验,证实拟松材线虫不仅体内组织中含有纤维素酶,而且向体外分泌;同时,拟松材线虫虫体蛋白提取液和分泌液的纤维素酶DNS 法定量测定也显示,拟松材线虫的纤维素酶活性与致病性呈现正相关关系,即致病性越强的拟松材线虫种群其纤维素酶活性也越强。 因此可以推测与松材线虫一致,纤维素酶也参与了拟松材线虫的致病过程,可以初步认定纤维素酶是松材线虫和拟松材线虫主要的致病相关酶类,会导致松树萎蔫。
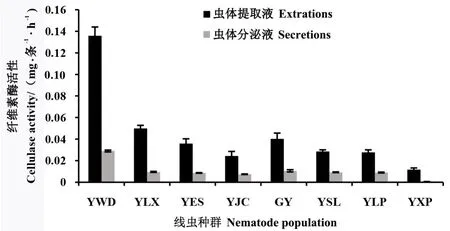
图2 DNS 法测定线虫虫体提取液、分泌液纤维素酶活性Fig.2 Determination of cellulase activity in nematode extractions and secretions by DNS

图3 松材线虫及拟松材线虫纤维素酶同工酶电泳Fig.3 Electrophoresis of cellulase isoenzymes of B. xylophilus and B. mucronatus
另外,对松材线虫和拟松材线虫的纤维素酶活性的比较发现,相同蛋白含量的松材线虫虫体蛋白提取液和分泌液中的纤维素酶活性远高于对应的拟松材线虫,这一结果也似乎暗示松材线虫和拟松材线虫的致病性差异可能与纤维素酶活性相关,但无法判断纤维素酶活性的差异是由于2 种线虫分泌的纤维素酶本身分解纤维素的效率不同还是由于分泌的纤维素酶数量不同引起的。 采用聚丙烯酰胺电泳对2 种线虫的纤维素同工酶进行分析,发现松材线虫和拟松材线虫的纤维素酶同工酶谱型略有差异,这与胡凯基和杨宝君(1995)的结果一致。 但董娜(2003)认为,松材线虫与拟松材线虫分泌的纤维素酶在活性和酶谱带上无种间区别,这与前两者的研究结果是相冲突的,而成幼虫的纤维素酶的谱带在迁移率和量上均无明显区别,各株系间也无区别,这与本实验结论一致。 故仅凭同工酶电泳谱型的细微差异判断2 种线虫纤维素酶的功能存在差异还显得证据不足,因此有必要在下一步的研究中分别纯化2 种线虫的纤维素酶后测定其单位质量的酶活性,或通过更多的技术和手段测定和验证2 个近缘线虫种分泌的纤维素酶的活性。
此外,关于纤维素酶组分的研究和报道也屡见不鲜。 纤维素酶最初被认为是动物依赖于与其共生的微生物产生的,而自身不能产生和分泌(Watanabe et al.,1998)。 后来研究发现,白蚁和线虫可以分泌内源性的内切-β-1,4-葡聚糖酶,且相关基因已经得到分离和克隆(Smant et al.,1998; Wang et al.,2003)。 Ma et al. (2009)证实松材线虫和拟松材线虫分泌的纤维素酶均包括完整的3 类酶:内切-β-1,4-葡聚糖酶、外切-β-1,4-葡聚糖酶和β-葡萄糖苷酶,且内切-β-1,4-葡聚糖酶活性最高。 随着分子技术的伸延,RNA 干扰(RNAi)也被用在线虫体外基因功能的分析中(Fire et al.,1998),已成为研究控制植物寄生线虫致病基因功能的有效生物学工具(Dutta et al.,2015; Lilley et al.,2007),已有研究使用RNAi 来调查B. xylophilus 的基因功能(Cardoso & Fonseca,2013; Kang et al.,2011,2012;Li et al.,2011; Park et al.,2008; Wang et al.,2012)。 在通过浸泡法对B. xylophilus 的内切-β-1,4-葡聚糖酶致病性相关基因进行RNA 干扰沉默时,纤维素酶活性结果显示,内切-β-1,4-葡聚糖酶基因的表达受到抑制且酶的活性显著降低(Cheng et al.,2010; Ma et al.,2011)。 但由于浸泡法具有不持续性和干扰效果逐步衰退的劣势,仅限遗传给子一代,子二代又恢复至原来的野生型,其应用受到很大限制,因此有必要从其他途径寻找高效、稳定的RNAi 干扰体系(牛宝龙等,2003; 杨谦和赵惠贤,2005; 叶建仁和黄麟,2012)。 对此,也可以通过体外注射dsRNA 至松树树干或通过转基因植物表达dsRNA 进而起到对线虫的RNA 干扰反应,但这些方面的研究工作到目前为止较少,有待进一步研究。
本实验中研究拟松材线虫分泌的纤维素酶与致病性的关系,验证了纤维素酶活性与致病性呈正相关。 周立峰(2017)的研究结果表明,拟松材线虫群体间的致病差异受生长环境、因长期的地理隔离导致的生殖隔离、与适应寄主体内生活以及脂肪酸与视黄醇结合蛋白等因素有关。 拟松材线虫和松材线虫2 个近缘种除了诸多相似方面,其种间的致病性差异却很大,推测这是由多种复杂的因素引起的,纤维素酶可能只是引起致病性差异中的一个关键因素,因此还需要更多的证据来寻找致病机制和引起致病差异的原因。
