色素上皮衍生因子的分段克隆表达对人皮肤鳞状细胞癌细胞增殖的影响
2019-10-24张志彬彭胜男刘藕根张颖鹏李春明彭亚婷张淑兰
张志彬,彭胜男,刘藕根,张颖鹏,李春明,彭亚婷,张淑兰
0 引 言
皮肤鳞状细胞癌是皮肤常见恶性肿瘤,发病率逐年上升。色素上皮衍生因子(pigment epithelium derived factor,PEDF)是一种强效的内源性抗肿瘤蛋白,由418个氨基酸组成。近年来发现PEDF短肽具有与全长的PEDF 蛋白同样的抗肿瘤作用,更容易被载体携带且引起的不良反应更少。然而有关PEDF 短肽对皮肤鳞状细胞癌细胞增殖的研究鲜有报道。本研究旨在通过分段克隆表达PEDF 融合蛋白,观察其对人皮肤鳞状细胞癌细胞系(human cutaneous squamous cell carcinoma cell line,SCL-1)的抑制结果,为短肽筛选提供基础。
1 材料与方法
1.1 材料质粒抽提试剂盒和RNA 提取试剂盒购自北京天根生化科技有限公司,PCR 试剂、限制性内切酶NheI、HindⅢ购自日本TaKaRa 公司,反转录试剂盒和T4 DNA 连接酶购自美国Fermentas 公司,DNA 凝胶回收试剂盒购自美国Axygen 公司,SDSPAGE 蛋白上样缓冲液(5×)、苯甲基磺酰氟(PMSF)购自上海碧云天生物技术有限公司,30%Acrylamide/Bis solution、甘氨酸购自美国Bio-Rad公司,考马斯亮蓝R250购自国药集团化学试剂有限公司,高亲和力的Ni-NTA 树脂(High Affinity Ni-NTA Resin)购自美国GenSript 公司,透析袋购自Biosharp 公司,SCL-1 细胞株购自深圳中洪博元生物技术有限公司,DMEM 培养基购自美国Gibco 公司,CCK-8 试剂盒购自日本株式会社同仁化学研究所。
1.2 方法
1.2.1 引物设计从NCBI 网站下载PEDF 序列(NM_002615.5),设计PEDF1(1-160 氨基酸)的引物,上游5'-TTCATGCTAGCATGCAGGCCCTGGTGCTACTCC-3',下 游5'-TCTAAAAGCTTTTACTTTTCCAGAGGTGCCACAAAGC-3'。PEDF2(161-300 氨基酸)的引物,上游5'-TTCATGCTAGCTCATATGGGACCAGGCCCAGAG-3', 下 游 5'-TCTAAAAGCTTTTAGTCATGAATGAAC TCGGAGGTG-3'。PEDF3(301-418 氨 基 酸)的 引 物,上 游5'-TTCATGCTAGCATAGACCGAGAACTGAAGACCGTGC-3',下游是5'-TCTAAAAGCTTTTAGGGGCCCCTGGGGTCCAG-3'。
1.2.2 PEDF1、PEDF2 和PEDF3 的基因扩增选用人皮下脂肪组织抽取物提取总RNA 组织。总RNA 提取参照Trizol试剂盒说明书操作。取2µg总RNA,采用20µL 逆转录体系(4µL 5×逆转录酶缓冲液、0.5µg Oligo(dT)18、50 mmol/L dNTP 混合液、200 U MMLV 逆转录酶、20U RNA 酶抑制剂和DEPC水),42 ℃60 min 逆转录为cDNA。PCR 反应采用25µL PCR 体系:10 pmoL/µL 各对上下游引物、200 mmol/L dNTP 混合液、50 mmol/L KCL、10 mmol/L Tris-HCl、2 mmol/L MgCl2、2 U Taq 酶、cDNA、DEPC水补足25µL,进行PCR 反应。反应程序为:96 ℃3 min,1循环;96 ℃70 s,57 ℃70 s,72 ℃80 s,35 个循环;72 ℃延伸7 min。
1.2.3 目的基因的克隆和鉴定将PCR 扩增产物PEDF1、PEDF2 和PEDF3 分别连接到pET28a(+)载体载体。用NheI/Hind Ⅲ内切酶分别双酶切PEDF1、PEDF2 和PEDF3 和空质粒pET28a(+),10 g/L 琼脂糖凝胶电泳后回收酶切产物,用T4 连接酶23 ℃作用2 h;用将连接产物转化入大肠埃希菌DH5α,转化后挑取单个菌落进行扩增以提取质粒进行酶切、测序、PCR鉴定。
1.2.4 重组表达载体的表达载体pET28a-PEDF1、pET28a-PEDF2 和pET28a-PEDF3,转化大肠杆菌表达菌株BL21,挑取单克隆,5 mL LB 培养基(Kanr)中震荡培养过夜。按1%接种量接种到50 mL LB 培养基中,A600为0.6 时,分别加入终浓度为0.1、0.4、0.8、1.2、1.6 和2 mmol/L 的异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG),37 ℃诱导培养3 h。分别取出1.0 mL菌液,离心收集菌体沉淀用80µL PBS悬浮,再加入5×SDS-PAGE上样缓冲液20µL 震荡混匀,100 ℃水浴煮沸5 min。离心后取上清进行12%SDS-PAGE鉴定。
1.2.5 融合蛋白的制备、分离、纯化、浓度及纯度鉴定挑取阳性克隆接种到5 mL LB培养基经37 ℃震荡过夜培养。吸取100µL接种于100 mL的LB培养基,37 ℃振荡培养2 h至A600为0.6左右时,加入终浓度为0.8 mmol/L 的IPTG 37 ℃诱导培养3 h。离心后收集菌体,加入32 mL的LE buffer重悬菌体,破碎前加入0.1 mol/L 的PMSF 320µL,置入超声破碎仪中进行破碎。破碎后的菌体离心后分别收集上清和沉淀。收集的沉淀用包涵体洗涤缓冲液洗涤2 次后,用包涵体溶解缓冲液重悬,冰浴1 h 使包涵体溶解,离心后将上清过滤。倒置填料瓶底部混匀柱填料,用移液管转移5 mL 填料至柱中,室温静置10 min 待凝胶与溶液分层后,让乙醇缓慢流出。向柱子中加入5 倍柱体积的去离子水,将乙醇冲洗干净后,再用8倍柱体积的LE buffer平衡柱子,上样。将洗涤、溶解好的包涵体溶液负载上柱,流速为1 mL/min。用15倍柱体积的LE buffer 洗柱,收集流穿峰。用2倍柱体积的Wash buffer洗柱,收集流出峰。用5倍柱体积的Elution buffer 洗脱,收集洗脱峰。洗脱后,1 次使用3 倍柱体积的LE buffer 和5 倍柱体积的去离子水,洗涤柱子,再用3倍柱体积的20%乙醇平衡柱子。蛋白纯化收集的洗脱液装入透析袋中,放在2 L 的refolding buffer 中于4 ℃重折叠72 h,样品于透析缓冲液中4 ℃透析24 h,期间换液2次。采用BCA 法测定蛋白浓度,考马斯亮蓝染色测定蛋白纯度,具体操作过程见参考文献[1]。
1.2.6 CCK-8 法检测不同浓度PEDF1、PEDF2 和PEDF3 对SCL-1 细胞增殖的影响对数生长期SCL-1 细胞用胰蛋白酶/EDTA 消化后重悬于含10%胎牛血清的DMEM 培养基,以5×104/mL 密度种植于96 孔板,每孔100µL。放置于孵箱中24 h 后,细胞铺满孔底部60%~70%,弃培养基,然后用PBS冲洗2次。实验设置调零组、空白对照组、实验组。以添加100µL 无血清DMEM/0.5%BSA 的无细胞孔作为调零孔。以添加100µL 无血清DMEM/0.5%BSA 的有细胞孔作为空白对照组。实验组加入100µL 含有不同浓度100、400、800 和1000 nmol/L PEDF1、PEDF2 和PEDF3 的无血清DMEM/0.5%BSA。继续孵育24 h。最后1 h 每孔加入10µL CCK-8 溶液,继续孵育1 h,置于分光光密度仪450 nm 读取吸光度。每种处理因素均设5 复孔,重复3 次,计算细胞活力比值,结果取平均值。细胞活力比值计算公式如下:
细胞活力比值=实验组/空白组
1.3 统计学分析采用SPSS 16.0 统计软件进行数据分析。计量资料以均数±标准差(xˉ±s)进行描述,组间均值比较采用方差分析,两两组间比较采用LSD法。以P≤0.05为差异有统计学意义。
2 结 果
2.1 构建PEDF1、PEDF2 和PEDF3 的原核表达载体构建好的载体pET28a-PEDF1、pET28a-PEDF2和pET28a-PEDF3 通过测序结果显示,3 个不同片段序列都符合预期并且都插入到正确位点。与NM_002615.5序列相比存在2个同义突变,分别为390C>T和963C>T。
2.2 PEDF1、PEDF2 和PEDF3 融合蛋白检测通过IPTG诱导出融合蛋白的大肠杆菌经超声破碎后,在上清和沉淀中均检测到目的蛋白表达,蛋白相对分子质量大小分别约为18 000、17 000和13 000。其中融合蛋白大部分分布在沉淀中,小部分以可溶形式存在于上清中,最终选择对沉淀中的蛋白进行分离纯化,见图1。

图1 融合蛋白的检测Figure 1 Detection of the PEDF1,PEDF2 and PEDF3 fusion proteins
2.3 PEDF1、PEDF2 和PEDF3 融合蛋白的分离纯化融合蛋白通过分离纯化,得到洗脱后的蛋白相对分子质量分别为18 000、17 000 和13 000,与PEDF1、PEDF2和PEDF3蛋白分子量相符,见图2。
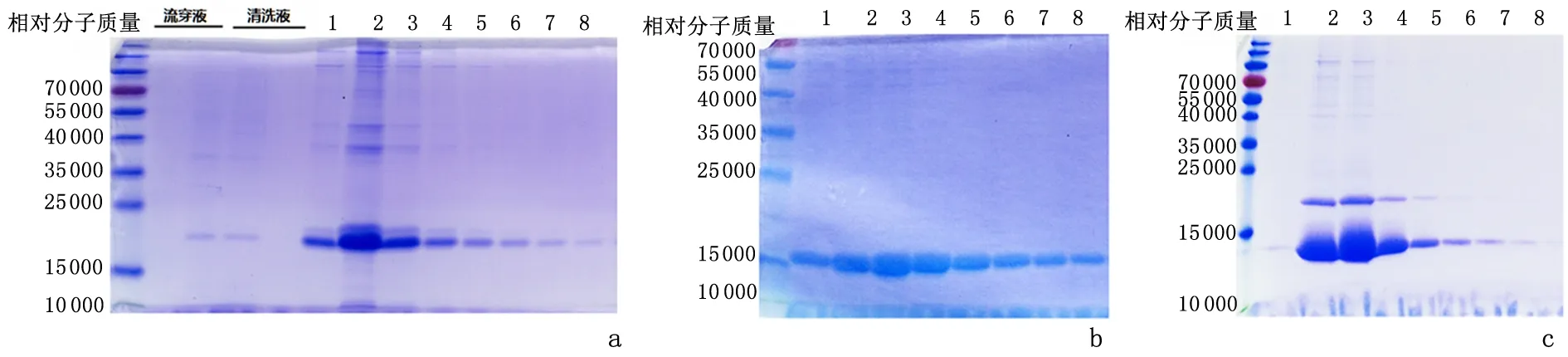
图2 融合蛋白的分离纯化Figure 2 Isolation and purification of the PEDF1,PEDF2 and PEDF3 fusion proteins
2.4 PEDF1、PEDF2 和PEDF3 融合蛋白对SCL-1细胞增殖的抑制影响24 h 时,800 nmol/L、1000 nmol/L 浓度PEDF3 SCL-1 细胞增殖较0 nmol/L PEDF3 明显降低,抑制SCL-1 细胞增殖(P<0.05)。48 h 时,400、800、1000 nmol/L 浓度PEDF3 SCL-1细胞增殖呈现显著抑制,并呈剂量依赖性(P<0.05)。72 h 时,800、1000 nmol/L 浓度PEDF3 SCL-1 细胞增殖较400、0 nmol/L 显著降低(P<0.05)。见表1。
表1 CCK-8 方法检测不同浓度PEDF1、PEDF2 和PEDF3的细胞活力比值Table 1 Proliferation of the SCL-1 cells with PEDF1,PEDF2 and PEDF3 at 100,400,800 and 1000 nmol/L at 24,48 and 72 hours
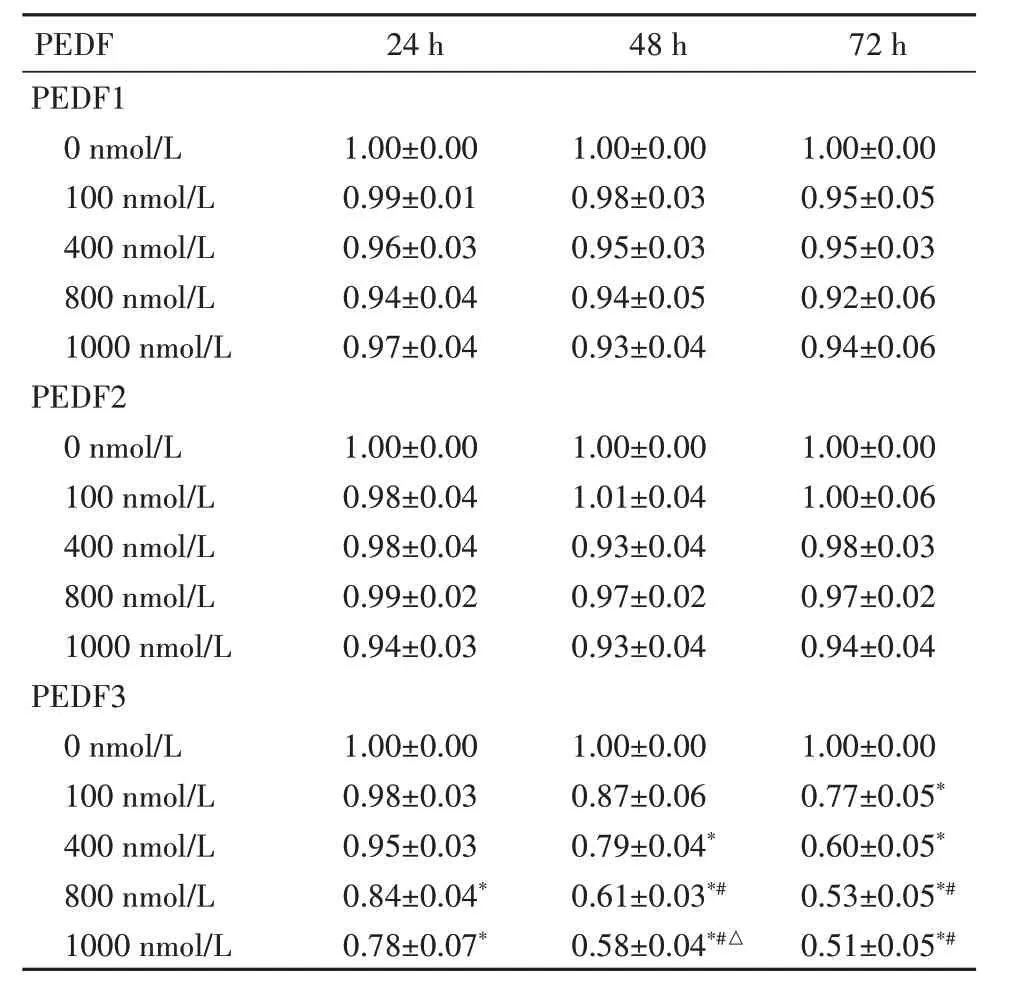
表1 CCK-8 方法检测不同浓度PEDF1、PEDF2 和PEDF3的细胞活力比值Table 1 Proliferation of the SCL-1 cells with PEDF1,PEDF2 and PEDF3 at 100,400,800 and 1000 nmol/L at 24,48 and 72 hours
与0 nmol/L 比较,*P<0.05;与400 nmol/L 比较,#P<0.05;与800 nmol/L 比较,△P<0.05
PEDF24 h 48 h 72 h PEDF1 0 nmol/L1.00±0.001.00±0.001.00±0.00 100 nmol/L0.99±0.010.98±0.030.95±0.05 400 nmol/L0.96±0.030.95±0.030.95±0.03 800 nmol/L0.94±0.040.94±0.050.92±0.06 1000 nmol/L0.97±0.040.93±0.040.94±0.06 PEDF2 0 nmol/L1.00±0.001.00±0.001.00±0.00 100 nmol/L0.98±0.041.01±0.041.00±0.06 400 nmol/L0.98±0.040.93±0.040.98±0.03 800 nmol/L0.99±0.020.97±0.020.97±0.02 1000 nmol/L0.94±0.030.93±0.040.94±0.04 PEDF3 0 nmol/L1.00±0.001.00±0.001.00±0.00 100 nmol/L0.98±0.030.87±0.060.77±0.05*400 nmol/L0.95±0.030.79±0.04*0.60±0.05*800 nmol/L0.84±0.04*0.61±0.03*#0.53±0.05*#1000 nmol/L0.78±0.07*0.58±0.04*#△0.51±0.05*#
3 讨 论
皮肤鳞状细胞癌是起源于表皮或附属器角质形成细胞的一种恶性肿瘤,近年来发病率逐年上升[2],该皮肤肿瘤具有病因复杂、临床误诊率高、恶性程度大及侵袭性和破坏性强等特点。常用的治疗方法主要为手术治疗,然而由于手术后严重影响美容外观,且不适合于老年体弱以及有手术禁忌证者。因此希望寻找到理想的、高效、非损伤性局部治疗方法。近年来在视网膜和其他一些细胞、组织中发现了一种内源性的强效抗肿瘤蛋白,即PEDF[3-4],为我们治疗皮肤鳞状细胞癌提供了新的思路。因此,本研究将PEDF 分段克隆,观察对SCL-1细胞增殖的影响。
PEDF 是一个相对分子质量为50KDa 的内源性可溶性分泌蛋白。PEDF 在人体广泛分布,皮肤以外的组织如脑、脊髓、眼、心脏、血管、肝、骨组织以外周血中,均可以检测到PEDF的表达[5]。在人体皮肤中,PEDF在表真皮及皮肤附属器均有表达[6]。此外,有研究发现人原代脂肪细胞分泌高浓度的PEDF 蛋白,本研究前期从人皮下脂肪组织抽取物提取总RNA 组织并扩增出PEDF 片断,也从组织学角度证实人皮下脂肪组织表达PEDF[7]。本研究测序结果显示PEDF 分段克隆片段序列与NM_002615.5 相比存在2 个点突变分别为,390C>T 和963C>T,但2 个点突变都是同义突变故不影响蛋白序列的表达,这与PEDF 在不同组织表达存在差异有关。
PEDF 具有抗肿瘤作用、神经营养作用、神经保护作用、抗血管新生和免疫调节等多种生物学功能[8-10]。目前PEDF 在抗肿瘤方面的研究成为研究热点,体内和体外实验证实PEDF 对前列腺癌、乳腺癌、子宫颈癌、胰腺癌、黑色素瘤等多种肿瘤具有抗肿瘤作用[11-14]。目前发现PEDF 短肽同样具有生物学活性,有研究表明PEDF 短肽对骨肉瘤、成神经细胞瘤等具有抗肿瘤作用[15-16]。因此,本研究希望筛选出抗皮肤鳞癌的PEDF 活性短肽,可以抑制皮肤鳞癌生长。通常多肽合成的长度不宜超过30 个氨基酸,否则难以保证准确性,但分段更细难度较大,因此本研究首先将PEDF 分成3 段(1-160,161-300,301-418 氨基酸)进行分段克隆,分别和表达载体连接后表达该重组蛋白并纯化。
在蛋白纯化过程中,本研究洗脱后得到的蛋白分子量分别为18 000、17 000 和13 000,与PEDF1、PEDF2 和PEDF3 分子量相符,提示分段克隆PEDF蛋白成功。为了验证分段克隆PEDF 蛋白的功能,本研究还通过CCK-8 增殖实验发现,PEDF3 呈剂量依赖性抑制皮肤鳞状细胞癌SCL-1 细胞增殖,提示PEDF-3存在抑制皮肤鳞状细胞癌增殖的功能片段,为了更准确分段克隆PEDF,我们将在后续实验中将PEDF3 分段合成更小的短肽,进一步筛选PEDF活性功能短肽,并且对融合蛋白需进一步做Western blot 或质谱分析[17-18],以明确融合表达的蛋白为目的蛋白。
综上所述,本研究成功分段克隆表达PEDF 融合蛋白,并发现PEDF3 抑制皮肤鳞状细胞癌细胞增殖,为功能性PEDF 短肽筛选提供基础,有望为皮肤鳞癌治疗提供新的思路。
