大丽轮枝菌响应赤霉素基因差异表达分析
2019-10-24赵汗青张博森高峰
赵汗青,张博森,高峰
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
赤霉素(Gibberellins,GA)是一种四环二萜类物质,是自然界中广泛存在的一种植物激素,在被子植物、裸子植物、真菌和细菌中均有广泛分布[1]。赤霉素由日本植物病理学研究水稻恶苗病(Rice bakanae)的过程中发现。目前,已经从植物、真菌和细菌中发现赤霉素类物质136种,其中GA3是目前研究最为清楚的一类赤霉素[2]。
大丽轮枝菌(Verticilliumdahliae)是一种土传植物病原真菌,是引起我国棉花黄萎病的主要病原菌,对农业生产造成的巨大的危害,可以侵染棉花、向日葵等200多种重要的经济作物[3]。因大丽轮枝菌成功逃避寄主先天免疫的机制尚不清楚,加上植物种质资源中抗原的缺乏,黄萎病目前并没有有效的防治手段。
近期,中科院微生物所钱韦课题组[4-5]发现植物激素在植物-病原细菌跨界信号交流过程中发挥重要功能。在致病病原真菌中同样有研究[6-7]发现,毛霉和根霉菌可以通过响应植物来源的赤霉素信号,增加其自身细胞壁中壳聚糖的含量。我们前期研究也发现,大丽轮枝菌侵染结构和芽管细胞壁中含有一定量壳聚糖成分,并且与植物的赤霉素信号相关。我们推测这种细胞壁成分的动态变化,可能与大丽轮枝菌逃避寄主的先天免疫相关。
转录组测序是近年兴起的一种高通量测序技术,可快速获得某一物种特定组织或功能状态下几乎所有转录本及基因序列,运用该技术对不同处理中的转录本比较和分析,有助于挖掘样本在不同处理下的响应情况[8-11]。本研究利用RNA-Seq比较分析了强致病力大丽轮枝菌菌株V592在GA3处理下的基因表达情况,进行了相关生物信息学分析。研究结果对于进一步解析大丽轮枝菌响应赤霉素信号的分子机制具有重要参考价值。
1 材料与方法
1.1 试验材料
供试菌株为强致病力大丽轮枝菌V592,由石河子大学植物病理教研室提供。
赤霉素GA3购自Sigma-Aldrich(CAS:G7645-6);NaNO3、K2HPO4和柠檬酸等其他常用试剂均为国产或者进口分析纯试剂。
1.2 样品准备
PDA(potato dextrose agar)培养基、Czapek’s液体培养基参照Zhao[12]的方法配置。
大丽轮枝菌在PDA培养基上培养,培养时间为5~7 d,培养条件为26 ℃,避光。赤霉素GA3用无水乙醇溶解后用去离子水稀释到10 μmol/L的工作浓度。
大丽轮枝菌分生孢子收集:V592平板上用无菌打孔器打取直径1 cm的菌饼,将6~8块菌饼接种到100 mL Czapek’s液体培养基中,26 ℃、200 rpm避光摇培2 d,经4层纱布过滤收集孢子。
赤霉素诱导:将收集好的孢子悬浮在5 ml无菌水中,孢子浓度为1×108cfu·L-1,分装为2份。分别将GA3母液和等量的无菌水加入至2份孢子悬浮液中,使赤霉素的终浓度为0.1 μmol·L-1,26 ℃,200 rpm避光震荡1 h后离心收集分生孢子,去除上清,置于液氮中冻存备用。
1.3 RNA提取及转录组测序
取适量上述收集的分生孢子,使用Invitrogen公司的Trizol试剂盒提取总RNA,提取方法参照User Guide:TRIzol Reagent(Invitrogen)。
提取完毕后,用NanoPhotometer spectrophotometer分光光度计检测RNA纯度(OD260/OD280及OD260/OD230)。使用Agilent 2100 bioanalyzer来精确检测RNA完整性。
1.4 cDNA文库的构建与质检
cDNA文库的构建与检测由北京诺禾致源公司完成。以片段化mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA第1条链。随后用RNase降解RNA链,并在DNA polymerase I体系下,以dNTPs为原料合成cDNA第2条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选250~300 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。
文库构建完成后,先使用Qubit 2.0 Fluorometer进行初步定量。对文库稀释至1.5 mg·L-1,随后使用Agilent 2100 bioanalyzer对文库的insert size进行检测,insert size符合预期后,qRT-PCR对文库有效浓度进行准确定量(文库有效浓度高于2 nmol·L-1),以保证文库质量。
1.5 上机测序及测序数据组装
转录组上机测序及测序数据组装均由北京诺禾致源公司完成。使用平台Illumina Hiseq 2000进行转录组文库测序,测序条件为PE 150,双端序列150 bp。对原始序列进行数据过滤:去除带接头(adapter)的reads,去除含N(N表示无法确定碱基信息)的reads以及去除低质量reads,获得较高质量的序列。我们使用HISAT 2进行spliced reads比对,并采用Trinity软件进行序列组装,获得2个样品的功能基因。
1.6 基因差异表达分析及功能注释
基因表达定量由北京诺禾致源公司完成,根据基因在参考基因组上的位置信息,统计每个基因从起始到终止范围内覆盖的reads数目。采用subread软件中的featureCounts工具对基因进行表达水平的定量,featureCounts主要使用Q10-B-C参数,分别过滤掉比对质量值低于10的reads,非成对比对上的reads,比对到基因组多个区域的reads。基因表达定量完成后,需要对其表达数据进行统计学分析,筛选样本在不同状态下表达水平显著差异的基因。
根据功能基因在处理组和对照组中的表达量进行差异表达分析,使用edgeR软件进行差异显著性分析(FC>1或者padj<0.05);差异表达基因的功能注释由北京诺禾致源公司完成,采用clusterProfiler软件对差异基因集进行GO(Gene Ontology,http:// www.geneontology.org/)、功能富集分析,KEGG(Kyoto Encyclopedia of genes and genomes,http://www.gebime.jp/kegg/)通路富集分析等。
2 结果与分析
2.1 大丽轮枝菌GA3处理组和对照组总RNA质量分析
对提取的GA3处理组和对照组总RNA的质量进行检测,结果如表1所示。处理组和对照组总RNA完整性均大于8.0,且OD260/OD280均大于2.0,总RNA质量浓度分别为172和181 mg·L-1,说明样品总RNA的完整性与纯度合格达到测序要求。
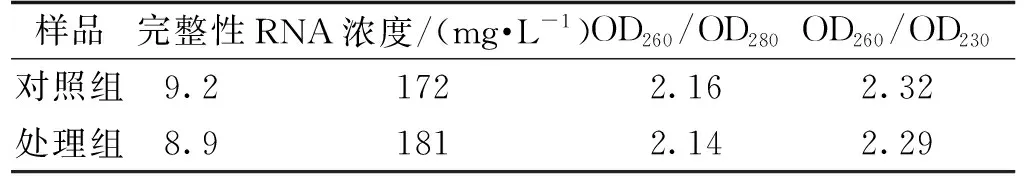
表1 大丽轮枝菌总RNA质量检测结果Tab.1 RNA quality test results of Verticillium dahliae
2.2 大丽轮枝菌GA3处理组和对照组转录组测序及测序数据组装
利用Illumina Hiseq 2000对GA3处理组和对照组进行转录组文库测序,数据质量汇总如表2所示。大丽轮枝菌GA3处理组和对照组测序分别获得8.28 G和7.98 G数据量,GC含量分别为59.07%和59.15%,其质量值大于30的(Q30)分别为91.17%和91.23%,质量值大于20(Q20)的分别为96.51%和96.54%。
采用Trinity软件对去冗余后的高质量序列进行组装,共获得9184和9164个功能基因。

表2 大丽轮枝菌转录组测序数据质量汇总Tab.2 Summary of the quality of transcriptome sequencing data of Verticillium dahlia %
2.3 大丽轮枝菌GA3处理组和对照组转录组功能基因差异表达分析及功能注释
2.3.1 显著差异表达基因(DEGs)
通过差异表达基因数据分析,与无菌水处理的对照组相比,大丽轮枝菌GA3处理组中共有161个DEGs,其中70个上调基因,91个下调基因。
2.3.2 GO功能富集分析
GO功能富集以padj小于0.05作为为显著性富集的阈值,对98个DEGs进行GO功能富集分析。其中43个上调和55个下调的DEGs被标记为30个功能类别,其中包括16个生物过程(BP)、3个细胞组分(CC)和11个分子功能(MF)。生物过程(BP)中最主要的是单一生物过程,其次是单一生物代谢过程、氧化还原过程、有机酸代谢过程和蛋白质复合物亚基组织等;细胞组分(CC)中最主要的是膜的积分分量,其次是宿主细胞核、宿主细胞内细胞器、宿主细胞内膜有界细胞器;分子功能(MF)中最主要的是氧化还原酶活性,其次是NAD或NADP作为受体,辅因子结合等。这证明了单一生物过程、氧化还原过程、有机酸代谢过程、宿主细胞核和氧化还原酶等功能可能与大丽轮枝菌响应赤霉素有关(图1)。
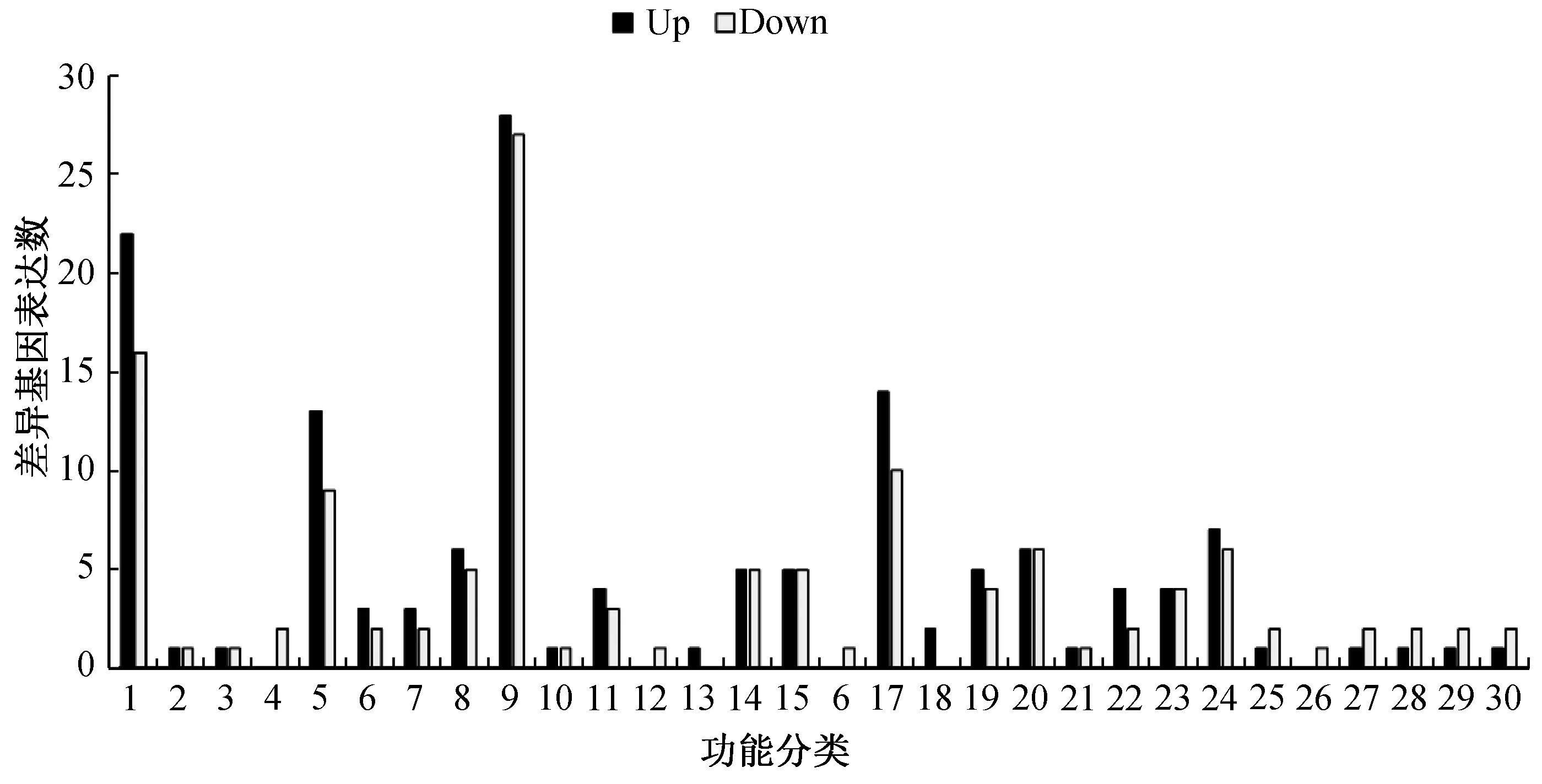
纵坐标为差异基因表达数;横坐标为GO Term,生物过程(BP,1—16):1—单一生物代谢过程;2—己糖生物合成过程;3—单糖生物合成过程;4—调节DNA代谢过程;5—氧化还原过程;6—辅酶代谢过程;7—蛋白质复合物亚基组织;8—有机酸代谢过程;9—单一生物过程;10—三羧酸代谢过程;11—辅助因子代谢过程;12—甘露糖生物合成过程;13—氰酸代谢过程;14—羧酸代谢过程;15—含氧酸代谢过程;16—硫氨基酸生物合成过程;分子功能(MF,17-27):17—氧化还原酶活性;18—苹果酸脱氢酶活性;19—氧化还原酶活性,作用于供体的CH-OH基团;20—辅酶结合;21—亚甲基四氢叶酸脱氢酶(NADP +)活性;22—四吡咯结合;23—氧化还原酶活性,作用于供体的CH-OH基团,NAD或NADP作为受体;24—辅因子结合;25—蛋白质组氨酸激酶活性;26—磷酸甘露糖酶活性;27—磷酸转移酶活性,含氮基团作为受体;细胞组成(CC,28-30):28—宿主细胞核;29—宿主细胞内细胞器;30—宿主细胞内膜有界细胞器。图1 差异表达基因GO功能注释Fig.1 GO classification of all differentially expressed genes
2.3.3 KEGG通路分析
KEGG(Kyoto Encyclopedia of Genes and Genomes)是整合了基因组、化学和系统功能信息的综合性数据库。为了解大丽轮枝菌在赤霉素处理情况下差异表达基因(DEGs)参与的代谢途径,通过KEGG数据库对DEGs进行分析共有68个上调的DEGs和30个下调的DEGs被标注于20个KEGG通络中,结果如图2A所示。次级代谢产物的生物合成途径(KEGG ID-vda01110,共有26个DEGs被标注)是最显著的(图2B),其次是丙酮酸代谢(KEGG ID:vda00620,共有7个DEGs被标注),乙醛酸和二羧酸根阴离子代谢(KEGG ID:vda00100,共有6个DEGs被标注),抗生素生物合成代谢(KEGG ID:vda01130,共有17个DEGs被标注)。实验结果表明,与大丽轮枝菌响应外源赤霉素相关的代谢通路主要包括次级代谢产物的生物合成途径、丙酮酸代谢和乙醛酸和二羧酸根阴离子代谢等。

A—KEGG富集通路差异表达基因数量;B—KEGG富集通路显著性分析;1—次级代谢产物的生物合成,2—丙酮酸代谢,3—乙醛酸和二羧酸根阴离子代谢,4—生物合成的抗生素,5—碳代谢,6—类固醇生物合成,7—果糖和甘露糖代谢,8—羧酸循环,9—苯丙烷代谢,10—糖酵解-糖质新生,11—氮代谢,12—精氨酸和脯氨酸代谢,13—硫代谢,14—丙氨酸,15—天门冬氨酸和谷氨酸代谢,16—苯丙氨酸、酪氨酸和色氨酸代谢,17—精氨酸生物合成,18—酮戊二酸代谢,19—氨基甲酸代谢,20—淀粉和蔗糖代谢,其他多糖降解。图2 差异表达基因KEGG功能分类Fig.2 KEGG classification of all differentially expressed genes
3 结论与讨论
对大丽轮枝菌响应外源赤霉素GA3进行转录组分析和差异表达分析,结果表明,大丽轮枝菌中多种生物过程及代谢通路参与了对外源赤霉素的响应。
根据HÉRIVAUX A等[13]研究发现,人们仅在几种早期分化真菌中鉴定到了识别植物激素信号的受体,但是这些真菌都属于根际共生真菌或者内生真菌,在高等病原真菌并没有相关报道,也并未在真菌中发现与响应赤霉素相关的基因。植物中的识别赤霉素的机制、赤霉素的代谢网络和次生壁的合成机制研究的较为清楚[14-15],但我们并没有在真菌基因组中找到相关的同源蛋白,说明真菌响应赤霉素的机制可能与植物不同有关。真菌细胞壁作为一个活的细胞器,其组分是一个动态变化的过程,我们的前期研究发现,大丽轮枝菌侵染结构和芽管细胞壁中含有一定量壳聚糖成分,并且与植物的赤霉素信号相关。
我们研究发现,大丽轮枝菌在响应赤霉素过程中,差异表达基因主要富集在次级代谢产物的生物合成途径,并且相较于对照组全部为上调表达,这与禾谷镰刀菌在侵染早期的转录组学研究[16]结果一致。在大丽轮枝菌和镰刀菌次级代谢产物的研究中发现,次级代谢产物磺胺醋酰和单端孢霉烯霉菌毒可以在侵染早期帮助病原菌侵染宿主[17-18],说明次级代谢产物合成在真菌侵染宿主植物的致病过程中发挥重要作用。赤霉素是植物的主要激素之一,在病原菌早期的侵染过程中,赤霉素可能作为一个跨界信号而被大丽轮枝菌识别。因此,我们推测大丽轮枝菌在响应外源赤霉素过程中,部分次级代谢产物生物合成相关基因的上调表达可能与侵染宿主早期的致病过程有关。
