诺帝-褐藻酸钠微球血管内介入治疗兔VX2肝癌
2019-10-22杨巧丽蒲洪波廖运国何学红
杨巧丽,游 箭,蒲洪波,廖运国,胡 鸿,魏 欣,何学红
(1.重庆市妇幼保健院放射科,重庆 401120;2.川北医学院第二临床医学院南充市中心医院介入放射科,四川 南充 637000;3.贵黔国际总医院介入科,贵州 贵阳 550018)
肝癌在全球癌症相关死因中居第2位[1]。TACE是中晚期肝癌的首选治疗方法[2],但栓塞后肿瘤内部缺血缺氧可逐渐诱导新生血管形成,促进肿瘤复发、转移[3]。诺帝是人工合成的类去甲二氢愈创木酸化合物,具有相似的结构和生物效应,对多种肿瘤及新生微血管具有抑制作用[4-5]。海藻酸钠微球(kelp miero gelation, KMG)是新型栓塞剂,具有无毒、生物相容性较好及生物降解性等物理特性,已广泛用于介入治疗肿瘤。将抗肿瘤药物包载于微球内制成载药缓释微球,是当前研究热点[6],可于目标部位缓慢释放药物,保持稳定的血药浓度,提高肿瘤局部药物生物利用度,减少给药次数,降低全身毒副作用[7]。本研究探讨诺帝-KMG血管内介入治疗兔VX2肝癌的效果。
1 材料与方法
1.1 实验动物与试剂 健康新西兰大白兔50只,雌雄各半,体质量2.0~2.5 kg,重庆渝达实验兔场提供(重庆市实验动物质量合格证0002926)。VX2荷瘤兔由重庆医科大学实验动物中心提供。诺帝来自陆军军医大学西南医院病理研究所,KMG来自北京圣医耀公司。将海藻酸钠加入磷酸盐缓冲液(PBS,pH 7.4)中稀释,将诺帝加入4% CaCl2溶液中快速搅拌至溶解(终浓度为5 mmol/L),再将浓度为3.5%海藻酸钠溶液逐渐滴加至配制好的CaCl2溶液中,剧烈搅拌,静置4 h,离心,吸干微球表面水分,分离微球,低温干燥,得到诺帝-KMG。
1.2 实验兔模型建立 取出VX2荷瘤兔大腿内侧肿瘤组织,选取肿瘤边缘活性较强的灰白色鱼肉样质韧组织,剪成大小约1 mm3的组织。麻醉实验兔后仰卧位保定,沿剑突偏左侧1 cm逐层开腹,暴露肝左叶,用镊子轻拉出肝左叶,眼科剪刺破肝左叶较厚部位形成窦道,植入2~3块瘤块,再用明胶海绵填塞。将肝左叶回纳入腹腔后逐层缝合切口。术后肌肉注射抗生素3天预防感染。
1.3 仪器与方法 建模后2周行介入治疗。采用GE DSA(LCV+)机,腹部造影模式,管电压1 250 kV,管电流800 mA。将实验兔随机分为A、B、C、D、E组,每组10只,麻醉后经股动脉穿刺,经由微导丝引入微导管,行腹主动脉(1 ml/s,3 s)、肝固有动脉(0.5 ml/s,3 s)造影,之后超选至靶血管灌注药物,A、B、C、D、E组灌注药物分别为生理盐水、诺帝、KMG、5-氟尿嘧啶(5-fluorouracil, 5-FU)+KMG、诺帝-KMG 1 ml/kg体质量,之后造影评估栓塞程度。
于治疗前1天及之后2周行增强CT扫描。采用GE Lightspeed 16排螺旋CT机,管电压100 kV,管电流100 mA,层厚1.25 mm,FOV 160 mm×160 mm,经耳缘静脉以0.5 ml/s速率注入非离子对比剂碘海醇5 ml,注射对比剂后13 s及70 s行肝脏双期扫描,测量病灶最大径(a)及最小径(b)。
1.4 肿瘤体积增长率检测 术后2周行CT增强扫描后处死实验兔,取出肝脏及肿瘤,计算肿瘤体积V(V=1/2×a×b2)及体积增长率。体积增长率=(术后V-术前V)/术前V×100%。
1.5 病理学检测 以4%甲醛溶液固定载瘤兔肝,石蜡包埋后切片,HE染色后观察肿瘤组织镜下表现,以免疫组织化学染色观察血管内皮生长因子(vascular endothelial growth factor, VEGF)及CD31表达。采用Weidner计数法计算微血管密度(microvessel density, MVD),在低倍镜(×100)下选取血管“热点”区,即胞质内含棕黄色颗粒的血管内皮细胞(CD31阳性细胞)最密集的区域,于高倍镜(×400)下在染色良好、背景清晰的视野内计数,将孤立的血管内皮细胞或细胞簇或管腔<50 μm的微血管视为1个肿瘤微血管,计数5个视野并取其平均值作为最终结果。VEGF阳性细胞占总细胞百分比<5%为阴性(-),≥5%为阳性。
1.6 统计学分析 采用SPSS 19.0统计分析软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
50只兔均建模成功。D、E组各1只兔死于介入治疗并发症,A组1只因血管变异致手术失败,最终纳入47只兔。
术前CT平扫示实验兔肝脏类圆形低密度影、边界清楚,增强扫描呈明显环形强化、中心密度较低(图1)。术后2周兔肝癌体积不同程度增加,中心坏死更明显,部分可见肝、肺内小结节状转移灶及淋巴结转移。

图1 建模成功实验兔增强CT图像 图2 介入治疗前实验兔DSA图像 A.动脉期; B.实质期
术前DSA示动脉期肿瘤动脉增多、增粗、纡曲,局部血管网聚集成团呈“抱球征”(图2A),实质期肿瘤由边缘环形显影逐渐呈结节状显影(图2B);术后肿瘤显影消失,邻近部分细小肝动脉未显影。
2.1 肿瘤体积及体积增长率 术前1天各组兔肿瘤体积差异无统计学意义(P>0.05);术后2周,各组实验兔肿瘤体积及体积增长率总体差异有统计学意义(P均<0.01),A、B组肿瘤体积及体积增长率均大于C、D、E组(P均<0.05)。见表1。
表1 各组兔术前1天及术后2周肿瘤体积及体积增长率比较(±s)

表1 各组兔术前1天及术后2周肿瘤体积及体积增长率比较(±s)
组别体积(cm3)术前1天术后2周体积增长率(%)A组(n=9)1.42±0.237.71±0.54460.94±112.14B组(n=10)1.50±0.187.55±0.82435.27±105.71C组(n=10)1.44±0.173.94±0.34∗#176.76±36.94∗#D组(n=9)1.51±0.183.44±0.48∗#131.82±47.90∗#E组(n=9)1.55±0.213.28±0.33∗#118.10±31.64∗#F值0.83173.54427.61P值0.51<0.01<0.01
注:*:与A组比较,P<0.05;#:与B组比较,P<0.05
2.2 VEGF表达及MVD VEGF阳性细胞主要分布于瘤周及栓塞后残存瘤组织内,胞浆呈棕黄色、黄色或棕褐色,条索状、弥漫状或灶状(图3)。5组间VEGF阳性率差异有统计学意义(P<0.01),E组低于其他各组(P均<0.05),C组高于其他各组(P均<0.05),见表2。
镜下可见孤立性棕黄色、棕褐色的血管内皮细胞及由多个血管内皮细胞聚集成的圆形、类圆形细胞簇或条索状微小血管,其间相互交错、连通(图4)。5组间MVD总体差异有统计学意义(P<0.01),E组MVD低于与其他各组(P均<0.05)。

表2 各组兔肿瘤组织VEGF阳性率及MVD比较
3 讨论
3.1 VEGF表达及MVD与肿瘤复发、转移的关系 肿瘤生长过快超过肿瘤血管供给能力或肿瘤血管被阻断时,肿瘤细胞缺血、缺氧,分泌以VEGF为主的大量促血管生长因子。VEGF作用多样,与血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)-2结合后启动下游信号通路,逐步介导肿瘤血管生成[8]、提高肿瘤血管通透性[9]而致MVD升高,使肿瘤细胞血供丰富而进一步增殖,脱落的肿瘤细胞随血液循环转移至全身其他部位。VEGF可多途径、多步骤促进微血管形成,导致肿瘤复发、转移。研究[10-11]表明,在结肠癌的发生发展过程中,VEGF可通过自分泌方式与肿瘤细胞表面受体结合,直接刺激肿瘤细胞增殖。Lesslie等[12]发现,结肠癌中的VEGF可与VEGFR-1受体结合,激活Src信号通路,促进肿瘤细胞转移。肝癌为富血供肿瘤,肿瘤组织中VEGF高表达,肿瘤内部微血管丰富。合理选用抗血管生成药物,可以降低肿瘤促血管生长因子表达,与抑血管生长因子达到平衡,促进肿瘤血管构筑表型向正常化转归,降低MVD,提高疗效[13]。
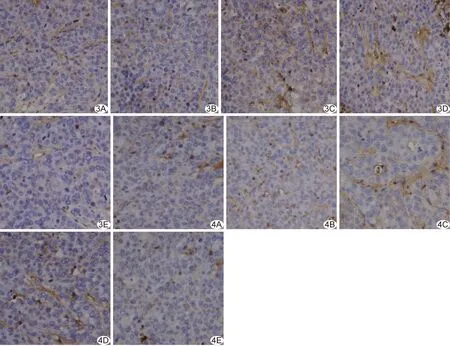
图3各组兔肝癌组织VEGF免疫组织化学图(×400) A~E.分别为A~E组图4各组兔肝癌组织CD31免疫组织化学图(×400) A~E.分别为A~E组
3.2 诺帝-KMG 诺帝可抑制肿瘤血管生成及生长,给药方式包括静脉滴注及动脉内灌注。静脉滴注创伤小,但全身血药浓度及毒副作用大;动脉内灌注为有创性治疗,但局部血药浓度高、全身毒副作用小,可在抑制肿瘤血管生成的同时阻断肿瘤血供,使肿瘤细胞缺乏营养物质供应而“饿死”。何学红等[14]以携带诺帝的聚乙烯醇(PVA)颗粒栓塞兔VX2肝癌,术后实验兔不良反应较轻,肿瘤体积较对照组(注射生理盐水)及TACE组(注射碘化油乳剂+顺铂)明显减小,血清VEGF显著降低,提示其用于栓塞治疗肝癌安全有效,不仅能明显抑制肿瘤生长,还能减少肿瘤血管生成。但PVA颗粒作为一种永久栓塞剂,具有膨胀速度快、易堵管、在体内不可降解等缺点,其对子宫肌瘤的效果不及KMG[15]。
本研究成功将诺帝包载于栓塞剂KMG中,制成诺帝-KMG聚合物,用于血管内介入栓塞治疗兔VX2肝癌,较好地控制了肿瘤体积,仅1只兔出现严重并发症而死亡,提示其相对安全、有效。
3.3 诺帝-KMG对VEGF、MVD的影响 TACE是治疗中晚期肝癌的首选方法,通过栓塞肿瘤供血动脉而诱导肿瘤细胞发生缺血缺氧性坏死,并于局部灌注化学治疗药物而直接杀死肿瘤细胞[2];但VEGF与肝癌TACE术后复发存在相关性[16],TACE术后常因VEGF高表达而诱导新生血管形成,促进肿瘤复发、转移,使远期疗效欠佳[3]。本研究C、D组VEGF、MVD最高,镜下呈密集阳性表达,原因可能为栓塞后肿瘤内部因缺血缺氧而刺激VEGF分泌,形成大量新生微血管,与相关报道[17]相符;B组VEGF、MVD虽低于A组,但差异无统计学意义,提示单次经导管灌注诺帝可能在一定程度上抑制VEGF生成,但作用时间短、效果有限;E组VEGF、MVD最低,表明诺帝-KMG物理特性良好,于病变部位持续缓慢释放诺帝,肿瘤内部持续接受诺帝作用,生物利用度高,可明显抑制肿瘤内部VEGF生成,MVD也因此降低。本研究C、D、E组肿瘤体积增长率均低于A、B组,证实介入治疗对控制肝癌体积增长具有显著疗效;D、E组术后肿瘤体积增长率低于C组,提示诺帝具有一定抗肿瘤细胞生长作用,且与5-Fu无显著差别。
综上所述,诺帝-KMG是安全有效的载药栓塞剂,可抑制兔VX2肝癌TACE术后VEGF表达及新生血管形成,且在一定程度上抑制肿瘤细胞生长。
