Runx2在TGF-β1诱导的肺癌A549细胞上皮-间质转化过程中的作用研究
2019-10-17耿文文高海东
耿文文,蒲 倩,高海东
山东大学齐鲁医院(青岛)普外科,山东 青岛 266000
肿瘤转移是一个复杂而有序的过程,主要包括:瘤细胞从原发瘤解离,穿过细胞外基质,侵入血管,在血循环中生存,侵出血管,并在远隔部位增殖形成微灶,继续生长最终形成临床可见的转移灶,瘤细胞必须完成所有这些过程才能形成转移瘤[1]。在整个过程中,肿瘤细胞首先需要获得侵袭和移动能力才有可能启动转移,因此这一步骤被认为是肿瘤转移过程中的限速步骤,而上皮-间质转化(epithelialmesenchymal transition,EMT)过程又是其中的关键步骤[2],在肿瘤的侵袭和转移过程中有重要意义,阻止恶性上皮细胞的EMT过程则有可能成为阻止肿瘤转移的新思路。Runx2是多瘤病毒增强子结合蛋白2/核心结合因子(polyomavirus enhancer binding protein 2/core binding factor,PEBP2/CBF)转录因子家族的成员,可以调节基质金属蛋白酶(matrix metalloproteinase,MMP)、骨桥蛋白(osteopontin,OPN)和骨唾液酸蛋白(bone sialoprotein,BSP)等肿瘤转移相关蛋白的表达[3]。研究表明,Runx2是转化生长因子-β(transforming growth factor-β,TGF-β)通路中重要的组成部分,而TGF-β通路在肿瘤细胞EMT过程中具有重要的作用[4-5],所以本研究着重探讨TGF-β诱导的EMT过程以及Runx2在其中发挥的作用。
1 材料和方法
1.1 主要试剂及细胞系
人肺癌细胞系A549由天津医科大学附属肿瘤医院中心实验室惠赠,传代培养于RPMI-1640培养液中,在37 ℃、CO2体积分数为5%、饱和湿度的条件下贴壁生长。RPMI-1640及胎牛血清购于美国Hyclone公司;TGF-β1购自美国PeproTech公司;纤维连接蛋白(fibronectin)抗体、Runx2抗体、E-cadherin抗体和波形蛋白(vimentin)抗体购自美国Abcam公司,p-Smad2/3抗体、p-AKT抗体(Cell Signaling USA)和p-ERK1/2抗体购自美国Cell Signaling公司,β-actin单克隆抗体(鼠抗人)、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔多克隆抗体和HRP标记山羊抗鼠多克隆抗体购自北京中杉金桥生物技术有限公司;脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司,LY294002[磷酸肌醇3激酶/蛋白激酶B(phosphatidylinositide3-kinases/protein kinase B,PI3K/AKT)通路抑制剂]、PD98059[丝裂原活化蛋白激酶/细胞外信号调节激酶(mitogen-activated protein kinase/extracellular signal-regulated kinase,MAPK/ERK)通路抑制剂]和Runx2-siRNA购自美国Selleck公司。
1.2 TGF-β1诱导EMT实验[6]
EMT是具有极性的上皮细胞转换成具有活动能力、能够在细胞基质间自由移动的细胞的过程。该过程包括细胞形态学的改变及基因型的改变,具体包括:① 细胞黏附分子如E-钙黏蛋白(E-cadherin)表达减少,导致立方上皮细胞失去细胞间相互作用,细胞极性丧失;② 立方上皮细胞的细胞角蛋白结构改变,外形演变为纺锤形纤维细胞形态;③ 获得了纤维原细胞或间质细胞的“特性”,包括vimentin及其他间质蛋白如fibronectin表达的上调,细胞获得较强的侵袭和移动能力。
将A549细胞消化离心后制成细胞悬液,向6孔板中接种,加入含10%胎牛血清的RPMI-1640培养液培养。使细胞生长均匀,直至贴壁。待显微镜下观察细胞已长至6孔板底壁的80%左右,向瓶中加入约2 mL RPMI-1640培养液,饥饿细胞12 h过夜后加入TGF-β1母液,将浓度调整为0.0、0.5、1.0、2.5、5.0和10.0 ng/mL。将6孔板置于 37 ℃、CO2体积分数为5%的温箱中培养,设不同的时间点(0、12、24、48、72和96 h)观察细胞形态变化并拍照。
1.3 脂质体介导的真核细胞siRNA转染
以不含血清和抗生素的RPMI-1640培养基 5 0 0 μ L 分别稀释两种s i R N A 母液及非特异性siRNA母液至终浓度为10 nmol/L,此为A液,室温放置5 min;以不含血清和抗生素的RPMI-1640培养基500 μL分别稀释10 μL的LipofectamineTM2000三管,此为B液,室温放置5 min。分别轻柔混合AB液,室温放置20 min,将混匀后的AB液分别均匀地滴入含4 mL RPMI-1640培养基(不含血清和抗生素)的细胞培养皿中,混匀,放入细胞培养箱内。转染后6 h更换完全培养基继续培养,分别收集转染24、48、72和96 h的细胞,采用蛋白质印迹法(Western blot)鉴定Runx2蛋白的抑制效果,筛选最佳的干扰序列、作用时间和干扰浓度。
1.4 Western blot检测蛋白水平
消化收集各组的细胞,提取细胞蛋白后应用BCA蛋白定量法测定蛋白含量。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,于冰上湿转,转膜后置于含5%牛血清白蛋白的洗膜缓冲液(TRIS-buffered saline Tween,TBST)中封闭2 h,加入一抗,4 ℃温育过夜,TBST振荡洗膜10 min×3次,以封闭液稀释的HRP标记的山羊抗小鼠及山羊抗兔IgG二抗(1∶5 000)室温温育1 h,TBST洗膜10 min×3次。于暗室中加入ECL显色液曝光,采用Image J进行灰度分析
1.5 统计学处理
所获数据应用SPSS 18.0统计软件进行分析,结果采用ANOVA单因素方差分析,两组组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TGF-β1可以诱导A549细胞发生EMT
首先根据相关研究[6]确定了TGF-β1诱导肺癌细胞系A549发生EMT形态变化的最佳浓度和时间,分别利用不同浓度(0.0、0.5、1.0、2.5、5.0和10.0 ng/mL)TGF-β1诱导细胞,在不同时间点(0、12、24、48、72和96 h)利用相差光学显微镜评估TGF-β1诱导的细胞形态学变化。结果显示,5 ng/mL TGF-β1在48 h可以使A549细胞发生形态改变,72 h之后更加显著。A549细胞培养在空白对照组呈现经典的鹅卵石上皮形态和生长模式,但是经过5 ng/mL TGF-β1处理后,细胞形态逐渐变为长梭形,极性丧失,细胞变得离散,呈现更多的纤维母细胞形态并减少了细胞间的连接(图1)。同时,在TGF-β1 5 ng/mL诱导细胞48 h后,与对照组相比,实验组中细胞黏附分子E-cadherin蛋白水平下降(P<0.05),而间质蛋白vimentin、fibronectin表达显著上调(P<0.05),证明在此过程中TGF-β1诱导A549细胞发生了EMT。与对照组相比,Runx2的表达也发生上调,差异有统计学意义(P<0.05,图2)。
2.2 干扰Runx2表达可以抑制肿瘤细胞发生EMT
设立空白对照组、TGF-β1组及siRunx2干扰组,后两组分别利用5 ng/mL TGF-β1处理细胞,48 h后观察细胞形态学改变并检测EMT相关蛋白的表达变化。与空白对照组相比,TGF-β1组细胞发生形态学改变,细胞形态逐渐变为长梭形,极性丧失,细胞变得离散(图3);而经过Runx2-siRNA处理下调Runx2表达的细胞,加入TGF-β1刺激细胞之后,与对照组相比细胞并没有出现明显的形态变化。TGF-β1刺激细胞48 h后细胞的间质蛋白vimentin、fibronectin表达上调,而上皮蛋白E-cadherin表达下降,差异有统计学意义 (P<0.05);而经过Runx2-siRNA处理下调Runx2的表达的细胞,加入TGF-β1刺激,EMT相关标志蛋白E-cadherin、vimentin、fibronectin表达未发生明显变化,差异无统计学意义 (P>0.05,图4)。由此可见,干扰Runx2表达抑制TGF-β1诱导A549肿瘤细胞发生EMT。
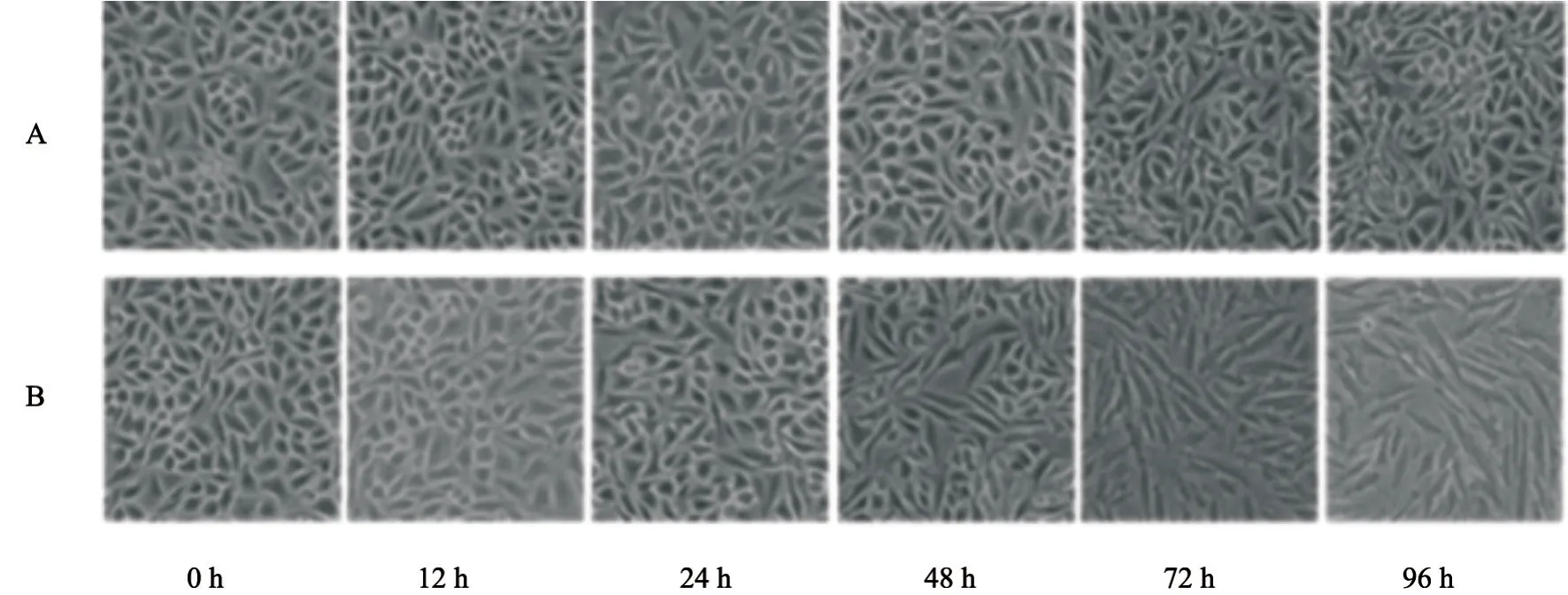
图 1 TGF-β1诱导的EMT过程中A549细胞形态变化Fig. 1 Morphological changes of A549 cells induced by TGF-β1 in the EMT process
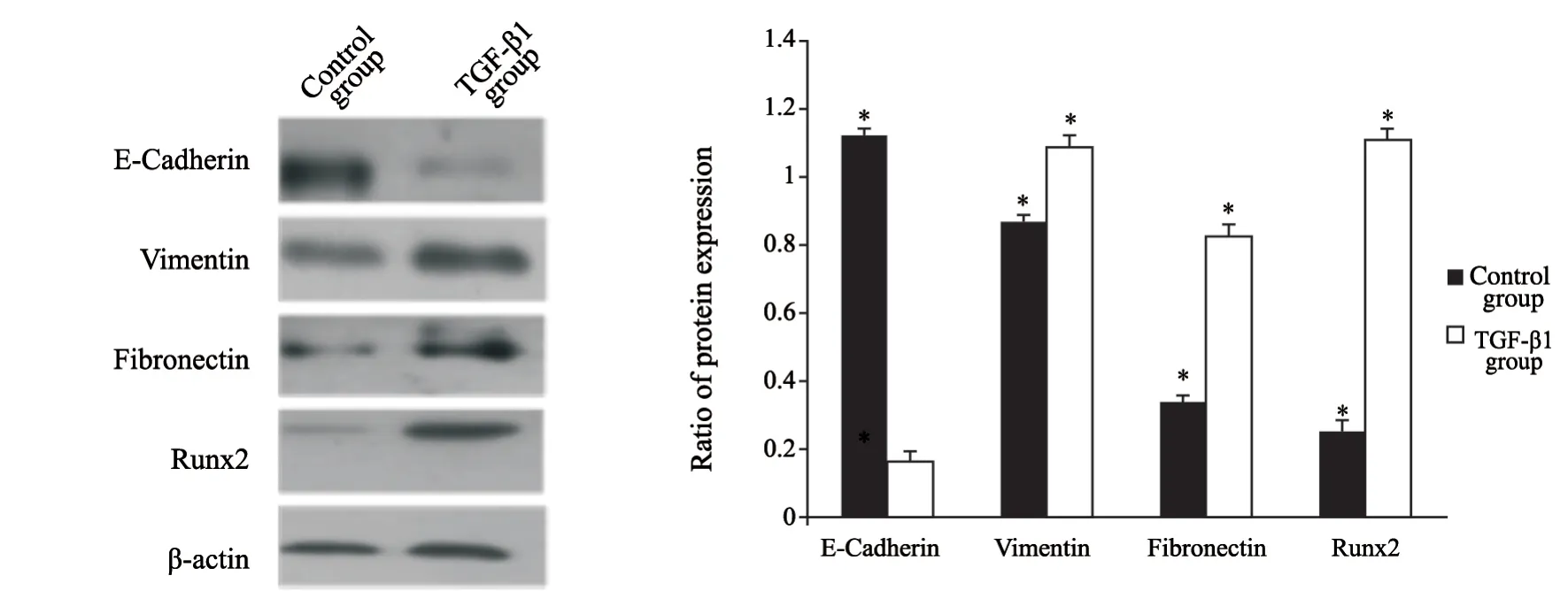
图 2 5 ng/mL 的TGF-β1作用于细胞48 h后,EMT相关标志蛋白及Runx2蛋白的表达变化Fig. 2 Comparison of EMT-related marker expression and Runx2 in response to 5 ng/mL TGF-β1 after 48 h
2.3 TGF-β1诱导A549细胞发生EMT过程中,激活了Smad2通路及旁路PI3K/AKT和MAPK/ERK通路
设立空白对照组及实验组,实验组利用5 ng/mL TGF-β1处理细胞1、3和6 h,通过Western blot检测TGF-β通路相关蛋白磷酸化水平变化研究通路活化情况。与对照组相比,TGF-β1刺激细胞后,Smad2蛋白磷酸化增强(P<0.05),Smad2通路被激活;同时旁路蛋白AKT和ERK磷酸化增强,差异有统计学意义(P<0.05,图5)。结果说明,TGF-β1刺激A549细胞后,除了经典的Smad2通路,PI3K/AKT和MAPK/ERK通路也被激活。
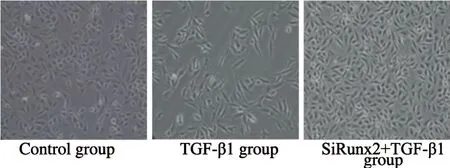
图 3 干扰Runx2表达阻止TGF-β1诱导A549细胞发生EMT形态变化Fig. 3 Interference with Runx2 expression prevented EMT morphological changes of A549 cells induced by TGF-β1
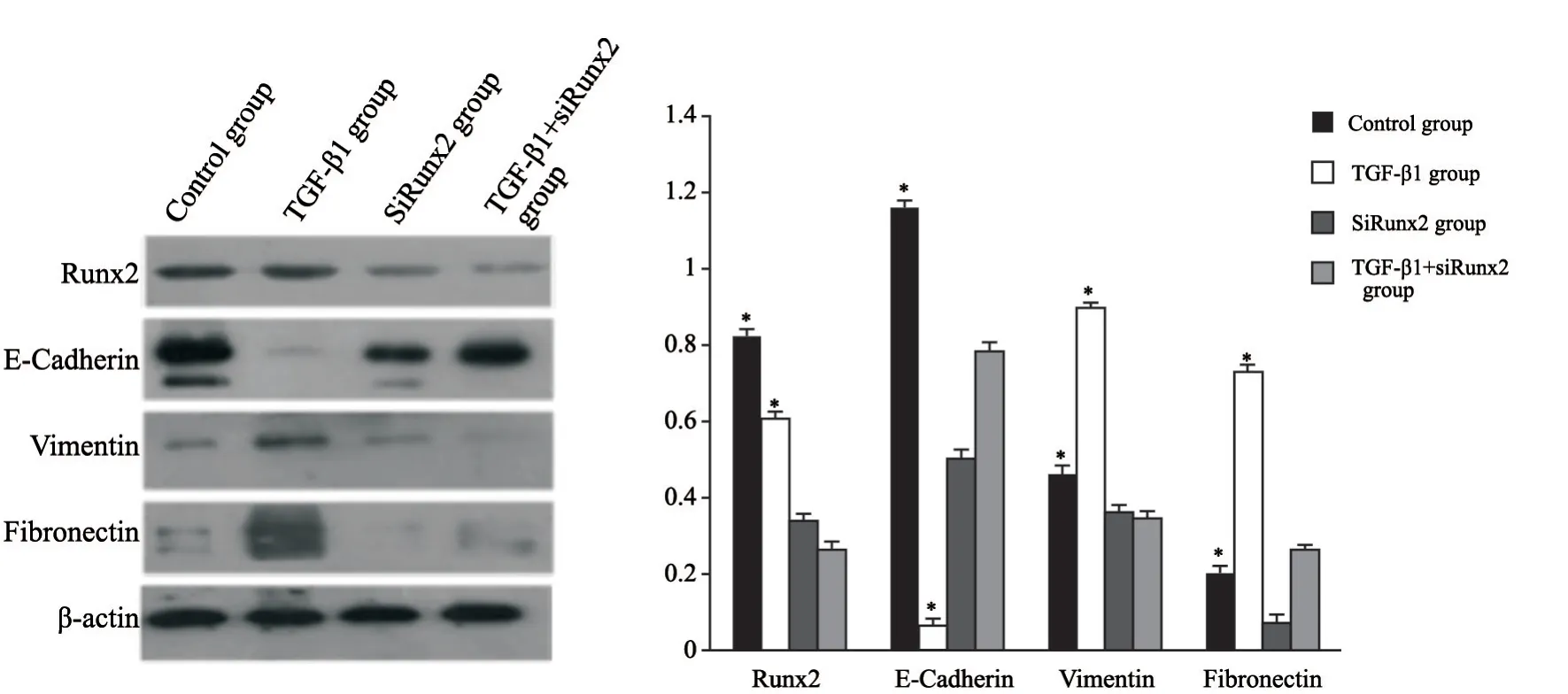
图 4 干扰Runx2表达对于A549细胞EMT相关蛋白水平的影响Fig. 4 Effect of Runx2 siRNA on EMT-related protein expression induced by TGF-β1 in A549 cells
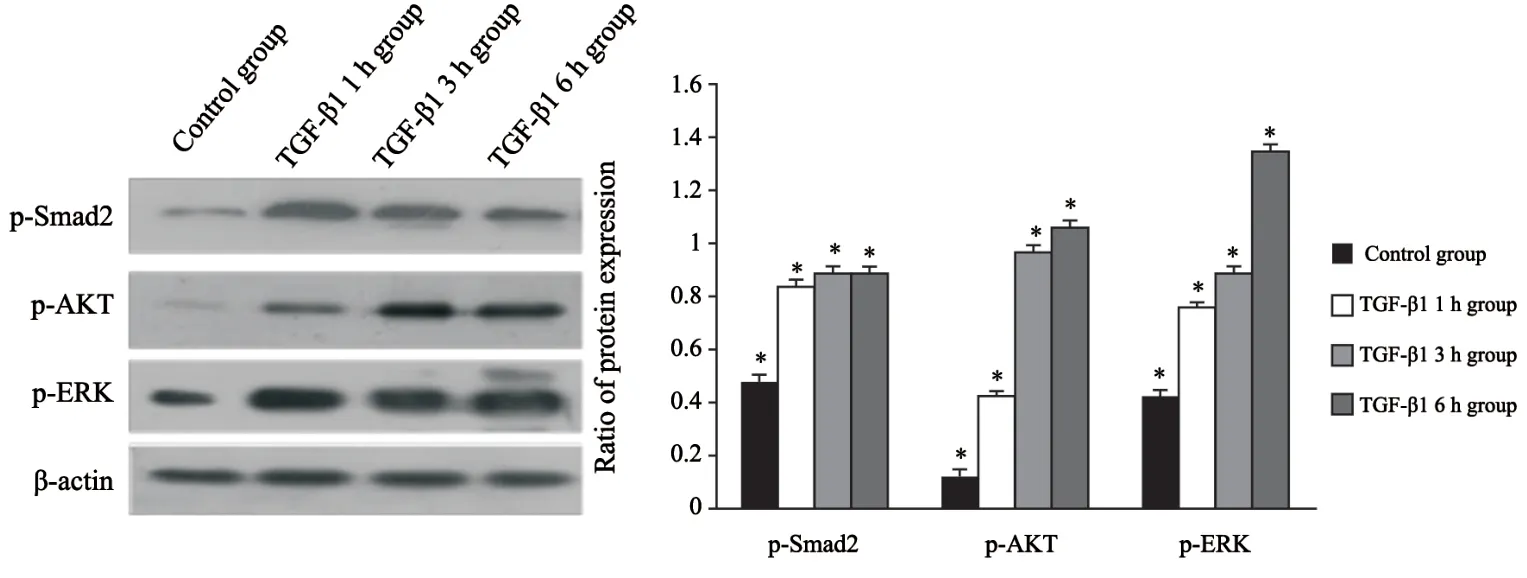
图 5 5 ng/mL of TGF-β1作用A549细胞1 h后激活Smad2通路、PI3K/AKT和MAPK/ERK通路Fig. 5 Smad2 pathway and the PI3K/AKT and MAPK/ERK pathways were activated in TGF-β1 induced EMT process within 1 h in A549 cells
2.4 TGF-β1主要通过PI3K/AKT通路调节Runx2表达影响A549细胞发生EMT
分别利用特异性通路阻断剂LY294002(PI3K/AKT通路抑制剂)、PD98059(MAPK/ERK通路抑制剂)阻断TGF-β旁路。结果显示,PI3K/AKT通路被阻断后,Runx2表达明显下调,差异有统计学意义(P<0.05),肿瘤细胞未发生EMT形态变化;而MAPK/ERK通路阻断后,Runx2表达未发生明显变化(P>0.05),而肿瘤细胞依然发生EMT形态变化(图6)。说明Runx2在TGF-β1诱导的A549细胞EMT过程中,主要是受到PI3K/AKT的调节。
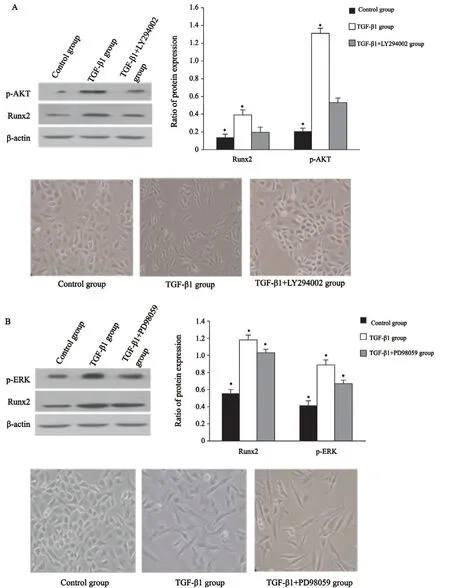
图 6 阻断PI3K/AKT(A)和MAPK/ERK通路(B)对Runx2表达及A549细胞EMT形态变化的影响Fig. 6 Effects of blocking PI3K/AKT (A) and MAPK/ERK (B) pathways on the expression of Runx2 and EMT process in A549 cells
3 讨 论
TGF-β可以自分泌和旁分泌的形式作用于肿瘤细胞,诱导肿瘤细胞发生EMT。目前,绝大多数关于EMT的研究都是基于TGF-β诱导模型[7]。Smads家族蛋白在将TGF-β信号从细胞表面受体转导至细胞核的过程中起到关键性作用,且不同的Smad介导不同的TGF-β家族成员的信号转导[8-9]。TGF-β作为配体形成的受体复合物,激活Smads进入核内,共同激活或抑制其调节的靶基因的转录。Smads是很多EMT相关基因的转录激活因子,与多种活化/抑制因子组成“共调节复合体”调节靶基因的转录[10-11],PEBP2/CBF家族蛋白即为其中重要一员。其中与肿瘤细胞EMT相关性最大的是Runx2[12]。Runx2介导肿瘤细胞对于TGF-β1/BMP等生长因子的反应性,沉默Runx2表达则会降低细胞对TGF-β的反应性[13]。虽然TGF-β家族激活的特异性R-Smad(Smad2/3、Smad1/5/8)能与许多转录因子发挥作用,但Runx家族蛋白是TGF-β超家族的特异性靶点之一,与TGF-β超家族信号通路的联系更为直接[14]。除此之外,Runx2的转录活性还受到其他细胞外信号通路的调控,研究发现,碱性成纤维细胞生长因子激活的ERK-MAPK通过磷酸化Runx2蛋白增强Runx2的转录活性,使细胞内的Runx2蛋白增多,从而进一步增强Runx2的转录活性[15]。
本实验利用TGF-β1诱导肺癌A549细胞,使用5 ng/mL TGF-β1诱导72 h之后,A549细胞发生明显的形态学改变,细胞形态变成长梭形,细胞变得离散,细胞间黏附消失。同时细胞上皮蛋白E-cadherin表达下调,间质蛋白vimentin、fibronectin表达明显上升,证明细胞发生了EMT过程,同时与TGF-β通路密切相关的蛋白Runx2表达也发生上调。所以,在已经构建了稳定的细胞EMT模型基础上,我们继续研究Runx2在肿瘤细胞EMT过程中的关键作用。实验结果显示,经Runx2-siRNA干扰沉默Runx2之后的细胞接受TGF-β1刺激之后,与对照组相比,细胞形态和细胞间质指标都未发生明显变化,说明沉默Runx2表达可以阻止细胞发生EMT,Runx2在细胞EMT过程中发挥着重要作用,与肿瘤的侵袭转移密切相关。本研究进一步探讨了Runx2在TGF-β1诱导的EMT过程中的机制,结果发现,在细胞接受TGF-β1刺激之后,TGF-β-Smad通路及旁路PI3K/AKT和MAPK/ERK通路都受到激活。利用特异性通路抑制剂抑制旁路PI3K/AKT通路之后,Runx2表达受到下调,而且同时肿瘤细胞也未发生EMT形态变化。而阻断MAPK/ERK通路后,Runx2表达并未受到影响,而且肿瘤细胞EMT过程也未受到阻断,表明在TGF-β旁路中,主要是通过PI3K/AKT通路调控Runx2表达进而影响肿瘤细胞EMT过程。但是,Runx2在TGF-β1诱导的EMT过程中的具体作用机制还有待进一步研究和探讨。
综上所述,Runx2在TGF-β1诱导的肿瘤细胞EMT过程中发挥着重要的作用,干扰Runx2的表达可以阻止细胞发生EMT,因此,Runx2有可能作为肿瘤治疗靶点用于抑制肿瘤早期转移。
