上海地区临床实验室HCV RNA检测正确度验证结果分析 *
2019-10-16蒋玲丽杨依绡黄中强王雪亮肖艳群
蒋玲丽,杨依绡,黄中强,王雪亮,鲍 芸,肖艳群
(上海市临床检验中心,上海 200126)
丙型肝炎病毒(hepatitis C virus,HCV)引起的HCV是最常见的传染性肝病之一,治疗前的HCV核糖核酸(ribonucleic acid,RNA)载量检测对治疗诊断起着重要作用[1]。根据上海市临床检验中心(以下简称“中心”)近几年HCV RNA室间质量评价(external quality assessment,EQA)反馈数据统计的结果,发现各实验室检测结果和各试剂组检测值之间存在一定的差异。为使不同实验室间测定结果具有可比性,可通过相应的参考方法或标准物质进行量值溯源[2],因此2015年中心制备了HCV RNA国家二级标准物质[编号:GBW(E)090628][3]。2018年中心利用制备的二级标准物质在上海地区开展了HCV RNA正确度验证计划,用以评价上海地区临床实验室HCV RNA检测结果的正确度。
1 材料和方法
1.1 参控实验室 上海地区开展HCV RNA检测实验室。
1.2 仪器与试剂 瑞士罗氏公司生产的Roche COBAS AmpliPrep/COBAS TaqMan 48检测系统及其配套试剂,方法为内标定量法。美国ABI公司生产的ABI7500全自动扩增仪检测系统,试剂由上海科华生物工程股份有限公司生产,方法为柱提法。
1.3 方法
1.3.1 正确度调查样本收集自上海交通大学医学院附属仁济医院检验科HCV RNA检测后的剩余血清样本。混合均匀(剔除溶血和脂血样本),去除沉淀后700 μl/支分装,制备成低浓度(约104IU/ml)和高浓度(105IU/ml)2个样本,编号为HCV RNA 1号和HCV RNA 2号。
1.3.2 调查样本评估按照中国合格评定国家认可委员会(China national accreditation service for conformity assessment,CNAS)GL03《能力验证计划样品均匀性和稳定性评价指南》要求评估调查样本的均一性和稳定性。每个浓度抽取10支样本,每支检测2次,评估样本均匀性;抽取6套样本在2~8℃放置3天后检测,评估样本稳定性。
1.3.3 正确度计划实施将3套共6支样本通过冷链系统运输到各临床实验室。要求临床实验室收到样本后立即将其存放在-20℃以下冰箱中。实验室将样本分3批次检测(注:3批次为不同检测日期),每批次分别取1套样本,平衡至室温后混匀,瞬时离心后检测。要求实验室每支样本重复测定3次(共18个测试数据),在2周内将所有检测结果上传至中心数据库,超过规定时间系统不再接收数据。检测后剩余样本按照生物安全要求进行处理。
1.3.4 定值[3-4]采用Roche COBAS AmpliPrep/COBAS TaqMan 48检测系统,将正确度验证样本溯源至HCV RNA国家二级标准物质[GBW(E)090628]。将国家二级标准物质稀释成7个浓度,每个浓度重复检测3次,求回归方程。要求二级标物每次定值实验检测均值在靶值±不确定度范围内为数据有效。正确度调查样本每个浓度重复检测10次,计算均值代入回归方程求出正确度验证样本的含量。分3个批次定值,计算3次定值均值作为最终定值结果。
1.3.5 结果分析使用上海市临床检验中心的室间质评管理平台进行数据的统计处理,以每个样本的对数值为统计值,计算按不同试剂分组后各试剂组的变异系数(coefficients of variation,CV)、偏移及所有回报结果的单个临床实验室室内CV,偏移。根据卫生部临床检验中心室间质量评价靶值±0.4 logIU/ml的评价标准对实验室检测结果进行评价。
1.4 统计学分析 所有数据采用log值转换后进行统计。均匀性评估采用方差齐性检验,稳定性评估采用t检验。
2 结果
2.1 均匀性和稳定性评估 计算低高2个浓度样本均匀性检测结果,作方差齐性检验,F分别为2.253 9和1.117 8,F0.05(9,10)=3.02,F
2.2 赋值结果 以国家二级标准物质[GBW(E)090628]为溯源进行赋值,分3批进行。每批分析过程中二级标物均重复检测3次,取3次赋值的均值作为正确度样本赋值结果,分别为3.02×104和3.39×105IU/ml。
2.3 正确度调查分析
2.3.1 不同试剂组组内CV及偏移分析:见表1。2个样本不同试剂组组内CV分别为0.78%~8.53%和0.94%~6.21%,检测结果与靶值的偏移分别为-4.69%~13.17%和-3.44%~6.51%,不同试剂组间检测均值最大差值分别为0.65和0.55logIU/ml。
表1不同试剂组检测均值、组内CV和偏移

试剂组1号样本均值(logIU/ml)CV(%)偏移(%) 2号样本均值(logIU/ml)CV(%)偏移(%)1234564.584.274.924.825.074.423.838.531.911.370.782.102.20-4.699.827.5913.17-1.31 5.535.575.895.695.795.343.536.211.271.111.980.94-0.010.726.512.894.70-3.44
2.3.2 单个实验室室内CV及偏移分析:回报结果的16家实验室中2个样本单个实验室室内CV分别为0.47%~8.53%和0.58%~6.21%;检测均值与靶值的偏移分别为-0.89%~13.17%和-4.88%~6.51%。不同实验室间检测均值最大差值分别为0.80和0.63 logIU/ml,详见图1,图2。实验室符合率结果见表2。

表2 实验室符合率
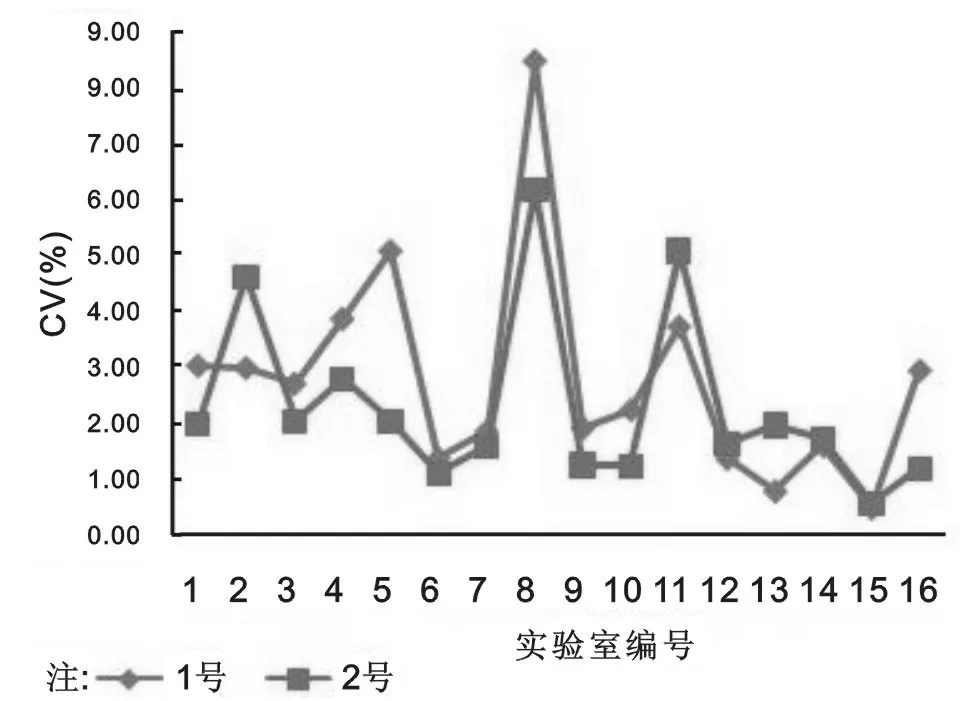
图1 实验室室内CV

图2 实验室偏移
3 讨论
EQA是评价临床实验室检测质量、促进实验室提高检测结果可靠性与准确性的有效手段,但EQA得到的偏移是单次检测结果与公议值的差值,中心组织的HCV RNA室间质量评价也一直采用试剂组组内公议值进行评价,其结果只能用于评价组内不同实验室间结果的一致性。不同组别之间的结果缺乏可比性,得出具有互换性和准确性的患者检验结果是临床实验室的重要目标[5]。正确度验证计划是EQA的一种特殊方式,是评价实验室多次重复检测结果的平均值与参考量值间的一致程度[6],“正确度”只能通过“溯源”来确定,所得偏移较室间质评更可靠和准确。
本研究分析了上海地区临床实验室2018年HCV RNA正确度验证结果。根据CNAS-CL02-A009《医学实验室质量和能力认可准则在分子诊断领域的应用说明》中不精密度要求,以0.4 logIU/ml为允许总误差,中间精密度<4/5Tea计算,2个样本的CV应分别小于7.14%和5.79%,上报结果中实验室8的CV超过了允许要求,但该实验室2个样本的检测均值均在允许范围内,提示实验室检测结果虽符合要求但检测重复性不佳,存在随机误差,建议实验室应加强人员培训,同时建议实验室应重新进行HCV RNA项目检测系统的精密度验证。另外,结果显示实验室9和实验室13的低浓度样本偏移超过了允许范围,但两个实验室该浓度样本的CV分别为1.91%和0.78%,提示两家实验室检测重复性较好,表明实验室存在系统误差。建议实验室可采取以下措施:①统计实验室长期室内质控数据,观察近期是否存在系统偏倚趋势;②上海地区室内质控数据要求进行实验室间比对,可通过室内数据室间比对检查实验室检测数据是否存在偏倚;③检查实验室检测设备是否满足要求;④从试剂校准品入手查找问题,积极联系试剂厂家分析校准品溯源的正确性。调查数据还显示2个样本试剂组间最大差值分别为0.65 logIU/ml和0.55 logIU/ml,实验室间最大差值分别为0.80 logIU/ml和0.63 logIU/ml,表明各试剂组和各实验室间检测结果还是存在一定差异,可能由于国内HCV RNA检测主要采用国产试剂,试剂品牌较多,各试剂校准品溯源方式不同,并且核酸提取以手工为主,整个检测过程影响因素较多。
综上所述,上海地区大部分实验室检测重复性较好,正确度符合要求,但各试剂组和各实验室之间结果存在差异。建议各试剂厂商统一试剂校准品的溯源方式和溯源链,并且积极推进全自动核酸提取系统,使各实验室之间的HCV RNA检测结果更具可比性。
