人血小板裂解液在人牙髓间充质细胞体外增殖与分化中的应用
2019-10-15谢贤哲何家林王腾飞霍冬梅
谢贤哲,徐 燕,何家林,王腾飞,霍冬梅
牙周炎是导致牙槽骨缺损的重要因素之一。以人牙髓间充质细胞(human dental pulp stroma cells,hDPSCs)等自体来源种子细胞为基础的组织工程技术得到越来越多学者与临床医师的关注。绝大多数细胞体外培养使用胎牛血清(fetal bovine serum,FBS)作为添加物。但由于FBS存在人畜共患病、免疫排斥等潜在风险,种子细胞体外扩增后的临床应用受到了极大的限制[1]。血小板裂解液(human platelet lysate,HPL)作为可能的FBS替代物受到广泛的关注[2-3]。很多学者尝试使用HPL对细胞进行体外扩增,但对于最适使用浓度的观点仍未统一[4]。
1 材料与方法
1.1 仪器与试剂杜氏改良Eagle培养基(Dulbecco′s modified eagle medium,DMEM,美国hylcone公司);FBS(美国Gibco公司);JJT-900超净台、细胞培养箱(美国Thermo公司);Elx808U酶标仪;Countstar细胞计数仪(上海睿钰生物科技有限公司);荧光倒置显微镜(DMI3000B,德国Leica公司);茜素红S法染色试剂盒、CCK-8试剂盒(北京Solarbio公司);TRIzol(美国Introvigen公司);实时荧光定量聚合酶链反应(Real time quantitive-polymerase chain reaction,RT-PCR)试剂盒(日本TaKaRa公司)。
1.2 HPL的制备与样本收集筛选志愿者,年龄25~28周岁,身体健康,采血前均行血常规检测血小板含量正常[(100~300)×109/L]。每位志愿者于肘静脉处采血20 ml,置于5 ml无抗凝剂玻璃管中,立刻放入Intra-spin离心机中2 700 r/min离心12 min,可见分3层,中间层为富血小板纤维蛋白(platelet-rich fibrin,PRF)。无菌条件下弃去底层红细胞后经3 000 r/min离心10 min将血小板与胶原蛋白网分离,上清液于-80 ℃与37 ℃下反复冻融3次后过0.22 μm滤筛,得到HPL。为避免个体间差异对实验结果造成影响,将多人份HPL混合后使用。
收集安徽省口腔医院口腔颌面外科2017年12月~2018年4月所拔除健康阻生第三磨牙共60颗,所有供体无系统性疾病,年龄18~40周岁。
1.3 细胞培养与检测
1.3.1细胞分离与培养 样本收集后立刻送往实验室,无菌条件下将牙髓轻柔取出,剪成1 mm×1 mm×0.5 mm大小移入6孔细胞培养板中,使用改良组织块法于37 ℃、5% CO2条件下在培养箱中分别使用含5%、10%、20% HPL以及10% FBS的DMEM进行原代细胞培养,每组15颗牙齿。
1.3.2细胞形态学观察 倒置显微镜及扫描电镜观察并记录原代细胞形态与生长状况,计算细胞成活率。
1.3.3流式细胞术检测细胞表面抗原表达 取7个流式管,选取第2代生长状态良好的细胞,调节每管细胞数为1×106个。分别加入CD34、D45、CD44、CD90、CD105、Stro-1单克隆抗体, 另设置一空白对照管。4 ℃避光孵育30 min,1 000 r/min离心5 min去上清液,重悬,上流式细胞仪进行检测。
1.3.4细胞活性检测 胰酶消化细胞制备单细胞悬液,并稀释至1×106/ml,取适量细胞悬液与0.4%台盼蓝溶液以9 ∶1混合均匀,3 min内用计数板分别计数活细胞与死细胞。
1.3.5细胞增殖检测 取对数生长期的P3代细胞,以1×104/ml接种于96孔板,预培养24 h,分别在第1、2、3、4、5、6、7天加入CCK-8溶液,孵育1~4 h后,用酶标仪测定在450 nm处吸光度值。
1.3.6细胞体外成骨诱导和检测 选择分别加入10% HPL和10% FBS的两组培养基为实验组与对照组。选取生长良好的P3代细胞,制备成5×104/ml细胞悬液,接种于6孔板中培养12 h,待细胞贴壁后进行成骨诱导,分别在0、7、14、21 d使用茜素红染色并进行观察。
选取10% HPL和10% FBS的两组生长状态良好的P3代细胞以1×105/ml接种于6孔板。分别于成骨诱导的0、7、14、21 d吸去培养液,PBS 冲洗2遍后,立即加入1 ml TRIzol裂解细胞提取总RNA。定量后,以Prime-ScriptTMRT Master Mix反转录试剂盒反转录合成cDNA,以cDNA为模板,β-actin为内参,使用7500Real Time PCR System进行荧光实时定量PCR,分别检测碱性磷酸酶(alkaline phosphatase,ALP)及骨形态发生蛋白-2(bone morphogenetic protein-2,BMP2)的mRNA表达水平。操作步骤严格按照产品说明书进行,所用引物均由上海生工生物有限公司设计并合成,各引物序列见表1。

表1 RT-PCR引物及其序列
1.4 统计学处理采用SPSS 22.0软件进行数据分析,多组间比较采用方差分析(ANOVA),两组之间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察培养7~12 d后,各组均有细胞从组织块边缘爬出,细胞形态规则呈长梭形,呈旋涡状排列,胞膜完整。使用HPL培养的细胞立体感更强,期间夹杂少量多角形细胞(图1、2)。
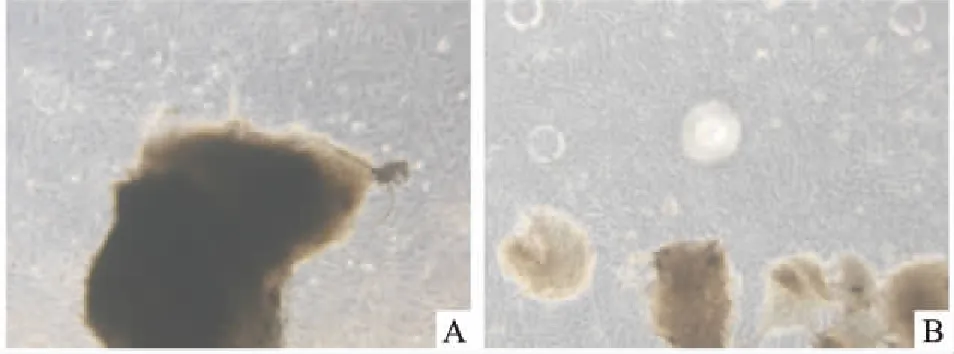
图1 原代培养的牙髓间充质细胞 ×80A:10% FBS组;B:10% HPL组

图2 扫描电镜下细胞形态 ×2 000
2.2 细胞成活率各组均有细胞爬出,20% HPL组细胞成活率最高(73.3±4.7)%,5% HPL组最低(26.7±4.7)%,除10% HPL与20% HPL组间差异无统计学意义外(F=0.82,P=0.485 1),各组之间差异均有统计学意义(F=11.16,P=0.046 4),见表2。
2.3 流式细胞仪检测结果流式细胞仪检测细胞特定抗原表达结果显示,所培养细胞阳性表达CD44(94.2%)、CD90(93.7%)、CD105(91.6%)、Stro-1(94.8%);阴性表达CD34(0.9%)、CD45(0.2%),见图3。
2.4 细胞活性检测结果台盼蓝染色结果显示:10% HPL组细胞活性最高(88.424±1.866)%,5% HPL组细胞活性最低(68.583±3.519)%,各组间差异均有统计学意义(F=32.43,P=0.028 1)。见表2。
2.5 细胞增殖检测结果各组细胞生长曲线均呈S型(图4),10% FBS组在第3天开始快速增殖,第5天时生长速度放缓,5%、10%及20% HPL组细胞均于第2天即开始快速增长,但第4天时生长速度逐渐降低,20% HPL组第5天达到平台期。各组间差异均有统计学意义(F总=5.25,P<0.001;F1d=18.56,P=0.018 7;F2d=7.04,P=0.114 6;F3d=65.52,P=0.006 3;F4d=356.60,P=0.001 5;F5d=138.80,P=0.001 0;F6d=108.40,P=0.005 6;F7d=77.51,P=0.001 3)。
2.6 成骨诱导后茜素红染色实验组(10% HPL)和对照组(10% FBS)经过连续4周的体外成骨诱导后,茜素红染色可见实验组与对照组均形成明显的红色矿化结节,见图5、6。
2.7 成骨诱导后ALP、BMP-2的mRNA表达水平两组细胞的成骨相关基因ALP、BMP-2随着成骨诱导时间延长,其mRNA表达量均增加。在各个时间点,实验组(10% HPL)的成骨相关基因ALP、BMP-2的mRNA相对表达量均高于对照组(10% FBS),差异有统计学意义(ALP:t7d=4.85,P<0.001;t14d=5.35,P<0.001;t21d=6.12,P<0.001; BMP-2:t7d=4.61,P<0.001;t14d=5.60,P<0.001;t21d=3.57,P<0.001)。见图7。

表2 各组细胞细胞成活率、活率

图3 流式细胞仪检测结果A:CD90;B:CD34;C:CD44;D:CD45;E:CD105;F:Stro-1

图4 牙髓间充质细胞增殖能力
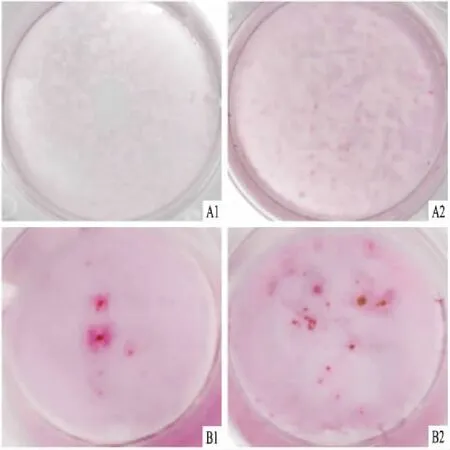
图5 茜素红染色照片 ×2A:10% FBS组成骨诱导;B:10% HPL组成骨诱导;1:7 d;2:21 d

图6 茜素红染色镜下照片 ×80A:10% FBS组成骨诱导;B:10% HPL组成骨诱导;1:7 d;2:21 d

图7 成骨基因ALP、BMP-2 mRNA相对表达量A:ALP;B:BMP-2;与10% FBS组比较:*P<0.05
3 讨论
本研究结果显示,健康牙髓组织在5%、10%以及20% HPL的培养体系下均有成活。其中5% HPL组成活率为各组最低,原因可能是组织块法培养原代细胞时,对生长因子浓度要求较高[5],5% HPL不足以支持所有牙髓组织块的成活,以致5% HPL组细胞成活率较低,随着HPL浓度的提高,细胞成活率升高;20% HPL组成活率与10% HPL组成活率相当,且均高于10% FBS组成活率。
通过流式细胞仪对细胞特异性表面抗原表达检测结果显示,所培养细胞阳性表达CD44(94.2%)、CD90(93.7%)、CD105(91.6%)、Stro-1(94.8%);阴性表达CD34(0.9%)、CD45(0.2%),符合间充质来源干细胞表面抗原表达的特征,但由于本研究仅就细胞的成骨分化做了相关研究,而对成脂以及成软骨方面并未加以验证,故所培养细胞是否完全具有牙髓间充质干细胞的特性仍需在后续实验中加以探究。
通过CCK-8对各组细胞培养不同时间节点增殖情况的分析显示,5%、10%及20% HPL组细胞均于第2天即开始快速增长,这表明HPL中的生长因子在促进细胞贴壁方面相较于FBS更有优势[6]。第4天时各HPL组生长速度逐渐降低,第5天时,20% HPL组首先到达平台期,这可能与高浓度生长因子对细胞生长产生的抑制作用有关,这也与Chen et al[7]的相关研究结果一致。
Q-PCR结果显示在各个时间节点,实验组(10% HPL)的成骨相关基因ALP、BMP-2的mRNA相对表达量均高于对照组(10% FBS),差异有统计学意义(P<0.05)。有研究[8]显示在使用5% HPL培养hDPSCs时,短时间内(15 d)可明显观察到ALP活性的增强,在此浓度下ALP活性最高;另有学者认为10% HPL在成骨诱导较长时间(15 d之后),促进hDPSCs成骨分化能力最强[7]。本研究使用Q-PCR与茜素红染色所得到的结果也证明了10% HPL相对于10% FBS在成骨能力方面的优势。
血小板在伤口愈合和组织修复中的基本生理作用构成了人血小板衍生物在再生医学中使用的基础[9]。用于诱导血小板中生长因子和其他生物活性分子释放的方法可分为四大类:① 冷冻/解冻:血小板富集物在-80 ℃与37 ℃下反复冻融,循环次数1~5次不等,研究[10]表明冻融循环3次对于生长因子的释放是一个较为稳定的循环次数;② 直接血小板激活:通过加入钙盐溶液诱导内源性凝血酶生成,或者直接加入人凝血酶或重组凝血酶使血小板脱粒,以释放血小板α颗粒内的生长因子,但此种方法使用的外来物质可能会使HPL在细胞疗法使用中的监管批准复杂化;③ 超声:学者发现在20 kHz的频率下超声处理30 min对于血小板α颗粒的裂解是有效的;④ 化学处理:在大多数制取HPL方式中,都需要对血小板富集物进行离心以除去细胞碎片和纤维蛋白凝块,若不去除则需在溶液中加入肝素等化学溶剂来作为抗凝剂,但有研究[11]显示较高的肝素浓度会对细胞增殖造成负面影响。国外学者使用反复冻融、超声裂解、凝血酶或钙离子激活对PRF进行处理,并检测其中各种生长因子的含量。结果显示反复冻融组各类生长因子的释放明显高于直接激活组,与超声裂解组相当;而对于储存时间超过6个月血小板富集物的处理,超声组中血小板衍生因子(platelet derived growth factor,PDGF)的释放占优势[12-13]。综合各种HPL制取方式的特点,本研究采用-80 ℃/37 ℃下反复冻融3次的方式获得HPL,并将多人份HPL混合使用以减少个体与批次间差异。
在HPL中各种生长因子对于细胞增殖与分化的作用机制方面,有研究[13]显示PDGF是一种间充质来源的促细胞有丝分裂蛋白,在所有创伤的愈合过程中起着关键作用,可提高包括成纤维细胞、血管平滑肌等细胞在内的中胚层来源细胞的增殖活性;转化生长因子-β(transforming growth factor-β,TGF-β)为一种调控细胞增殖与分化的蛋白,是体内多能性的基础抗炎因子,参与诸多组织的修复进程及炎症反应,并具有促成纤维细胞增殖及胞外基质形成、I型胶原和纤维蛋白生物合成、阻止破骨细胞形成和骨吸收发生的功能;胰岛素样生长因子(insulin like growth factor,IGF)是一种高度类似于胰岛素的多肽,作为最早被发现的可作用于软骨的生长因子之一,是软骨基质合成中的主要刺激因子,其机制主要体现在刺激成骨细胞增殖与分化,促进软骨及骨基质生成,其两种亚类IGF-Ⅰ和IGF-Ⅱ均具有显著促进多种来源软骨细胞分裂增殖及软骨基质合成的效应;血管内皮生长因子(vascular endothelial growth factor,VEGF)作为血管再生进程中必不可少的诱导因子,在胚胎发育时期和组织损伤时起到促进血管新生的作用,并可在血管阻塞造成组织局部血供不足时形成侧枝循环,部分恢复血氧供应;成纤维细胞生长因子(fibroblast growth factor,FGF)有aFGF与bFGF两种形式,其参与调控胚胎发育、创伤愈合及血管形成等过程,被认为是效应最显著的软骨细胞分裂及形态发生刺激原之一,对软骨细胞在内的中胚层来源细胞具有明显的促分裂作用[11,14]。
虽然HPL作为动物血清的替代物已经用于间充质细胞的体外培养[10],但对于HPL的标准制取以及最适使用浓度的观点仍未统一[15]。本研究证明了适宜浓度HPL在hDPSCs体外培养及成骨分化中的优势,为HPL代替FBS提供了依据。在后期研究中,课题组将深入探讨HPL培养下hDPSCs在动物及临床牙槽骨缺损模型中的有效性及调控机制,以期为重度牙周炎的治疗提供更多的方法。
