类胰岛素生长因子(IGFs)在斜带石斑鱼胚胎及卵巢的表达
2019-10-14杨慧荣王庆李水生赵会宏何思美薛华艺吴沅沅杨炎张勇
杨慧荣, 王庆, 李水生, 赵会宏, 何思美, 薛华艺, 吴沅沅 , 杨炎 , 张勇
(1. 华南农业大学海洋学院, 广东 广州 510642;2. 中山大学水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室,广东 广州 510275)
IGFs具有促进细胞分裂、生长的功能,GH的大部分生理功能都是由其介导。大量的研究表明IGFs定位于鱼类的性腺,其它研究也表明IGF-1参与了性腺的功能,如:类固醇激素生成,滤泡生长和最终的卵巢成熟。最近的研究也暗示了IGF家族参与了鱼类的胚胎发育,性别决定和性腺分化[1-5]。但是,IGF系统在鱼类胚胎和性腺及其发育进程中的功能还很不清晰,生长轴是否在鱼类的胚胎及性腺发挥功能还没有得到充分证实,是否IGF系统在性腺会对促性腺激素的刺激做出应答还是未知。
IGF-1和IGF-2作为主要的促生长因子,主要来源是肝脏,肝脏产生的IGFs主要通过内分泌方式运送到鱼体其它组织,但也可通过自分泌、旁分泌作用于自身或相邻的肝外组织细胞,促进其生长和分化。目前在硬骨鱼的脑、鳃、胃、肠、肾和胰腺等组织中都发现有IGF-1及IGF-2的表达。IGF-2被认为是重要的胚胎生长和发育的调节因子。在大量幼体和成体的硬骨鱼类,如鲤鱼(Cyprinuscarpio)[6]、虹鳟(Oncorhynchusmykiss)[7]、斑马鱼(Barchydaniorerio)[8]和海鲷(Sparusaurata)[9-10]等,在肝脏和大量的肝外组织中均检测到了IGF-2的分布,更有趣的是,在罗非鱼(Oreochromismossambicus)的脑组织中检测到丰富的IGF-2的表达[11]。鱼类IGFs的基本功能是促生长,研究也较为清楚。自IGF-1、IGF-2及最近报道的IGF-3基因在脊椎动物的卵巢被发现后[12-14],它们在卵巢的功能开始备受关注,对鱼类GH-IGFs轴的视角开始由生长转向生殖,大量的研究表明他们参与了鱼类的性腺发育和成熟进程,在鱼类生理调控过程中具有重要地位[2, 5]。但目前IGF-1在性腺的研究有较多报道,IGF-2却很少被提及,因此,不同鱼类性腺中IGF-2的作用是急需解决的一个重要问题。
鱼类特异的、由一种新基因编码的一种新型的IGF因子(命名为IGF-3)在罗非鱼[12, 15]和斑马鱼[16]中发现,对基因组和系统发育分析表明:IGF-3普遍存在于硬骨鱼类,而且仅出现在卵巢中的颗粒细胞和体细胞、精巢中的间质细胞,对于其功能的研究才刚刚起步[12, 15-17],所以我们有必要进一步研究IGF-3和它潜在的生物学功能。
斜带石斑鱼(Epinepheluscoioides)属于鲈形目(Perciformes),鮨科(Serranidae),石斑鱼亚科(Epinephelinae),石斑鱼属(Epinephelus),为暖水性礁栖大型鱼类,广泛分布于印度洋和太平洋的热带、亚热带海域。石斑鱼名贵的重要海水养殖品种,也是我国华南沿海地区以及东南亚地区重要的经济鱼类。本研究从斜带石斑鱼的卵巢中克隆得到IGF-3全长序列,从GeneBank下载得到斜带石斑鱼的IGF-1(41353204)和IGF-2(45357121)的全长cDNA序列,研究三者的蛋白结构和相似性及在胚胎发育及人工性逆转过程中的表达。通过时空表达分析,初步推测IGF-1、IGF-2和IGF-3在其胚胎发育及性逆转过程中的生理功能。
1 材料与方法
1.1 材料
斜带石斑鱼采自广东省大亚湾水产试验中心,实验鱼体采用室内循环水养殖系统养殖。取样时,实验用鱼先用MS-222麻醉,然后迅速分离各组织至1.5 mL离心管中,液氮速冻处理,存放于-80 ℃超低温冰箱备用。取样所用的解剖器械和玻璃器皿均在180 ℃烘烤3 h以上,枪头及离心管等用DEPC(1 mL/L)水溶液处理12 h后高温高压灭菌2次(20 min/次)。所有实验动物操作均在华南农业大学实验动物伦理委员会的相关指导下进行。
胚胎发育所需要的样本于2011年4月取自广东省大亚湾水产试验中心。在斜带石斑鱼繁殖季节,守在亲鱼池旁观察。在亲鱼追尾之后,立即在收卵槽收集受精卵。然后在生物投影仪下观察,分别收集不同发育时期的胚胎。各个时期收集100个胚胎到1.5 mL离心管中(每个时期平行取3管),投入液氮速冻,然后转至-80 ℃保存备用。
人工诱导性逆转的斜带石斑鱼购广东省大亚湾水产试验中心,体质量1.3~2.2 kg,体长为37.5~52.5 cm。饲养水温为 24.5~29.2 ℃。取样前将石斑鱼置于冰上低温麻醉,快速断头,取少量性腺放置波恩氏液中固定用于组织学鉴定,剩余的部分性腺保存至1.5 mL离心管中,液氮急速冷冻,转存至-80 ℃超低温冰箱保存备用。
1.2 方法
1.2.1 特异引物设计 利用Primer 5.0引物设计软件设计斜带石斑鱼IGF-1、IGF-2、IGF-3及18S基因引物,采用RT-PCR和实时荧光定量 PCR(quantitive real-time PCR)技术,筛选出扩增效果好的特异性引物,用于胚胎发育RT-PCR和埋植样品的Real-time PCR分析。筛选出的特异性引物如表1所示。
表1 斜带石斑鱼IGF-1、IGF-2、IGF-3及18S基因引物
Table 1 The optimized peimers of IGF-1、IGF-2、IGF-3 and 18S genes

基因Genes引物Primers序列(5'to 3')Sequences (5'to 3')IGF-1IGF-1 FCGAGAGCACCCAAGGTTAGTIGF-1 RTCCATTCGCACCTTCCCTAIGF-2IGF-2 FCGTGATGCCCGCACTAAAACIGF-2 RCAGCGGGCTCATTTGTGGTIGF-3IGF-3 FGTGTGTATGTTCTACTCCACIGF-3 RTCCTTCTGTAAGCTTCCCTC18S18S FCCTGAGAAACGGCTACCACATCC18S RAGCAACTTTAGTATACGCTATTGGAG
1.2.2 半定量PCR (semi-quantitative RT-PCR) 技术 采用RT-PCR方法检测斜带石斑鱼IGF-1、IGF-2、IGF-3及18S基因在胚胎发育过程中的表达变化。选取斜带石斑鱼未受精卵,受精卵,2细胞期,4细胞期,8细胞期,16细胞期,32细胞期,多细胞期,桑椹期,囊胚,原肠早期,胚体形成期,视囊形成期,肌节出现期,听囊形成期,脑泡形成期,心脏形成期,尾芽期,心脏跳动期和将孵期共20个时期的样品进行收集,提取总RNA反转录成第一链cDNA,然后利用IGF-1、IGF-2、IGF-3和18S基因的特异性引物进行PCR检测,取5μL的PCR产物进行w=1.5%琼脂糖凝胶电泳并拍照分析。采用Blend Taq-plus酶(TOYOBO,Japan)进行胚胎发育的的RT-PCR反应。反应条件为:94 ℃ 3 min;40个循环:94 ℃ 15 s,52 ℃ 15 s,72 ℃ 35 s;最后72 ℃ 10 min。
1.2.3 甲基睾酮(MT)埋植方法 ① MT埋植前用导管插入每条鱼的生殖孔摄取小部分性腺组织以确定其雌性性腺发育阶段; ② 用MS-222麻醉斜带石斑鱼后,快速测量并记录其体长、体质量,根据10 mg/kg体质量的MT浓度计算埋植所需的药条量,然后根据比例选取不同MT含量的胶条; ③ 用消毒的埋植刀在鱼腹部划开一个小口(注意划开腹腔膜而不伤及内脏),用消毒的镊子将含MT的药条植入鱼的腹腔(对照组则植入不含MT的药条),伤口不缝合,用红霉素眼膏涂抹;④ 手术后的实验鱼均经消毒液浸泡后放回鱼池饲养; ⑤ 取样安排:每周取对照组和实验组各6尾,取样前将实验鱼置于冰上低温麻醉后,快速断头取出性腺等组织并液氮速冻后转至-80 ℃保存备用,同时每尾鱼各取小部分性腺置于波恩氏液中固定,用于性腺发育的组织学鉴定。
1.2.4 实时荧光定量PCR技术
1) 荧光定量技术。
以18S作为内部参照基因,采用实时荧光定量PCR技术检测性腺发育及人工性逆转过程中IGF-1、IGF-2和IGF-3表达情况。
将斜带石斑鱼IGF-1、IGF-2、IGF-3和18S特异性引物克隆出来的特异基因片段,分别连接插入到载体中,构建质粒DNA标准样品,转化,提取质粒,再将质粒按照原液浓度的10-1到10-10倍进行逐级稀释,并进行PCR及电泳检验稀释效果。
参照SYBR®Green Real time PCR Master Mix(TOYOBO, Japan)试剂盒说明书准备反应体系。采用384孔板的反应模块。将反应体系准备好之后,将加好样本的384孔板,低速离心后,利用Roche Light Cycler 480 real time PCR system进行基因表达的检测。具体反应程序为:95 ℃预变性1 min; 95 ℃变性5 s,57 ℃退火10 s,72 ℃延伸20 s,84 ℃收集荧光1 s,共40个循环;溶解曲线:95 ℃ 1 min,60 ℃ 1 min,95 ℃ continue。
2)荧光定量数据分析。
根据实时荧光定量PCR的CT值和各基因的标准曲线,计算出斜带石斑鱼IGF-1、IGF-2、IGF-3和18S的浓度,然后每个样本的基因表达浓度与该样本18S的表达浓度相比,所得的比值就是目的基因在特定组织的相对表达量。所有数据以平均值±标准差(means±SEM)的形式表示。作图采用GraphPad Prism 5软件。使用SPSS 13.0(SPSS, Chicago,IL,USA)软件中的Duncan’s multiple range test进行显著性差异的统计学分析,各实验组的变化用one-way analysis of variance(ANOVA)的Duncan检验,当P<0.05时认为差异显著。
1.2.5 序列分析 IGF-1,IGF-2和IGF-3基因潜在的开放读码框在蛋白分析网页(www.expasy.org)提供的translate程序上预测,用BioEdit软件翻译成相应的氨基酸序列。信号肽的预测使用signalIP服务器(http://www.cbs.dtu.dk/services/SignalP/)。蛋白序列的多重比对使用Clustal W1.8软件。核苷酸和氨基酸序列同源性比对在NCBI(National Center for Biotechnology Information)(http://www.ncbi.nlm.nih.gov)上提供的BLAST程序中进行。
2 结果与分析
2.1 氨基酸的同源性比对
2.1.1 斜带石斑鱼IGF-1、IGF-2和IGF-3蛋白序列的同源性比对 将斜带石斑鱼的IGF-1、IGF-2和IGF-3的蛋白序列进行同源性比对,计算3者的同源性参数,得到IGF-1与IGF-2的同源性为30.23%,IGF-1与IGF-3的同源性为24.04%,IGF-2与IGF-3的同源性为22.83%,相差不大,处于较低的水平,进一步证实了IGF-3是有别于IGF-1和IGF-2的不同基因。同时有保守的7个半胱氨酸残基(如图1)。

图1 斜带石斑鱼IGF-1、IGF-2和IGF-3的氨基酸多重比对(双下划线表示信号肽,星号表示保守位点,灰色代表保守的7个半胱氨酸残基)Fig.1 Comparison of amino acid sequences of grouper IGF-1、IGF-2 and IGF-3 precursors (The signal peptides are double underlined.Asterisks indicate conserved sites. Grey highlights represent the 7 conserved cysteine residues)
2.1.2 斜带石斑鱼与其他鱼类IGF-1、IGF-2和IGF-3氨基酸序列的同源性比对 将斜带石斑鱼与GeneBank下载的其他鱼类的IGF-1、IGF-2和IGF-3氨基酸序列进行同源性比对,得到其相似度(表2)。结果表明,斜带石斑鱼IGF-1氨基酸序列与罗非鱼、虹鳟(Oncorhynchusmykiss)、青鱂(Oryziasdancena)、大西洋鲑(Salmosalar)和红鳍东方鲀(Takifugurubripes)的同源性达到80%以上,与斑马鱼(Daniorerio)、金鱼(Carassiusauratus)和鲶鱼(Ictaluruspunctatus)约为60%,与哺乳类的人(Homosapiens)为75.25%,与两栖类的非洲爪蟾(Xenopuslaevis)为55%,与哺乳类的家鼠(Musmusculus)、褐家鼠(Rattusnorvegicus)约40%。IGF-2氨基酸序列与点蓝子鱼(Siganusguttatus)和金头鲷(Sparusaurata)的同源性达到90%以上,与大西洋鲑、红鳍东方鲀、罗非鱼、虹鳟、青鱂为80%以上,与两栖类的非洲爪蟾为47%,与哺乳类的人、家鼠、褐家鼠约40%。斜带石斑鱼与双棘黄姑鱼(Protonibeadiacanthus)的同源性最高,达到了75.38%;与罗非鱼的其次,为56.28%,与斑马鱼的2种转录本的同源性较低,分别为34.31%和33%,相差无几。
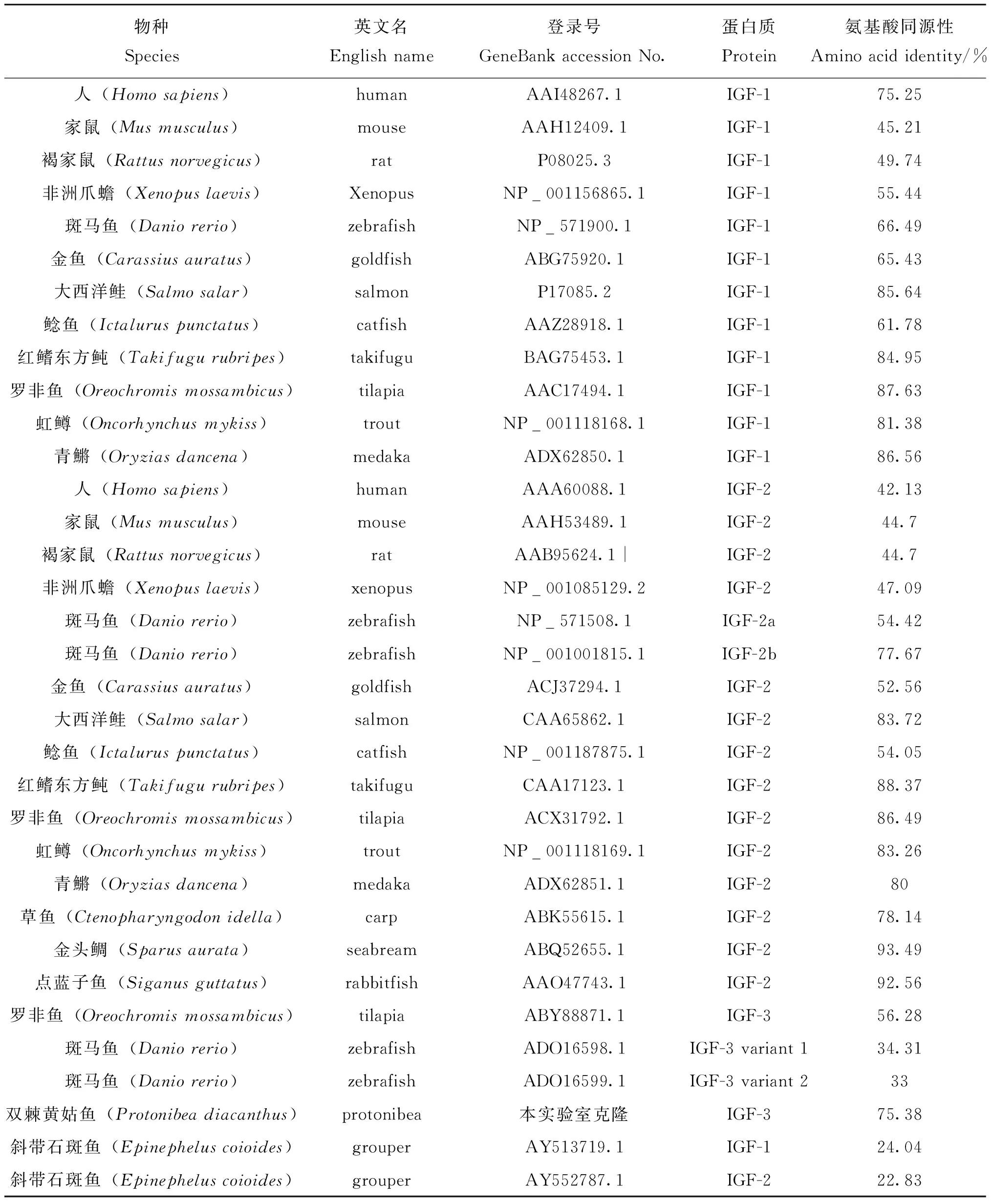
表2 斜带石斑鱼与其它脊椎动物IGF-1,IGF-2和IGF-3氨基酸序列同源性比较Table 2 The amino acid pairwise comparison of IGF-1, IGF-2 and IGF-3 sequences of E. coioides with the selected species
2.2 斜带石斑鱼IGF-1、IGF-2和IGF-3基因在胚胎发育过程中的表达
斜带石斑鱼受精卵在(25±0.5)℃、盐度31.0的海水中培育,历时28 h 30 min(已有50%的仔鱼孵出)完成整个胚胎发育过程,大体上可分为以下5个时期:卵裂期、囊胚期、原肠胚期、神经胚期和器官形成期,然后进入胚后发育阶段。
通过实时荧光定量PCR技术对斜带石斑鱼IGF-1、IGF-2和IGF-3基因在胚胎发育过程中的表达进行研究,研究结果显示:3基因多数的CP值都超过35,说明该基因在某些时期的mRNA水平很低,用Real-time PCR的方法没法检测得到。随后进行采用半定量RT-PCR技术研究3基因在胚胎发育过程中的表达,结果是:IGF-I mRNA在胚胎期发育过程中仅有微弱表达,几乎检测不到;IGF-2自桑椹期开始表达,在桑椹期后期呈现出持续的高水平表达态势,至出膜的初孵仔鱼;IGF-3自未受精卵开始,随着胚胎进程表达水平不断提高,但表达量不如IGF-2丰富(图2),预示着IGF-2和IGF-3,特别是IGF-2在胚胎发育期起重要作用。
2.3 斜带石斑鱼IGF-1、IGF-2和IGF-3基因在MT诱导性逆转过程中的表达
通过实时荧光定量PCR方法检测斜带石斑鱼IGF-1、IGF-2和IGF-3在性逆转过程中的表达情况。结果显示斜带石斑鱼IGF-1和IGF-3在性逆转过程中都显著性下降,其中IGF-3比IGF-1下降得更为明显,而IGF-2却没有明显变化(图3)。

图2 斜带石斑鱼IGF-1、IGF-2、IGF-3和18S基因在胚胎发育过程中的RT-PCR电泳图(A:未受精卵;B:受精卵;C:2细胞期;D:4细胞期;E:8细胞期;F:16细胞期;G:32细胞期;H:多细胞期;I:桑椹期;J:囊胚;K:原肠早期;L:胚体形成期;M:视囊形成期;N:肌节出现期;O:听囊形成期;P:脑泡形成期;Q:心脏形成期;R:尾芽期;S:心脏跳动期;T:将孵期;Nc:空白对照;M:相对分子质量标准DL2 000)Fig.2 Electrophoretic analysis of Semi-RT PCR for IGF-1, IGF-2, IGF-3 and 18S gene during embryonic development in E. coioides(A: egg; B: fertilized egg; C: 2-cell stage; D: 4-cell stage; E: 8-cell stage; F: 16-cell stage; G: 32-cell stage; H: multi-cell stage; I: morula; J: blastula; K: gastrula; L: embryo body stage; M: optic capsule stage; N: muscle burl stage; O: otocyst stage; P: brain vesicle stage; Q: heart stage; R: tail-bud stage; S: crystal stage; T: pre-hatching stage; Nc: negative control;M: Marker DL2 000)

图3 斜带石斑鱼在MT诱导性逆转过程中IGF-1(A)、IGF-2(B)和IGF-3(C)mRNA的表达变化(Week 2和week 4分别为为埋植2周和4周后的性腺。18S作为内参基因,数据均用平均值±标准差表示,不同字母(a和b)表示有显著性差异,当P<0.05时,认为差异显著(n=5或6)Fig.3 The mRNA expression patterns of IGF-1(A), IGF-2(B) and IGF-3(C) in ovary during MT-induced sex change in E. coioides(Week 2 and week 4 indicated the gonads after 2 and 4 weeks of MT implantation respectively. 18S is used as the reference gene. The data was shown as mean ± S.E. and the values with different letters (a and b) are significantly different with a probability level less than 0.05 (n=5 or 6)
3 讨 论
3.1 氨基酸的同源性比对
对IGF-1、IGF-2和IGF-3氨基酸序列进行同源性比对得到的相似度可以看出,IGF-2基因高度保守,IGF-1基因保守性略差,IGF-3基因保守性最差。另外,斜带石斑鱼的IGF-1、IGF-2和IGF-3均与硬骨鱼类的亲缘关系最近,其次是两栖类,最后是哺乳类,系统进化关系和氨基酸序列的同源性相一致,符合生物从低等到高等的进化历程。尽管斜带石斑鱼的3种IGFs序列在系统进化上存在差异,不同物种的IGF-3基因保守性很差,但与胰岛素相似,IGFs具有由半胱氨酸形成的二硫键,二硫键对胰岛素和IGFs的高级结构的维持及生物功能有着重要的作用。硬骨鱼类IGF-3刚发现不久,其结构特点以及E区的作用机制和生物学功能研究还需进一步研究。
3.2 斜带石斑鱼IGF-1、IGF-2和IGF-3基因在胚胎发育过程中的表达
胚胎发育是个体生长发育过程中十分重要的生理阶段,涉及到各种内外信号通路的调节。早期研究表明,IGF-2在哺乳动物胚胎的发育起着重要的生理功能,直至胎儿出生后IGF-2转录活性降低。IGF-2在调节家鼠胎儿生长方面发挥着重要作用,IGF-2的表达在时间上要先于IGF-1[18],在鱼类也有相似的表达模式,例如:在未受精的点蓝子鱼卵中检测到IGF-2 mRNA的表达,且在整个早期发育阶段,IGF-2 mRNA的表达量明显高于IGF-1[19],在金头鲷[9]胚胎期IGF-2 mRNA的表达量也明显高于IGF-1,但在鲤鱼[6]则出现相反情况。Chen等[20]研究显示,一种报告基因——增强型的绿色荧光蛋白(enhanced green fluorescent protein, eGFP),通过融合到罗非鱼IGF-2的启动子区域,在斑马鱼胚胎的32细胞期检测到其mRNA的表达,该表达在时间上优先于IGF-1启动子驱动的报告基因的表达,这些都证实了在鱼类IGF-2在时间上要先于IGF-1的表达,且表达量比IGF-1丰富。IGF-2可能通过局部自分泌和旁分泌的方式对于硬骨鱼类胚后发育发挥着重要作用。
采用RT-PCR技术研究IGF-1、IGF-2和IGF-3基因在胚胎发育过程中的表达,结果显示:IGF-I mRNA在胚胎期发育过程中仅有微弱表达,几乎检测不到;IGF-2自桑椹期开始表达,在桑椹期后期呈现持续高水平的表达态势,至出膜的初孵仔鱼,预示IGF-2对胚胎发育起着重要作用,与前人的研究结果相一致;IGF-3自未受精卵开始,随着胚胎发育进程表达水平不断提高,但表达量不如IGF-2丰富。Li等[16]在斑马鱼的研究结果表明,IGF-3基因通过可变剪接产生2种不同的转录剪接体,转录剪接体Ι特异表达于性腺,而转录剪接体ΙΙ仅仅只在早期发育过程中有表达,最近的一项研究也证实了IGF-3存在于斑马鱼胚胎[21]。目前非常有限的IGF-3的基因资源,很难判断本研究的IGF-3对应斑马鱼的哪种转录本,但上述研究暗示了IGF-3可能在胚胎发育进程中扮演某种角色,但其功能有待进一步研究。
3.3 斜带石斑鱼IGF-1、IGF-2和IGF-3基因在MT诱导性逆转过程中的表达
由雌到雄的性逆转是一个十分复杂的生理过程,受到上游的促性腺激素释放激素和促性腺激素,下游的性类固醇激素和其他神经内分泌因子的共同调控,导致卵巢的退化和精巢的发育[22-23]。利用性类固醇激素来诱导性逆转已经被广泛应用,同时也证实了性类固醇激素是性逆转过程中发挥关键作用的重要因子[24-25]。MT是重要的性逆转激素,通过腹腔埋植MT人工诱导,在4周内斜带石斑鱼就可发生由雌到雄的性转化,加快其自然的性逆转过程。
在斜带石斑鱼人工诱导性逆转过程中,3种IGF因子同样表现出了不同的表达模式,表明了斜带石斑鱼不同IGFs因子在雌性和雄性分别发挥着不同的生理功能。在鱼类,较多的视角集中在IGF-1对生殖的功能,它能促进卵母细胞的成熟[26-27]和精子发生[7, 28-29],调节类固醇的新陈代谢,产生或活化生殖相关激素[30]。在黑头软口鲦(Pimephalespromelas)中,卵巢中IGF-1,IGF-1R,GH和GHR的表达量比精巢高[31],在成熟的罗非鱼中,IGF-1在卵巢中的表达量远高于精巢[32]。而关于IGF-2在性腺的作用报道较少。
斜带石斑鱼的IGF1和IGF-3在其性逆转过程中的表达量都显著性降低,其中IGF-3比IGF-1下降得更为明显,而IGF-2却没有显著性变化。但有趣的是,Berishvili等[15]研究发现,IGF-3表达模式具有显著的性别差异,在精巢中的表达量要高于卵巢,而且精巢中的表达量在各个时期都比较稳定,但IGF-3的表达量在胚后发育表现出随着时间的推移而明显减低的趋势,与本研究相佐。有关IGF-2和IGF-3在精巢和卵巢的功能差异有待进一步阐明。
