桑花叶型萎缩病相关病毒的SYBR Green I实时荧光定量PCR检测方法
2019-10-10孙勋勋杨宏宇周轶楠刘吉平
孙勋勋,杨宏宇,周轶楠,刘吉平
(华南农业大学动物科学学院,广东 广州 510642)
【研究意义】双生病毒科(Geminiviridae)拥有400多种植物病毒,主要分布在热带和亚热带地区,能够侵染木瓜、棉花、豆类和蔬菜等经济作物,导致巨大的经济损失。Geminiviridae病毒为单链DNA病毒,有单组份和双组份两种,主要有菜豆金色花叶病毒属(Begomovirus)、玉米线条病毒属(Mastrevirus)、甜菜曲顶病毒属(Becurtovirus)、曲顶病毒属(Curtovirus)、番茄伪曲顶病毒属(Topocuvirus)、芜菁曲顶病毒属(Turncurtovirus)、画眉草线条病毒属(Eragrovirus)、冠状病毒属(Capulavirus)和葡萄藤红斑病毒属(Grablovirus)等9个属,主要通过烟粉虱、叶蝉、树虱和蚜虫等昆虫传播[1]。桑花叶型萎缩病相关病毒(Mulberry Mosaic Dwarf associated Virus,MMDaV)和橘褪绿矮缩相关病毒(Citrus Chlorotic Dwarf associated Virus,CCDaV)是两种木本双生病毒,具有独特的基因组结构,但因未明确其媒介昆虫和病毒粒子形态,所以将它们归为未定属[2]。桑花叶型萎缩病相关病毒(MMDaV)是在皱缩和花叶状的桑叶中发现,并未确定该病毒与桑花叶型萎缩病具有相关性[3]。桑花叶型萎缩病主要导致桑树植株矮化,叶片皱缩畸形并存在褪绿斑等症状,在我国各蚕区普遍发生且危害严重[4]。但是由于柯赫氏法则验证困难,至今还未能确定MMDaV与桑花叶型萎缩病之间的关系。【前人研究进展】对于双生病毒CCDaV,已有实时荧光定量PCR[5]和环介导等温核酸扩增技术(LAMP)[6]两种检测方法检测CCDaV,可对CCDaV进行快速定量和可视化的检测。而针对MMDaV,虽然已建立了PCR[7]以及核酸斑点杂交(nucleic acid spot hybridization,NASH)检测技术[8]检测MMDaV,但这些方法无法对MMDaV进行快速定量检测。【本研究切入点】与PCR 相比,实时荧光定量PCR具有特异性强、灵敏度高、可定量和快速等特点,在植物病害检测上具有广泛的应用[9]。本研究以MMDaV保守的外壳蛋白基因序列为引物设计靶点,构建有效的MMDaV实时荧光定量PCR检测方法,并以广东、广西、海南、重庆、陕西和江西采集的桑病叶样品为检测对象,验证MMDaV实时荧光定量PCR检测方法的有效性。【拟解决的关键问题】快速定量的检测桑树中的MMDaV,能进一步用于桑树、MMDaV和昆虫三者间互作关系的研究。
1 材料与方法
1.1 试验材料
带有皱缩和花叶状的桑病叶材料(图1)采集于广东、广西、海南、重庆、陕西和江西等地,样品信息见表1。桑叶污叶病病原真菌桑球针壳(Phyllactinia moricola)和桑叶常见真菌疣孢青霉(Penicillium verruculosum),桑椹菌核病病原真菌肉阜状杯盘菌(Ciboria carunculoides),桑树青枯病病原细菌茄科劳尔式菌(Ralstonia solanacearum),桑树青枯病病原细菌假单胞菌(Pseudomonadaceaespp.)和阴沟肠杆菌(Enterobacter cloacaesp.),家蚕微粒子病病原家蚕微孢子(Nosema bombycis)和家蚕白僵病病原真菌白僵菌(Beauveriabassiana)保存于华南农业大学亚太地区蚕桑培训中心微生物实验室。

图1 桑花叶型萎缩病症状Fig.1 Symptom of mulberry mosaic dwarf disease
1.2 CTAB法抽提植物基因组DNA
在CTAB法提取植物DNA[10]的基础上,为提高DNA的纯度,在加入600 mL异丙醇后,将全部液体吸入核酸纯化吸附柱套件中,12 000 r/min离心30 s过滤,弃滤液;加入70%乙醇500 μL洗涤,12 000 r/min离心30 s,弃滤液,洗涤2次,最后空离1次;将吸附柱放置于新的1.5 mL EP管中,加50 μL ddH2O,12 000 r/min离心30 s获得桑叶总DNA。
1.3 引物的设计与合成
NCBI上获得桑花叶型萎缩病相关病毒的全基因组序列(KP303687.1)为靶序列,筛选扩增外壳蛋白基因序列引物MCP581F/MCP1464R,并以保守外壳蛋白基因为靶序列,设计特异实时荧光定量PCR检测引物MCP981F/MCP1148R。MMDaV外壳蛋白基因的PCR检测引物MCP746F/MCP1148R[7]用于对照,以上引物序列信息见表2。

表1 各地桑病叶样品信息Table 1 Information of diseased mulberry leaf sample
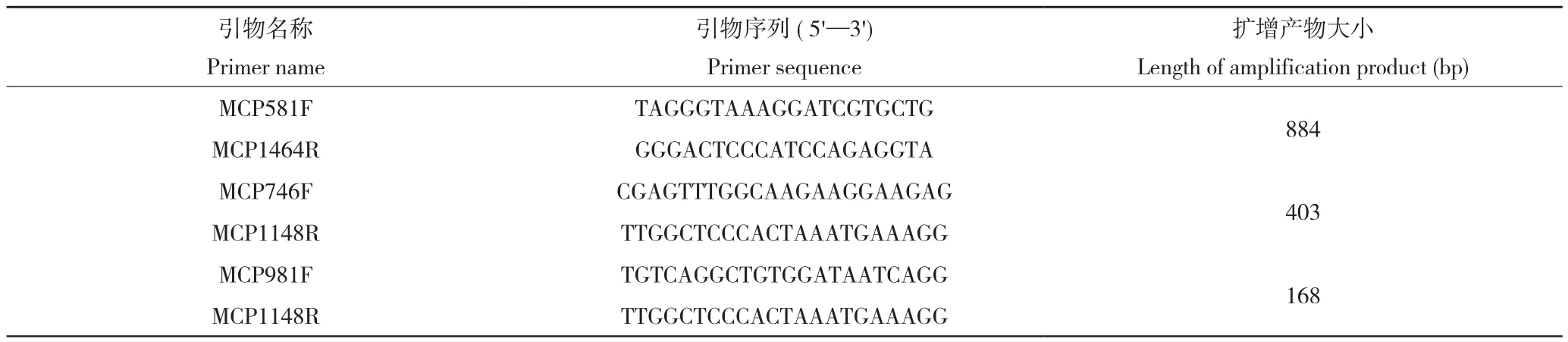
表2 引物信息Table 2 Primer information
1.4 构建阳性质粒
以皱缩和花叶状的桑病叶总DNA为模板,使用引物MCP581F/MCP1464R扩增包含病毒外壳蛋白基因序列。反应体系(20 μL):北京擎科生物科技有限公司金牌PCR Mix(TSE101) 10 μL,ddH2O 7 μL,桑病叶总DNA模板2 μL,上下游引物各0.5 μL,PCR条件为98 ℃预变性30 s,98 ℃变性 8 s,58 ℃退火 30 s,72 ℃延伸 20 s,35个循环,最后72℃延伸10 min。扩增目的条带使用TaKaRa胶回收试剂盒(MiniBEST Agarose Gel DNA Extraction Kit)纯化,纯化的片段使用北京全式金生物有限公司克隆试剂盒pEASYBlunt Cloning Kit(CB101)构建阳性质粒,使用生工SanPrep柱式质粒DNA小量抽提试剂盒(B518191-0050)提取质粒,质粒浓度使用分光光度计检测。将质粒浓度计算成拷贝数计数,计数公式:拷贝数=(6.02×1023×质粒质量)/(碱基数×660)。本实验以1.93×109copies/μL为初始浓度进行10倍梯度稀释。
1.5 实时荧光定量PCR引物检测
PCR特异性检测以皱缩和花叶状的桑病叶、桑球针壳(P.moricola)、肉阜状杯盘菌(C.carunculoides)、白僵菌(B.bassiana)、疣孢青霉(P.verruculosum)、茄科劳尔式菌(R.solanacearum)、假单胞菌(P.spp.)、阴沟肠杆菌(E.cloacaesp.)、家蚕微孢子(N.bombycis)和健康桑叶总DNA为模板对引物的特异性进行验证。PCR灵敏度检测将质粒浓度从1.93×106copies/μL到1.93×101copies/μL以10倍稀释作为模板进行检测。检测引物反应体系(20 μL):2×TaqMaster Mix(Microanalysis Inc)10 μL,ddH2O 7 μL,DNA 模板 2 μL,上下游引物各0.5 μL,PCR条件:95 ℃预变性5 min,95 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸10 s,35个循环,最后72 ℃延伸10 min。扩增的片段经1.2%琼脂糖凝胶电泳检测。
实时荧光定量PCR特异性检测的DNA模板参照PCR检测模板,其灵敏度检测将阳性质粒从1.93×105copies/μL 到 1.93×101copies/μL 浓 度以10倍梯度稀释制成标准参照液,每个浓度重复检测3次。反应体系(20 μL),SYBR Green Realtime PCR Master Mix(QPK-201,东 洋 纺 生物有限公司)10 μL,ddH2O 7 μL,DNA模板2 μL,上下游引物各0.5 μL,实时荧光定量PCR条件:95℃预变性5 min,95℃变性10 s,60 ℃退火15 s,72 ℃延伸10 s,35个循环。仪器为MYGOmini荧光定量PCR仪(3OY-XT4-7NN,IT-IS Life Science Ltd)。
2 结果与分析
2.1 构建MMDaV阳性质粒
扩增获得包含MMDaV外壳蛋白基因的序列,成功构建MMDaV外壳蛋白基因克隆质粒MCP14-pEASY-Blunt,质粒中包含外壳蛋白基因长度为884bp,NCBI上blast仅对比到桑花叶型萎缩病相关病毒(KR131749.1),最大相似率为97.96%。
2.2 检测引物PCR的特异性及灵敏性检测
检测引物MCP981F/MCP1148R的PCR特异性及灵敏度(图2)。特异性检测结果除了花叶皱缩状的桑病叶总DNA及阳性质粒存在大小为168 bp左右的目的条带,其他参照样品和阴性对照均无目的条带,说明该引物的PCR特异性良好。灵敏度检测结果质粒浓度从1.93×106copies/μL到1.93×103copies/μL存在明显条带,其余泳道无条带,说明该引物的PCR最低检测限为1.93×103copies/μL。

图2 引物特异性及灵敏性PCR检测Fig.2 PCR detection for specificity and sensitivity of primers
2.3 实时荧光定量PCR标准曲线
成功构建阳性质粒标准曲线,从荧光曲线(图3)可以看出,不同浓度之间存在明显的梯度,且重复性良好。以质粒浓度为横坐标,3次Cq平均值为纵坐标制作标准曲线(图4),结果浓度与Cq值之间线性关系良好,标准曲线为y= -3.3739x+ 33.083,其 中R2= 0.9992,斜 率为 -3.3739,扩增效率(E=10^(-1/标准曲线斜率)-1)为97.88%。以Cq值≤30的作为检测敏感区间,检测的最低有效质粒浓度为8 copies/μL。
2.4 实时荧光定量PCR特异性检测
对该引物的实时荧光定量PCR检测的特异性进行验证,结果(图5)除了对阳性质粒和花叶皱缩状的桑病叶检测出现曲线,其他样品均未出现曲线,说明该引物在实时荧光定量PCR检测上的特异性良好。
2.5 实时荧光定量PCR检测各地样品
使用构建的实时荧光定量PCR检测方法对采集于广东、广西、海南、重庆、陕西和江西等6个省区花叶皱缩状的桑病叶样品进行检测。对比引物MCP746F/MCP1148R的PCR检测与实时荧光定量PCR检测,结果(图6)PCR对各地桑病叶样品检测均有条带,条带强弱不一,实时荧光定量PCR对各地桑病叶样品检测 均有相应的曲线(图7),检测的Cq值在9.69~26.17之间。并且实时荧光定量PCR与普通PCR电泳条带强弱程度存在对应的Cq值,普通PCR条带亮度强的,其实时荧光定量PCR检测的Cq值越小,反之越大。说明实时荧光定量PCR对各地桑病叶样品均具检测结果,且检测结果稳定可靠且可量化。

图3 不同浓度质粒的实时荧光定量PCRFig.3 The real-time fluorescence quantitative PCR for plasmids with different concentrations
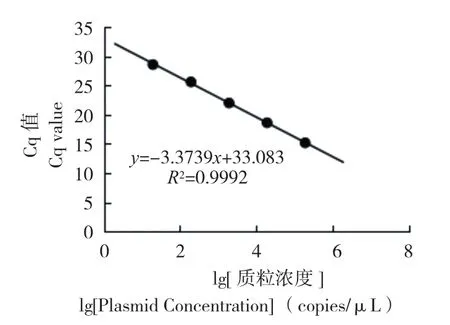
图4 标准曲线Fig.4 Standard curve
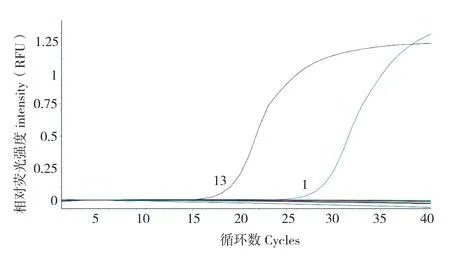
图5 引物实时荧光定量PCR特异性验证Fig.5 Real-time fluorescence quantitative PCR for primer-specific detection
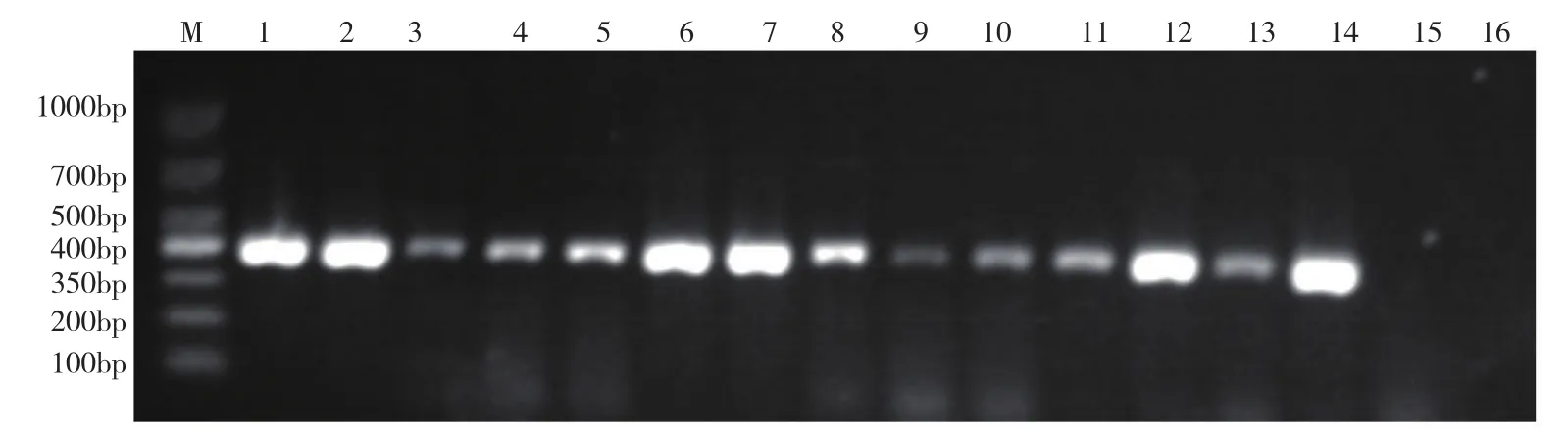
图6 各地样品PCR检测电泳结果Fig.6 PCR detection results of samples from different provinces
3 讨论

图7 各地样品的实时荧光定量PCR检测Fig.7 Real-time fluorescence quantitative PCR detection of samples from different provinces
实时荧光定量PCR比普通PCR和LAMP检测技术的灵敏度高[11],该技术可生产成诊断试剂盒[12]。在植物病毒检测上,实时荧光定量PCR被广泛应用于我国产量最高的苹果、梨、柑橘、葡萄和香蕉等5种果树中病毒的检测,其中病毒外壳蛋白基因为最常用的检测靶标[13]。本研究采用应用最广的非特性性染料SYBR Green I构建MMDaV的实时荧光定量PCR,以MMDaV外壳蛋白基因序列为靶序列。在验证植物病毒检测引物的特异性时,大多数研究者使用以相同植物上的不同病毒作为参照[12-13]。目前已报道过多种桑树病毒,但都未能明确与桑树之间的关系,也不能稳定的检出,因此无法获得其他桑树病毒作为参照。因为桑树主要用来养蚕、采桑叶和采桑椹,所以本实验以桑叶、桑椹和家蚕常见病原微生物作为对照检测特异性也具有一定的实践意义。
可重复性方面,建立的标准曲线扩增效率为97.88%,在90%~105%之间且接近1,说明重复性好。标准曲线R2=0.9992,接近1,说明该检测方法可靠性高。实时荧光定量PCR可用于检测不同时期带病植株和昆虫体内的病毒量[14-15],本研究建立的MMDaV实时荧光定量PCR能够定量的检测MMDaV,该检测方法最低有效质粒检测浓度为8 copie/μL,与凌薇等[14]构建的樱桃叶斑驳病毒实时荧光定量PCR检测方法有效质粒检测浓度为23 copies/μL均具有较高灵敏度,并且其灵敏度是MMDaV常规PCR的24倍[7]。
虽然桑花叶型萎缩病在全国各大蚕区均有发生,但至今仅在江苏镇江[8]和陕西安康学院[16]两地有MMDaV的报道,此次在广东、广西、海南、陕西、重庆和江西等地皱缩和花叶的桑病叶中均检测到MMDaV,MMDaV的检出地点增加。
4 结论
本研究建立的MMDaV实时荧光定量PCR检测方法具有特异性强、灵敏度高、可重复性和可定量等特点,可应用于广东、广西、海南、陕西、重庆和江西等多个地方桑病叶MMDaV的定量检测。
