吡格列酮对三硝基苯磺酸诱导炎症性肠病大鼠过氧化物酶体增殖物激活受体γ和核因子-κB p65的影响
2019-10-09葛相栓刘小玲王慧超李君芳
葛相栓,刘小玲,王慧超,李君芳
炎症性肠病(inflammatory bowel disease,IBD)是一类多种病因引起的、异常免疫介导的肠道慢性及复发性炎症。过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor gamma,PPAR-γ)具有炎症调控作用。本研究于2006年9月至2007年8月将PPAR-γ配体吡格列酮干预三硝基苯磺酸(TNBS)诱导的IBD大鼠,通过观察大鼠的疾病活动度和结肠黏膜损伤情况并检测结肠PPAR-γ,核因子-κB p65(NF-κB p65)表达,探讨吡格列酮对大鼠IBD可能的作用机制和治疗效果,为其今后应用于IBD临床治疗提供理论依据。

图1 对照组、模型组及干预组大鼠结肠黏膜结构及过氧化物酶体增殖物激活受体γ(PPAR-γ)和核因子-κB p65(NF-κB p65)的表达:A、B、C分别是对照组、模型组及中剂量干预组大鼠结肠黏膜结构(HE染色×40);D、E、F、G分别是模型组及中剂量干预组PPAR-γ与NF-κB p65的表达(免疫组织化学SP法×100)
1 材料与方法
1.1实验动物3月龄清洁级大鼠48只,体质量(200±20)g,由安徽医科大学动物实验中心提供。饲养条件:室内温度18~22℃,相对湿度50%~60%,光照12 h/d,自由饮水,饲喂鼠全价饲料,隔日更换垫料。本研究符合一般动物实验伦理学原则。
1.2主要试剂及仪器盐酸吡格列酮片,江苏恒瑞医药股份有限公司,生产批号040525,规格:30 mg;柳氮磺吡啶(SASP),上海信谊天平药业有限公司,生产批号06181105,规格:15 mg;兔抗鼠PPAR-γ多克隆抗体,上海钰博生物科技有限公司,浓度:1 mg/mL;羊抗兔过氧化物酶标记的链酶卵白素(SP)染色试剂盒,北京中衫金桥生物技术有限公司;兔抗NF-κB p65单克隆抗体,艾美捷科技有限公司,羊抗兔SP试剂盒,北京中杉金桥生物技术有限公司;TNBS,上海榕柏生物技术有限公司,规格:10 mL;图像采集系统,美国PixeLINK1394 camera公司。
1.3实验设计
1.3.1分组 48只SD大鼠称体质量后编号,采用随机数字表法分为对照组、模型组、SASP药物治疗组(SASP组)、吡格列酮低剂量治疗组(低剂量组)、吡格列酮中剂量治疗组(中剂量组)、吡格列酮高剂量治疗组(高剂量组),每组8只,其中后四组为干预组。
1.3.2模型构建 TNBS/乙醇溶液(5%TNBS溶于50%乙醇中,体积比2∶1)法构建模型。原理:乙醇破坏结肠黏膜屏障,TNBS与肠黏膜角蛋白结合,激发局部的免疫反应,引起局部出血、水肿,糜烂,形成溃疡,详细过程参考文献[1]。对照组给予0.9%氯化钠溶液灌肠,其余各组均TNBS/乙醇溶液进行结肠炎模型构建。
1.3.3各组处置 对照组、模型组:0.9%氯化钠溶液灌胃,每日1次;吡格列酮低剂量组、中剂量组、高剂量组:分别予吡格列酮2 mg/kg、4 mg/kg、6 mg/kg灌胃,每日1次;SASP组:给予SASP 100 mg/kg灌胃,每日1次。均于造模后第2天开始灌胃。
1.3.4标本采集 饲养14 d后开腹暴露腹主动脉,负压管采取血液,低速离心后留血清,-75℃保存。游离结肠组织,取病变最明显处组织,应用4%多聚甲醛液固定,石蜡包埋。
1.4免疫组织化学检测免疫组织化学法检测大鼠结肠组织NF-κB p65、PPAR-γ蛋白的表达,操作步骤参照试剂盒说明书进行。用PBS代替一抗作为阴性对照。切片集中染色。染色及结果判定:NF-κB p65、PPAR-γ阳性表达均为细胞核内和(或)胞质出现棕黄色颗粒。由两位有经验的病理医师在光学显微镜下盲法读片,观察阳性染色在胞质、胞核的分布。每张切片任意选择5个100倍视野,采用病理图像分析系统分析阳性细胞积分光密度值。
1.5观察指标
1.5.1结肠炎症活动指数(DAI) 观察动物体质量下降比例、大便性状及血便的改变,按照结肠炎症活动评分标准[2],代入公式DAI=(体质量下降分数+大便性状分数+便血分数)/3,计算大鼠的炎症活动。
1.5.2结肠黏膜大体形态损伤指数(CMDI) 肉眼观察结肠黏膜的充血、水肿、壁内溃疡、肠壁厚度及肠管长度的改变,参照Wallace、Keenan[3]结肠黏膜大体损伤评分标准进行结肠黏膜大体损伤评分。
1.5.3结肠黏膜组织学损伤指数(TDI) 显微镜下观察组织切片有无溃疡、淋巴细胞浸润、嗜中性粒细胞浸润及浸润深度、黏蛋白减少、假膜形成等11项指标,进行评分,具体评分细则参照Pullan等[4]组织病理学评分标准。上述评分均由病理科医师采用盲法进行。
1.6统计学方法所有数据采用SPSS 18.0统计软件分析处理。不同组别间的数值比较采用单因素方差分析,两两比较采用LSD-t检验。NF-κB p65、PPARγ表达水平双变量间的单因素相关性分析采用Pearson相关性分析。P<0.05表示差异有统计学意义。
2 结果
2.1结肠DAI不同组间均数比较,F=8.495,P=0.000。SASP组、吡格列酮低、中及高剂量组DAI与模型组比较,均低于模型组,P值分别是0.000、0.010、0.000、0.010;中剂量治疗组与SASP组比较,P=0.6900,差异无统计学意义;吡格列酮低剂量治疗组、高剂量组DAI与SASP组比较,P值分别是0.020、0.020,差异有统计学意义。具体数值见表1。
2.2结肠黏膜CMDI对照组、模型组、SASP组、低剂量组、中剂量组、高剂量组结肠长度分别为(9.01±0.01)cm、(8.95±0.01)cm、(9.10±0.20)、(9.21±0.15)cm、(8.97±0.17)cm、(9.00±0.05)cm,差异无统计学意义,P=0.120。不同组间均数比较,F=7.057,P=0.000。SASP组、吡格列酮低剂量组、中剂量组、高剂量组与模型组比较显著低于模型组,P值分别是0.000、0.001、0.000、0.005。吡格列酮不同剂量治疗组与SASP组相比差异无统计学意义,P值分别是0.456、1.000、0.1400。具体数值见表1。
2.3结肠黏膜TDI不同组间均数比较,F=20.573,P=0.000。SASP组、吡格列酮低剂量组、中剂量治疗组、高剂量治疗组与模型组TDI比较,均P=0.000,低于模型组。吡格列酮不同剂量治疗组与SASP药物组比较,P值分别是0.568、0.849、0.568,差异无统计学意义。具体数值见表1。
2.4结肠NF-κBp65、PPAR-γ检测
2.4.1对照组可见大量PPAR-γ阳性颗粒,主要位于细胞质;不同组间PPAR-γ均数比较,F=47.101,P=0.000。模型组PPAR-γ表达显著低于对照组,P=0.000;SASP组、吡格列酮低剂量组、中剂量组、高剂量组PPAR-γ表达显著高于模型组,均P=0.000,阳性颗粒主要位于肠上皮细胞和部分炎症细胞的细胞核;吡格列酮低剂量组、中剂量组、高剂量组PPAR-γ与SASP组相比较,P值分别是0.000、0.773、0.004。
不同组间NF-κB p65均数比较,F=105.725,P=0.000。对照组NF-κB p65阳性细胞少见,以胞质表达为主;模型组可见大量肠上皮细胞和炎症细胞的细胞核中有NF-κB p65阳性颗粒分布,表达显著高于对照组,P=0.000;SASP组、吡格列酮低剂量组、中剂量组、高剂量组PPAR-γ表达显著低于模型组,均P=0.000。吡格列酮中、高剂量组与SASP组相比差异无统计学意义,P值分别是0.370、0.952。具体数值见表2及图1。
表1 不同组别大鼠结肠组织炎症活动指数(DAI)、大体形态损伤指数(CMDI)、组织学损伤指数(TDI)的比较/±s

表1 不同组别大鼠结肠组织炎症活动指数(DAI)、大体形态损伤指数(CMDI)、组织学损伤指数(TDI)的比较/±s
注:DAI(炎症活动指数)中a示与模型比较,P值分别是0.001、0.010、0.002、0.009;b示与SASP组比较,P值分别是0.019、0.687、0.020;CMDI(大体形态损伤指数)中c示与模型比较,P值分别是0.000、0.001、0.000、0.005;d示与SASP组比较,P值分别是0.456、1.000、0.140;TDI(组织学损伤指数)中e示与模型比较,均P=0.000;f示与SASP组比较,P值分别是0.568、0.849、0.568
组别模型组SASP组低剂量组中剂量组高剂量组F值P值鼠数8 8 8 8 8 DAI 3.13±0.83 1.50±0.53a 2.25±0.71ab 1.63±0.52ab 2.25±0.46ab 8.495 0.000 CMDI 2.63±0.52 1.13±0.83c 1.38±0.52cd 1.13±0.83cd 1.63±0.84cd 7.057 0.000 TDI 9.50±1.93 4.63±1.19e 5.00±1.31ef 4.75±1.04ef 4.00±0.76ef 20.573 0.000
表2 不同组别大鼠结肠组织过氧化物酶体增殖物激活受体γ(PPAR-γ)及核因子-κB p65[NF-κB p65]的比较/±s
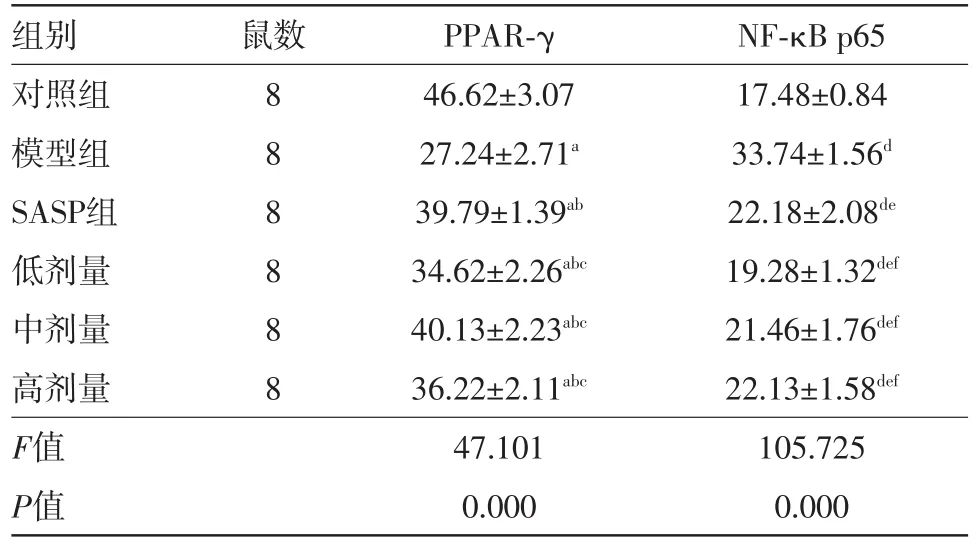
表2 不同组别大鼠结肠组织过氧化物酶体增殖物激活受体γ(PPAR-γ)及核因子-κB p65[NF-κB p65]的比较/±s
注:PPAR-γ(过氧化物酶体增殖物激活受体γ)中a示与对照组比较,P=0.000;b示与模型比较,均P=0.000;c示与SASP组比较,P值分别是0.000、0.773、0.004。NF-κB p65[核因子-κB p65]中d示与对照组比较,P=0.000;e示与模型比较,均P=0.000;f示与SASP组比较,P值分别是0.001、0.370、0.952
组别对照组模型组SASP组低剂量中剂量高剂量F值P值鼠数88 8 8 8 8 PPAR-γ 46.62±3.07 27.24±2.71a 39.79±1.39ab 34.62±2.26abc 40.13±2.23abc 36.22±2.11abc 47.101 0.000 NF-κB p65 17.48±0.84 33.74±1.56d 22.18±2.08de 19.28±1.32def 21.46±1.76def 22.13±1.58def 105.725 0.000
2.4.2NF-κB p65、PPARγ关联性分析 对照组、模型组、SASP组、吡格列酮低剂量组、中剂量组、高剂量组PPAR-γ与NF-κB p65的表达均呈负相关(相关系数分别为-0.851、-0.875、-0.771、-0.776、-0.766、-0.910,P值分别是 0.007、0.004、0.025、0.024、0.027、0.000)。
3 讨论
目前认为IBD的发病与环境因素、免疫、遗传、感染等多种因素有关,肠道免疫系统导致免疫反应和炎症过程。活化的免疫细胞,如单个核细胞、T细胞、B细胞经刺激后合成或分泌的细胞因子在IBD的发病机制中起重要的调节作用,其中促炎和抗炎细胞因子失衡在IBD发病过程中起关键作用[5]。免疫是目前IBD研究的热点。
NF-κB是一种参与炎症、免疫反应的重要转录因子,许多分子都受NF-κB的调控,如TNF(肿瘤坏死因子)-α、IL(白细胞介素)-1β、IL-8、IL-12、IL-2、IL-6、iNOS(诱导型一氧化氮合酶)、COX2(环氧酶2)、炎症趋化因子、黏附分子[5]。NF-κB活化通过两种主要的信号通路:经典和非经典信号通路。经典的NF-κB激活途径来自不同免疫受体的刺激,激活程度是快速且短暂的,而非经典途径是缓慢且持久的[6]。NF-κB在克罗恩病病人巨噬细胞中表达明显升高,促使结肠上皮细胞促炎细胞因子表达增加,肠道炎症反应增强。而作为NF-κB拮抗剂的二硫代氨基甲酸吡咯烷,通过降低NF-κB活性来缓解DSS诱导的结肠炎症[7]。上述研究表明NF-κB在IBD中的促炎作用。NF-κB p65作为NF-κB家族成员之一,本研究发现TNBS诱导结肠炎模型中NF-κB p65的表达较同期正常对照组明显增高,给予SASP及吡格列酮干预后不同程度降低。这印证了上述观点。
PPAR-γ是介导脂肪酸及过氧化物酶体增殖物,分别在巨噬细胞、结肠上皮细胞及其它种类的免疫细胞上表达,在健康的大肠上皮细胞上高表达,而在IBD中低表达[8]。在克罗恩病病人和TNBS诱导的结肠炎模型中,PPAR-γ水平下降[9],表达PPAR-γ的基因载体或PPAR-γ激动剂(吡格列酮和姜黄素)能降低不同结肠炎模型的黏膜炎症和疾病的严重程度。相反,破坏结肠PPAR-γ的表达能使化学药物诱导结肠炎的敏感性增加。本研究中结肠炎模型组PPAR-γ下降,给予吡格列酮及SASP干预后不同程度升高,与上述研究一致,表明PPAR-γ参与了IBD的炎症反应过程。
PPAR-γ主要通过抑制炎症通路中NF-κB、AP-1、STAT及NFAT等转录因子的活性来发挥抗炎作用[10-11]。Yang等[9]研究表明TNBS诱导大鼠结肠炎模型中CMDI、DAI、NF-кB、TNF-α、IL-6、MPO(髓过氧化物酶)等升高,PPAR-γ降低,给予穿心莲内酯衍生物干预后,前者下降、后者升高[12]。研究显示含有吡唑的中氮茚衍生的化合物B4能通过激活PPAR-γ的表达来抑制NF-κB活化,缓解TNBS诱导的结肠炎大鼠的症状,包括体质量下降、肠道病理损伤及炎症细胞的浸润。相反,PPAR-γ拮抗剂GW9662能抑制 B4的抗炎效果[7]。Wang等[13]研究表明在葡聚糖硫酸酯钠诱导鼠实验性结肠炎,千层纸素苷通过PPARγ激活来抑制NF-κB通路发挥抗炎作用。本研究表明,给予PPAR-γ配体吡格列酮后PPAR-γ表达升高,而NF-κB p65表达下降。这说明实验性结肠炎中NF-κB和PPAR-γ负相关,其相互关系为:PPAR-γ的活化能抑制NF-κB下游信号表达,从而减轻肠道炎症。
吡格列酮是胰岛素增敏剂噻唑烷二酮类降糖药。早期研究表明噻唑烷二酮类药物对TNBS诱导的结肠炎有治疗作用[14]。罗格列酮作为PPAR-γ的配体能调控单核细胞和巨噬细胞中多种细胞因子的表达,如IL-1β,COX-2,IL-6,IL-8,TNF-α,INF(干扰素)-γ,iNOS和炎症趋化因子的表达,减轻肠道炎症,特别是NF-кB的表达[15-16]。梁红亮和欧阳钦[17]在恶唑酮诱导的小鼠结肠炎模型中发现罗格列酮治疗后PPAR-γ表达阳性率随时间的延长而逐渐增高,NF-κB p65、Fas/Fasl和Caspase-3表达阳性率随时间的延长而逐渐递减,说明PPAR-γ配体噻唑烷二酮类通过激活PPAR-γ来抑制NF-κB活化,从而缓解结肠炎症。本研究中吡格列酮干预实验与上述结论一致。
总之,本实验显示吡格列酮可有效改善TNBS诱导的IBD大鼠的症状,其作用机制可能是吡格列酮作为PPAR-γ人工配体,通过增加PPAR-γ的表达,抑制促炎因子NF-κB p65的表达,减轻结肠的炎症和免疫反应。同时,本研究也为吡格列酮治疗结肠炎提供了一定理论依据。
志谢中国科技大学第一附属医院消化内科吴正祥教授及河南大学基础医学院乔玲教授在本研究设计、指标检测、论文书写及数据统计等方面给予耐心、详尽的指导
(本文图1见插图10-1)
