Caprini和Rogers血栓风险评估模型在胸外科肺癌患者围手术期应用的验证研究*
2019-10-09郭海方强黄建鸣周红任光国韩泳涛
郭海,方强,黄建鸣 ,周红,任光国,韩泳涛
610041成都 四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 胸外科中心[郭海(现工作单位:610213成都,成都天府新区人民医院 胸外科)、方强、周红、任光国、韩泳涛],研究所(黄建鸣)
静脉血栓栓塞症(venous thromboembolism,VTE)是恶性肿瘤常见的并发症,严重影响肿瘤患者的生活质量及生存率。VTE的主要两种形式深静脉血栓形成(deep venous thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)在胸外科肺癌手术患者围术期的发生率并不低,尤其PE是肺癌外科的第二位猝死原因[1-2]。PE栓子约80%~95%源自右心或者静脉系统的DVT[2],因此积极有目地性地预防DVT可以有效防止患者发生PE,从而避免肺癌术后灾难性事件发生。通过对潜在患病人群进行VTE风险评估和筛查,进而对不同风险等级的患者采取相应的预防措施是目前防范VTE发生的主要策略,这就需要借助简单实用且有效的 VTE 风险评估工具。现阶段外科用于评估VTE高风险人群的VTE 风险评估工具主要是Caprini和Rogers血栓风险评估量表,但此二量表在我国胸外科肺癌患者围术期应用及筛检出高风险VTE人群的有效性尚不确切,有关其临床验证评价的前瞻性研究报道较少[3],因此其在预防VTE中的指导价值和意义仍不明确。本研究通过对Caprini和Rogers血栓风险评估量表在我国胸外科肺癌患者围术期筛查高风险VTE的适用性进行分析,以验证其判断实际发生VTE的有效性。
1 资料和方法
1.1 研究设计
采用前瞻性队列研究,连续纳入2015年3月至2017年3月在四川省肿瘤医院胸外科中心接受手术治疗的肺癌患者,术后未预防性抗凝处理。所有患者围术期行双下肢血管彩超筛查DVT,怀疑肺血管栓塞者行胸部CT检查。采用Caprini和Rogers血栓风险评估量表对每例手术患者进行评分,分析各VTE不同风险层级组间的VTE实际发生率和临床指标特点。肺癌分期使用IASLC TNM(2009)[4]。本研究通过了本院伦理委员会审批,患者及家属均签署知情同意书。
1.2 纳入与排除标准:
1.2.1 纳入标准 (1)病理证实为肺癌;(2)接受手术治疗者;(3)既往无栓塞或抗凝病史者;(4)围术期无严重并发症者;(5)术后均未预防性抗凝治疗。
1.2.2 排除标准 (1)术后病理证实肺良性肿瘤者;(2)术前加压超声(compressed ultrasonic,CUS)证实DVT阳性者;(3)术后需再次手术者;(4)拒绝参加该临床试验者。
1.3 VTE诊断标准
1.3.1 PE诊断标准 胸部增强CT扫描在肺动脉及其分支内发现血凝块或动脉充盈缺损征象[5];
1.3.2 DVT诊断标准 线阵式超声探头,探头频率在3.5~5.0 MHz之间,血管与声束取60°夹角,取样容积置于血管中央,在下肢静脉血管内发现新近出现的血栓的直接征象,CDFI证实无血流信号[6]。
1.4 VTE风险层级评价
Caprini量表VTE风险等级[美国胸科医师学会(American College of Chest Physicians,ACCP)抗栓指南第9版分级标准,适用于非骨科的外科患者][7]:低危1~2分;中危3~4分;高危5~8分;极高危>8分。Rogers量表VTE风险等级(ACCP抗栓指南第9版分级标准)[7]:非常低危<7分;低危7~10分;中高危>10分。
1.5 临床和实验室相关指标
1.5.1 VTE临床危险因素 VTE临床危险因素包括:年龄、身体质量指数(body mass index,BMI)、性别、组织学类型、病理分期、吸烟指数、慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)、肺功能、手术时间、术后卧床时间、胸引管留置时间、电视胸腔镜辅助手术(video assisted thoracoscopic surgery,VATS)、血型、围术期输血[8]。筛选出VTE阳性组和阴性组之间有统计学差异的以上临床危险因素,再分别比较Caprini和Rogers血栓风险评估不同VTE风险层级组之间以上临床指标的差异。
1.5.2 实验室相关指标 凝血指标:D-二聚体(D-Dimmer)、纤维蛋白原(fibrinogen,FIB)、纤维蛋白原降解产物(fibrinogen degradation products,FDP);其它指标:中性-淋巴细胞比值(neutral-lymphocyte ratio, NLR)[8-9]。测定时点:术前(术前72小时内)、术后第1天,术后第3天,术后第7天。血标本:晨起空腹静脉血。
1.6 统计学方法
采用IBM SPSS 22.0统计软件包进行分析。Χ2-检验用于计数资料率的分析,均数比较采用t-检验或方差分析。危险因素用单因素分析及logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
术前共招募183名拟诊“肺癌”患者,术后不符合纳入标准者31例予以排除,最终152例肺癌患者入选本研究。其中男98例、女54例,平均年龄(58.8±9.6)(26~79)岁。全组患者Caprini评分为8~15分,平均(8.6±1.4)分,其中高危组(5~8分)66例,平均(6.7±0.6)分,极高危组(>8分)86例,平均(9.0±0.8)分;全组Rogers评分6~18分,平均(8.7±1.5)分,其中低危组(7~10分)67例,平均(6.3±1.1)分,中高危组(>10分)85例,平均(10.7±1.3)分。术后DVT发生率25%(38/152),无PE发生;Caprini评分高危组发生18例(27.3%),极高危组发生20例(23.3%);Rogers评分低危组发生17例(25.4%),中高危组发生21例(24.7%)。
2.1 DVT(+)与DVT(-)组临床危险因素比较
单因素分析结果显示,DVT(+)组与DVT(-)组间年龄、手术持续时间、术后卧床时间、胸引管留置时间的差异具有统计学意义(P<0.05)。两组之间吸烟指数、血型构成、合并COPD病史、组织学类型、VATS、手术时间(<90和≥90 min)、术后卧床时间(≤72和>72小时)、病理分期的差异亦具有统计学意义(P<0.05),因此以上这些因素是与DVT相关的危险因素(表1)。
表1 DVT(+)与DVT(-)临床危险因素比较
Table 1. Clinical Risk Factors of DVT (+) and DVT (-)
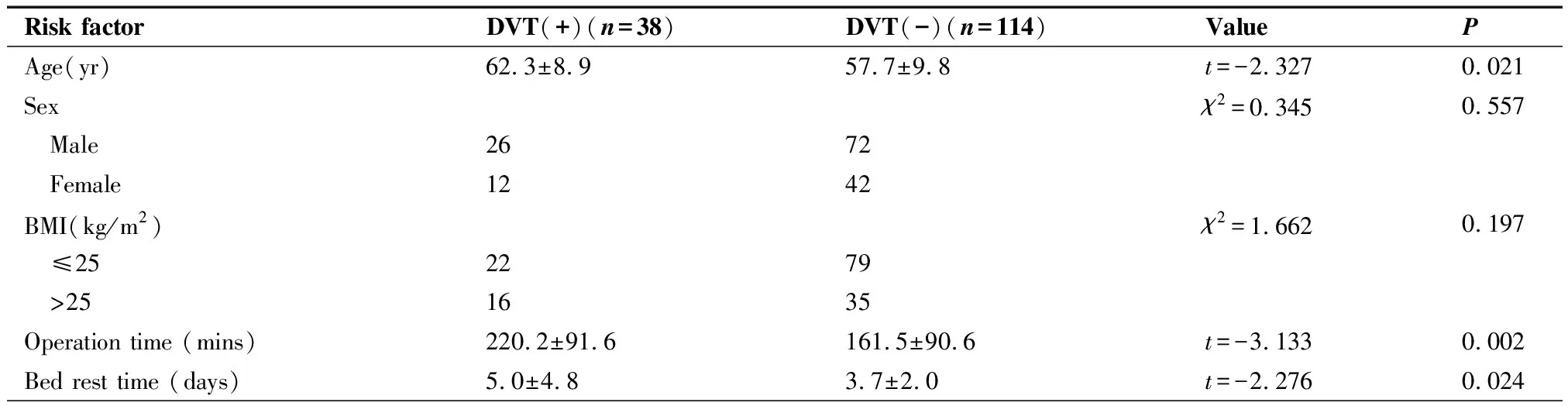
Risk factorDVT(+)(n=38)DVT(-)(n=114)ValuePAge(yr)62.3±8.957.7±9.8t=-2.3270.021Sexχ2=0.3450.557 Male2672 Female1242BMI(kg/m2)χ2=1.6620.197 ≤252279 >251635Operation time (mins)220.2±91.6161.5±90.6t=-3.1330.002Bed rest time (days)5.0±4.83.7±2.0t=-2.2760.024
(Table 1 continues on next page)
(Continued from previous page)
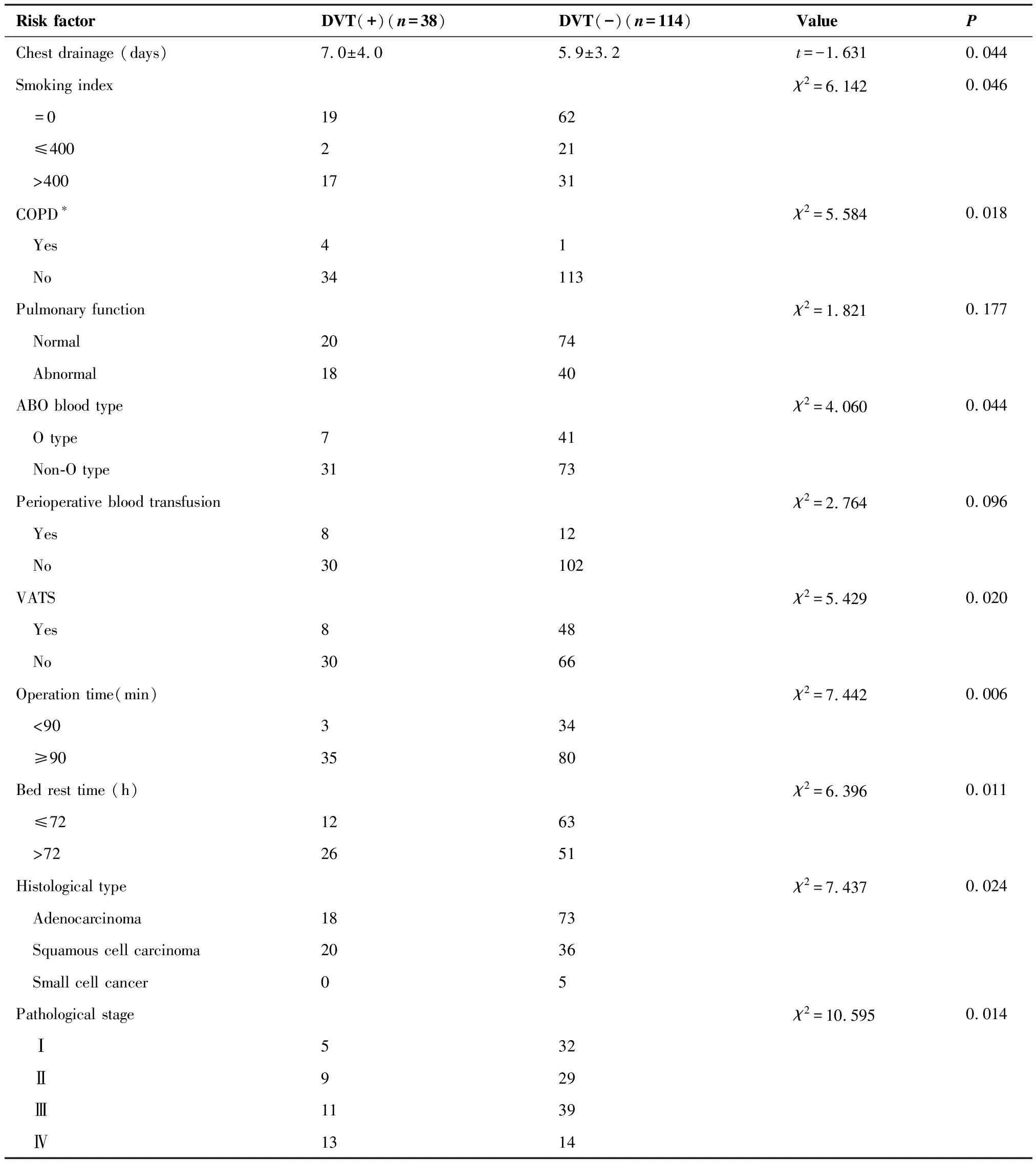
Risk factorDVT(+)(n=38)DVT(-)(n=114)ValuePChest drainage (days)7.0±4.05.9±3.2t=-1.6310.044Smoking indexχ2=6.1420.046 =01962 ≤400221 >4001731COPD∗χ2=5.5840.018 Yes41 No34113Pulmonary functionχ2=1.8210.177 Normal2074 Abnormal1840ABO blood typeχ2=4.0600.044 O type741 Non-O type3173Perioperative blood transfusionχ2=2.7640.096 Yes812 No30102VATSχ2=5.4290.020 Yes848 No3066Operation time(min)χ2=7.4420.006 <90334 ≥903580Bed rest time (h)χ2=6.3960.011 ≤721263 >722651Histological typeχ2=7.4370.024 Adenocarcinoma1873 Squamous cell carcinoma2036 Small cell cancer05Pathological stageχ2=10.5950.014 Ⅰ532 Ⅱ929 Ⅲ1139 Ⅳ1314
DVT:deep venous thrombosis;BMI:body mass index;COPD:chronic obstructive pulmonary diseases;VATS:video-assisted thoracic surgery.
*Diagnostic standards for COPD[10].
2.2 DVT危险因素的logistic回归分析
Logistic回归分析结果显示:合并COPD(OR:53.793,95%CI:3.58~808.05,P=0.004)、IV期肺癌(OR:8.803,95%CI:1.809~42.837,P=0.007)、手术时间≥90min(OR:4.231,95%CI:1.126~15.892,P=0.033)、非O型血(OR:5.562,95%CI:1.510~20.485,P=0.010)是与DVT相关的危险因素;年龄(OR: 1.010,95%CI:0.951~1.072,P=0.755)、术后卧床时间(OR:1.012,95%CI:0.839~1.220,P=0.899)、胸引管留置时间(OR:0.984,95%CI:0.831~1.165,P=0.855)、吸烟指数(OR:1.001,95%CI:1.000~1.003,P=0.162)不是与DVT相关的危险因素(表2)。
表2 肺癌围手术期DVT危险因素的logistic回归分析
Table 2. Logistic Regression Analysis of DVT Risk Factors in Lung Cancer Patients in the Perioperative Time
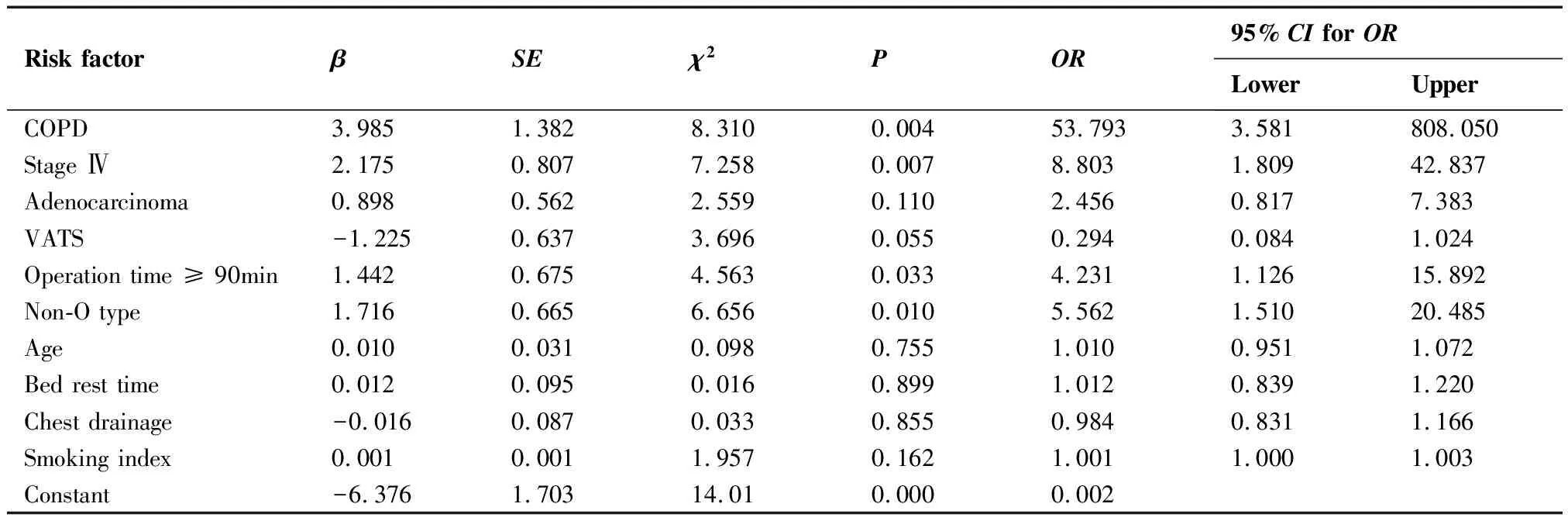
Risk factorβSEχ2POR 95% CI for ORLowerUpperCOPD3.9851.3828.3100.00453.7933.581808.050Stage Ⅳ2.1750.8077.2580.0078.8031.80942.837Adenocarcinoma0.8980.5622.5590.1102.4560.8177.383VATS-1.2250.6373.6960.0550.2940.0841.024Operation time ≥ 90min1.4420.6754.5630.0334.2311.12615.892Non-O type1.7160.6656.6560.0105.5621.51020.485Age0.0100.0310.0980.7551.0100.9511.072Bed rest time0.0120.0950.0160.8991.0120.8391.220Chest drainage-0.0160.0870.0330.8550.9840.8311.166Smoking index0.0010.0011.9570.1621.0011.0001.003Constant-6.3761.70314.010.0000.002
DVT:deep venous thrombosis; COPD:chronic obstructive pulmonary diseases; VATS:video-assisted thoracic surgery.
2.3 基于Caprini量表不同VTE风险层级的临床特点
基于Caprini风险模型,高危组与极高危组DVT发生率为27.3%vs23.3%(χ2=0.321,P=0.571),差异无统计学意义。高危组与极高危组患者在年龄、手术持续时间、术后卧床时间、胸引管留置时间之间的差异均无统计学意义(P>0.05);在吸烟指数、不同术式构成、血型构成、合并COPD病史、组织学类型、VATS、手术时间(<90和≥90 min)、术后卧床时间(≤72和>72小时)、病理学类型比例的差异亦无统计学意义(P>0.05)。
2.4 基于Rogers量表不同风险层级的临床特点
基于Rogers评分量表评价VTE风险,低危组与中高危组DVT发生率为25.4%vs24.7%(χ2=0.009,P=0.925),差异无统计学意义。低危组患者与中高危组患者在年龄、手术持续时间、胸引管留置时间之间的差异均无统计学意义(P>0.05);两组患者的吸烟指数、不同术式构成、血型构成、合并COPD病史、组织学类型、VATS、手术时间(<90和≥90 min)、术后卧床时间(≤72和>72小时)、病理学类型比例的差异亦无统计学意义(P>0.05)。
2.5 基于Caprini和Rogers不同VTE风险层级的围术期凝血指标及NLR比较
2.5.1 Caprini不同VTE风险层级围术期凝血指标及NLR比较 高危组与极高危组之间在术前的凝血指标及NLR的差异无统计学意义,术后各时点的凝血指标及NLR的差异均无统计学意义(表3)。
2.5.2 Rogers不同VTE风险层级围术期凝血指标及NLR比较 低危组与中高危组之间在术前的凝血指标及NLR的差异无统计学意义,术后各时点的凝血指标及NLR的差异亦无统计学意义(表4)。
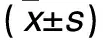
Table 3. Postoperative Coagulation Index and NLR in Different Risk Groups Stratified by Caprini Risk Assessment Model
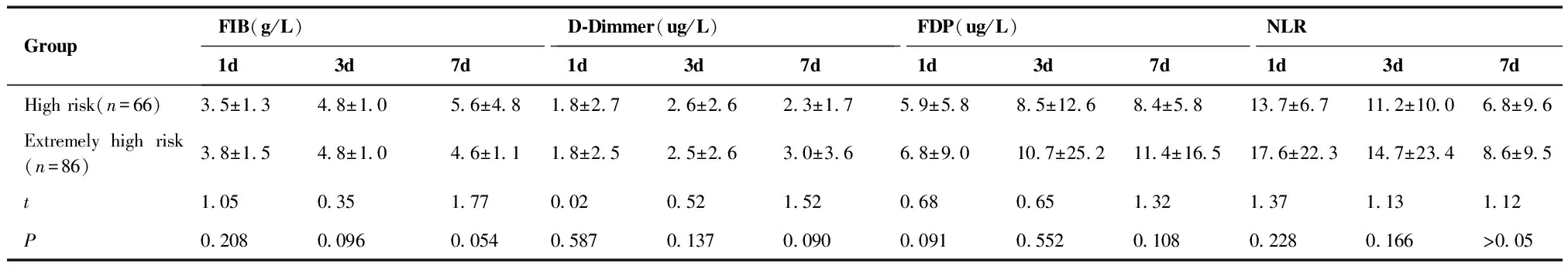
GroupFIB(g/L)D-Dimmer(ug/L)FDP(ug/L)NLR1d3d7d1d3d7d1d3d7d1d3d7dHigh risk(n=66)3.5±1.34.8±1.05.6±4.81.8±2.72.6±2.62.3±1.75.9±5.88.5±12.68.4±5.813.7±6.711.2±10.06.8±9.6Extremely high risk(n=86)3.8±1.54.8±1.04.6±1.11.8±2.52.5±2.63.0±3.66.8±9.010.7±25.211.4±16.517.6±22.314.7±23.48.6±9.5t1.050.351.770.020.521.520.680.651.321.371.131.12P0.2080.0960.0540.5870.1370.0900.0910.5520.1080.2280.166>0.05
NLR:neutral-lymphocyte ratio;FIB:fibrinogen;FDP:fibrinogen degradation products.
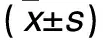
Table 4. Postoperative Coagulation Index and NLR in Different Risk Groups Stratified by Rogers Risk Assessment Model

GroupFIB(g/L)D-Dimmer(ug/L)FDP(ug/L)NLR1d3d7d1d3d7d1d3d7d1d3d7dLow risk(n=67)3.8±1.24.8±0.95.3±4.61.6±1.92.6±2.62.3±1.76.4±7.612.2±27.311.4±17.618.6±23.914.9±20.38.6±11.9Moderately high risk(n=85)3.6±1.64.8±1.04.9±1.51.9±2.92.5±2.63.0±3.66.4±7.97.5±11.38.9±7.013.5±7.311.7±17.27.2±6.8t0.910.170.670.691.391.420.041.351.071.781.030.84P0.6220.1040.3130.2250.4710.3020.1780.5190.3870.0960.194>0.05
NLR:neutral-lymphocyte ratio;FIB:fibrinogen;FDP:fibrinogen degradation products.
3 讨 论
国外研究发现,肺切除术后VTE发生率为5%,死亡率8.3%[11]。Kadlec等[12]报道950例肺癌手术患者中VTE发生率为17.6%。本组152例肺癌患者前瞻性队列研究显示,虽然没有因PE而死亡病例,但术后DVT的发生率仍高达25%,说明肺癌围术期相关诸多环节是VTE发生的高危因素,肺癌患者是术后VTE并发症的潜在高风险人群,应该施予重点预防。同时胸外科接受肺手术的肺癌患者围术期发生DVT多在术后7天内,大多数无明显症状,且发生急性PE猝死之前症状常不典型[13-16],因此通过血栓风险评估工具筛选出VTE发生的高危患者,指导VTE预防措施的个体化使用对于防治胸外科肺癌手术患者围术期VTE具有重要意义。目前国内外普通外科和骨科手术用于评判VTE风险的工具多参照Caprini和Rogers风险评估量表,但此二量表是否同样适用于国内普胸外科肺癌人群的证据还不充分。另外,从ACCP抗栓指南对此二量表的评价来看,在外科亚专业胸外科尤其是肺癌外科的验证亦缺乏充分证据[7]。
本研究结果显示Caprini血栓风险评估模型评价胸外科肺癌手术患者容易评为VTE高危组以上风险人群。本组研究对象为前瞻性连续纳入在胸外科中心接受手术治疗的肺癌患者,以中晚期居多,因此能真实反映临床工作中实际面对的肺癌人群特征。本组患者普遍具有高龄、大手术、恶性肿瘤、卧床时间长、中心静脉通路和肺功能异常的特征,导致Caprini血栓风险评估量表容易将患者评为VTE高危分值。根据ACCP抗栓指南第9版推荐,对于围术期高危风险人群应该采取机械方法和药物联合方法预防VTE发生,即均需对该类患者进行预防性抗凝治疗,因此Caprini血栓风险评估量表对于加强对胸外科肺癌患者预防VTE措施重视度具有积极指导意义。最近国内有单中心研究显示Caprini评分可有效筛选VTE高危患者[17],其结论可能与队列样本的特殊性有关,该样本大多数(84.6%)病例为中低危组,包括42%的良性疾病及纵隔肿瘤,这与我们研究中的队列特征是不同的(均为高危组以上)。ACCP抗栓指南第9版认为Caprini血栓风险评估量表可合理地将患者分为低、中、高危人群,如果将此量表应用于多数为高危分值的肺癌人群中,是否还能有效识别出真正VTE高危患者,仍需要进一步验证。在我们的研究中没有发现Caprini评分高危和极高危组之间的VTE发生率存在明显差异,说明此量表对于中国胸外科肺癌患者围术期VTE风险层级评估的有效性并不明确,进而想在临床上通过此工具来进行个体化分层预防VTE还要值得商榷。同样的,本研究在Rogers评分的验证中显示了相似的结果,即低危和中高危组之间的VTE发生率没有明显差异。
究其原因,我们推测可能此二量表中涵盖的相关危险因素缺乏肺癌外科特异性。Caprini和Rogers血栓风险评估模型分别涵盖了39项和29项VTE相关风险因素,随着评分增加,发生VTE的风险也逐步增加,但这些风险因素大部分并没有体现肺癌外科的特殊性。少数几个与肺癌外科相关的危险项目对于每个肺癌患者具有同质性, 例如在Caprini量表中肺癌患者均为恶性肿瘤(2分),术前多行深静脉穿刺术(2分),大多数是中老年患者(1~3分),普遍手术时间长(1~2分);Rogers量表中本研究除了胸膜活检、肺局部切除术等小手术都定义为呼吸系统手术(9分),容易使整体评分较高,表明胸外科肺癌手术患者属整体VTE高风险人群。根据国外学者[18-20]和本组研究结果显示,胸外科肺癌患者围术期VTE危险因素包括病理类型鳞癌或腺癌、吸烟强度、合并COPD、深静脉穿刺方式、开胸手术、非O型血型、手术时间≥90min、术后卧床时间>72小时、分期晚期等,而BMI、年龄、性别、肺功能异常、围术期输血、中心静脉通路等可能不是相关危险因素。本研究显示,无论Caprini评分高危和极高危组还是Rogers评分低危和中高危组之间VTE危险因素均无显著性差异,可能解释此二量表识别VTE有效性欠佳的原因。Caprini和Rogers血栓风险评分量表内危险因素中的年龄、性别、BMI、肺功能异常、输血等项目对于胸外科肺癌患者并不是特异性相关危险因素,这些项目贡献的评分增加反而干扰血栓风险评价的准确性。若要提高识别的有效性,量表中的有些评分项目需要进一步改进:例如量表中(大的开放手术>45min)对于衡量肺癌外科手术大小需要调整,因为胸外科肺癌手术时间普遍大于45min;量表中项目应对恶性肿瘤组织学类型进一步区分。
有研究显示,FIB、FDP、D-Dimmer、NLR对评估VTE发生风险具有一定的预测作用[21-24],然而我们的研究并没有显示两种评分量表各自不同风险层级分组之间这些实验室指标上具有统计学差异。其一方面原因可能是这些指标本身对预测VTE的特异性并不强,另一方面鉴于本研究中大多数DVT为小栓子(肌间静脉血栓),两种评分量表中的危险因素分值还不具有甄别远端DVT的能力,可能需要对评分量表纳入更细的实验室指标及诊断截断值才能有助于提高量表的特异性。
综上,适用于肺癌外科的血栓风险评估模型应充分考虑普胸外科肺癌患者的特殊性危险因素,并结合更特异的实验室指标。虽然Caprini血栓风险评估模型评价胸外科肺癌手术患者均为VTE高风险人群,对强化预防VTE具有积极的临床指导意义。但对于中国胸外科围术期肺癌患者,当多数为高危分值的整体人群时,应用这两种血栓风险评估模型对VTE风险层级评估则有效性尚显不足,需要建立符合这类人群特质的肺癌外科血栓风险评估量表体系。本研究结果为单中心研究数据,仍需要进一步扩大样本量及进行多中心研究来验证。对于探索建立适用于我国的肺癌外科血栓风险评估模型,虽然我们找到了一些VTE相关危险因素(如COPD、非O型血型、手术时间≥90min、术后卧床时间>72小时、分期晚期、鳞癌等),但由于研究样本量较小,单中心研究的样本基线特征可能存在偏移,有必要纳入多中心研究数据,进一步对危险因素项目进行筛选和对权重因子进行修正。考虑到我国地域广阔,存在不同体质人群的特点,故仍需要更多的国内胸外科中心进一步的验证研究。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
