响应面法优化酿酒酵母中S-腺苷甲硫氨酸的提取工艺
2019-10-08张晓青张爱君司晓光王树勋曹军瑞
杜 瑾,张晓青,张爱君,司晓光,王树勋,曹军瑞*
(自然资源部天津海水淡化与综合利用研究所,天津 300192)
S-腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM)是一种有机四价硫形式甲硫氨酸磺酰基化合物,广泛存在于动植物和微生物体内,参与40多种生化反应,在转甲基、转氨丙基和转硫基中起重要作用,被称为“活性甲硫氨酸”[1]。临床上广泛用于肝炎、关节炎、抑郁症和各种肝病的治疗[2-3],在食品添加剂领域也有着巨大的市场需求。微生物发酵技术制备SAM具有成本低廉、易于操作等优点,是目前SAM工业化生产的主要方法[4],采用的微生物主要为酿酒酵母[5]、毕赤酵母[6]等酵母菌。
酵母菌积累SAM的能力较强,但由于SAM是胞内产物,在分离纯化过程中首先要破碎较厚的酵母细胞壁,最大限度地提取SAM产物。文献中报道较多的破碎酵母释放SAM方法主要是化学试剂法,其中应用最广的萃取剂为高氯酸和乙酸乙酯-硫酸[7-8]。高氯酸法的萃取效果近似达到100%,是早期提取SAM的主要方法,但高氯酸的危险性较高,目前仅用作萃取标准[9]。乙酸乙酯-硫酸法萃取率可达到90%,但有机溶剂用量大,提取成本和污染性均较高。近年来,开发安全、高效、环保的SAM提取工艺受到关注。如已有研究采用硫酸溶液在70 ℃热水条件[10]和4 ℃冷水条件[11]提取酿酒酵母胞内SAM。李继安等[12]采用无机强酸水溶液并冻融处理提取SAM。李勇等[13]采用高压氮气挤压式细胞破碎法破碎酵母细胞释放胞内SAM。
超声波可通过水介质的空化作用,使细胞壁结构破碎,释放内容物,在较短的提取时间内提高提取效率,具有设备需求低、操作简便、安全性好等优点,常用于食品工业中产物提取过程的强化和优化[14-15],可用于提取酵母细胞内活性物质[16-17]。本研究创新采用低浓度盐酸溶液作为提取液,辅以超声破碎酵母细胞,通过单因素试验、Plackett-Burman试验、最陡爬坡试验、响应面试验优化酿酒酵母胞内SAM提取的最佳工艺条件,为实现SAM的高效、环保制备提供参考。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)菌体由自然资源部第三海洋研究所提供。
SAM标准品 美国Sigma公司;甲醇、甲酸铵(均为色谱纯) 上海阿拉丁生化科技股份有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
ZHWY-2102C型恒温振荡器 上海智城分析仪器制造有限公司;3K15型高速冷冻离心机 德国Sigma公司;SFX550型超声波破碎仪 美国Branson公司;ACQUITY型超高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 SAM含量测定
采用超高效液相色谱测定SAM,检测方法参考文献[18]。色谱柱为BECH C18反相柱(2.1 mm×50 mm,1.7 μm);流动相0.01 mol/L甲酸铵,pH 3~4;流速0.3 mL/min;柱温30 ℃。二极管阵列检测器的检测波长为254 nm。SAM标准品及分析样品经0.22 μm微孔滤膜过滤后进样。
1.3.2 SAM提取量和提取率的计算
SAM提取量的计算如式(1)所示:

式中:C为根据标准曲线方程计算出测量液中SAM的质量浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;W为酿酒酵母菌体干质量/g。
SAM提取率的计算如式(2)所示:

式中:X为SAM提取量/(mg/g);X0为采用高氯酸法提取SAM的提取量/(mg/g)。
1.3.3 SAM提取液的筛选
准确称取0.2 g酵母干细胞,加入6 mL不同提取液,分别为1.5 mol/L高氯酸、1.5 mol/L盐酸、0.1 mol/L盐酸、0.01 mol/L盐酸、0.001 mol/L盐酸,常温振荡处理4 h;或加入2 mL乙酸乙酯-水溶液(体积比1∶1)振荡提取1 h后,再加入4 mL 0.4 mol/L硫酸溶液振荡提取3 h。4 ℃、8 000 r/min离心15 min,去除破碎菌体,收集上清液,用于SAM含量测定。以SAM提取量和提取率为指标,综合考虑有机溶剂用量、SAM稳定性等因素,选择合适的提取液。
1.3.4 超声辅助提取的单因素试验
以0.1 mol/L盐酸为提取液,固定超声辅助提取的基本参数为超声功率250 W、超声时间(指总的超声工作时间,下同)5 min、超声时间间隔10∶10 (工作时间∶间歇时间,s/s)、料液比1∶30 (g/mL)。在基本超声参数下,分别考察超声功率(100、150、200、250、300、350、400 W)、超声时间(1、2、3、4、5、6、7 min)、时间间隔(10∶3、10∶5、10∶8、10∶10、8∶10、5∶10、3∶10(s/s))、料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL))4 个因素对SAM提取量的影响。
1.3.5 Plackett-Burman试验
选择超声功率、超声时间、时间间隔、料液比4 个因素进行Plackett-Burman试验设计,考察SAM提取量,筛选出影响SAM提取量的重要因素。试验各因素与水平设计见表1。
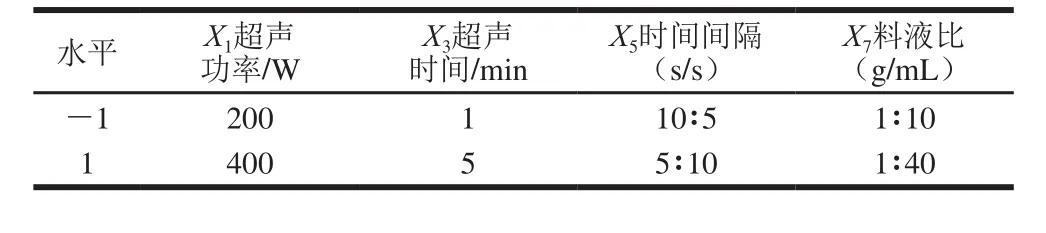
表1 Plackett-Burman试验设计因素与水平Table 1 Experimental factors and levels used in Plackett-Burman design
1.3.6 最陡爬坡试验
根据Plackett-Burman试验筛选出的显著影响因素的正负效应,设计最陡爬坡试验的爬坡方向和步长,使SAM提取量逼近最佳值反应区域[19]。
1.3.7 超声辅助提取SAM工艺条件的响应面优化试验
在Plackett-Burman试验及最陡爬坡试验基础上,采用Box-Behnken方法设计3因素3水平的响应面分析试验,对SAM提取工艺参数进行优化。试验各因素编码和水平设置见表2。

表2 Box-Behnken试验因素与水平Table 2 Factors and levels used in Box-Behnken design
1.4 数据处理
每组3 次平行实验,结果取平均值。采用Office Excel 2007软件进行统计分析和数据制图。Design-Expert 8.06软件进行响应面设计及结果分析。
2 结果与分析
2.1 SAM提取液及浓度的确定
传统工艺一般采用1.5 mol/L高氯酸或乙酸乙酯-硫酸提取酵母菌体胞内SAM。按照1.3.3节方法,选取不同提取液以及不同浓度的盐酸溶液,提取效果如表3所示。
由表3可知,1.5 mol/L高氯酸提取量最高,文献中通常作为SAM提取量100%计算。乙酸乙酯提取率达91.3%,与文献[7]报道一致。为降低操作危险性和对环境污染,本研究采用不同浓度盐酸提取酿酒酵母菌体中SAM,以期采用低浓度盐酸提取胞内SAM。结果显示,SAM提取量随盐酸浓度降低而降低。当盐酸浓度降低至0.01 mol/L时,提取率可达到65.7%;但当盐酸浓度降低至0.001 mol/L时,提取率降低至32.9%。同时,由于SAM在酸性条件下稳定,而盐酸浓度低于0.01 mol/L时,溶液pH值高于2,不利于SAM稳定性。因此,选取0.01 mol/L盐酸为提取液,进行下一步实验。
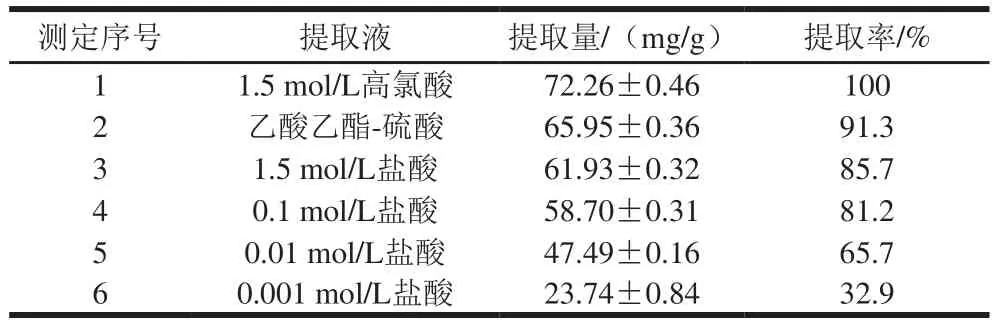
表3 不同提取液对SAM提取效果的影响Table 3 Effect of different solvents on the extraction yield of SAM
2.2 超声辅助提取的单因素试验结果
2.2.1 超声功率对SAM提取量的影响

图1 超声功率对酿酒酵母中SAM提取量的影响Fig. 1 Effects of ultrasonic power on the extraction yield of SAM from S. cerevisiae
由图1可知,酿酒酵母中SAM提取量首先随超声功率的增大而增加,当超声功率为300 W时达到最大,而后逐渐下降。这是由于超声功率越大,超声波在提取溶液中产生的空化效应和机械作用的强度越大,其破碎酵母细胞壁的效果越好[20],越有利于释放胞内SAM。但过高的超声功率会使SAM分子结构变化或降解,也会使更多的胞内杂质溶入提取液中,影响SAM提取量,增加后续分离纯化工艺的难度。因此,选择超声功率为300 W。
2.2.2 超声时间对SAM提取量的影响

图2 超声时间对酿酒酵母中SAM提取量的影响Fig. 2 Effects of ultrasonic irradiation time on the extraction yield of SAM from S. cerevisiae
由图2可知,在超声时间1~3 min范围内,SAM提取量随超声时间延长而增加,当超声时间为3 min时达到最大,而后SAM提取量趋于平缓,至7 min时明显下降。这是由于超声波对细胞壁的破坏能够随时间延长而更加充分,使胞内SAM完全释放,但过长的超声时间会造成天然活性产物降解[21]。因此,选择超声时间为3 min。
2.2.3 超声时间间隔对SAM提取量的影响

图3 超声时间间隔对酿酒酵母中SAM提取量的影响Fig. 3 Effects of ultrasonic irradiation interval on the extraction yield of SAM from S. cerevisiae
如图3所示,超声时间间隔10∶3~10∶10时,SAM提取量随间歇时间的延长而增加,而后随着时间间隔比值的减小,SAM提取量基本持平。这是由于超声波破坏酵母细胞壁的过程中伴随着热量积聚[22],间歇时间过短不利于热量扩散,且SAM具有热不稳定性,造成SAM降解、提取量降低。而当总工作时间一定时,胞内SAM已充分释放,即使增加间歇时间也不能提高SAM提取量,反而会增加SAM提取过程的总耗时。因此,选择超声时间间隔为10∶10(s/s)。
2.2.4 料液比对SAM提取量的影响

图4 料液比对酿酒酵母中SAM提取量的影响Fig. 4 Effects of solid-to-liquid ratio on the extraction yield of SAM from S. cerevisiae
由图4可知,在料液比1∶10~1∶25(g/mL)范围内,由于细胞内与溶剂间溶质浓度差随提取剂体积的增加而增大,传质推动力提高[23],SAM提取量随之增大。但在料液比达到1∶25(g/mL)之后,SAM已被充分提取,进一步增加提取剂用量,SAM提取量仍基本持平。综合考虑提取效果和提取剂成本,选择料液比为1∶25(g/mL)。
2.3 Plackett-Burman法筛选影响SAM提取效果的主要因素
以影响SAM提取量的超声条件作为4 个因素,选用N为12进行Plackett-Burman试验设计,X1、X3、X5、X7分别代表超声功率、超声时间、时间间隔、料液比,设计X2、X4、X6、X8、X9、X10空白作为误差分析项。每个因素分别选取了高(1)和低(-1)两个水平,以SAM产量作为响应值。Plackett-Burman试验设计和响应值见表4,每个试验设2 个平行样,结果取平均值。

表4 Plackett-Burman试验设计与结果Table 4 Plackett-Burman design with response variable
使用Design-Expert 8.06软件对Plackett-Burman试验结果进行方差分析,影响SAM产量因素主效应分析结果见表5。回归模型的主效应P小于0.000 1,说明Plackett-Burman试验设计因素在所选取的水平范围内对SAM提取量的影响显著。从SAM提取量响应值方面分析,时间间隔(X5,P=0.244 4)对SAM提取量影响不显著(P>0.05)。料液比(X7,P<0.000 1)、超声功率(X1,P=0.000 7)、超声时间(X3,P=0.019 4)对SAM提取量影响显著(P<0.05),其影响顺序为料液比>超声功率>超声时间。因此,选取该3 个因素进行最陡爬坡试验,进一步逼近其最佳区域。
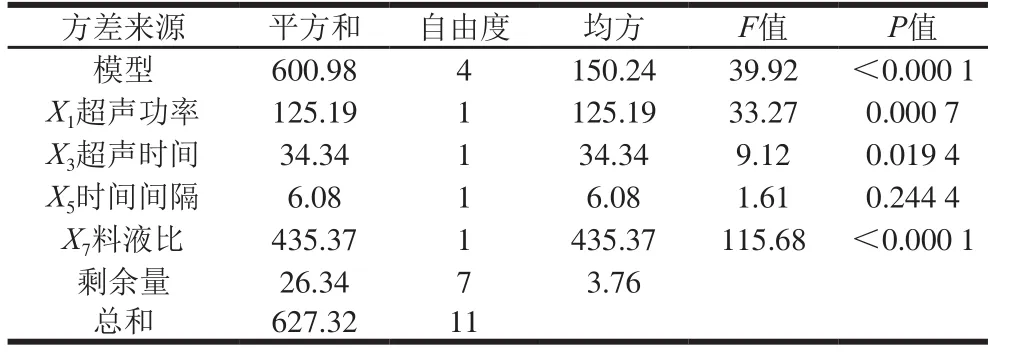
表5 SAM提取量影响因素主效应分析Table 5 Main effect analysis of the extraction yield of SAM versus various factors
2.4 最陡爬坡试验确定因素水平
由Plackett-Burman试验回归方程中确定的3 个重要因素的变量确定试验范围和爬坡步长,设计最陡爬坡路径[24],试验设计及结果见表6。可以看出,SAM提取量变化趋势为先上升再趋于平稳,在第4组试验中SAM提取量达到最大(55.45 mg/g)。因此,选择第4组试验的各因素取值作为响应面试验的中心点,即超声功率300 W、超声时间4 min、料液比1∶25(g/mL)。
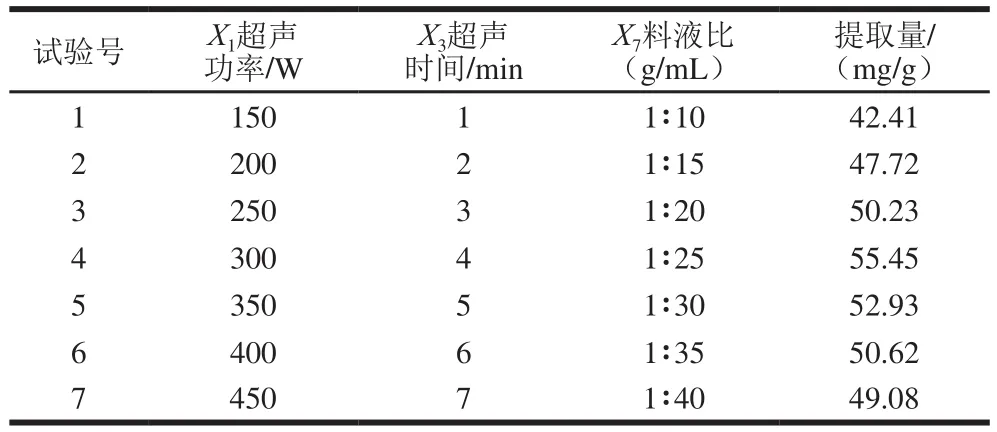
表6 最陡爬坡试验设计及结果Table 6 Steepest ascent design with experimental results
2.5 响应面试验优化SAM提取工艺
2.5.1 Box-Behnken试验结果
根据Plackett-Burman试验及最陡爬坡试验结果,采用Box-Behnken设计,以超声功率(X1)、超声时间(X3)、料液比(X7)为因变量共设计17 组试验,试验设计方案及结果见表7。

表7 Box-Behnken试验设计及结果Table 7 Box-Behnken design with experimental results
利用Design-Expert 8.06软件对表7试验数据进行多元回归拟合,得到以SAM提取量为响应值的回归方程为:

对回归模型作显著检验和方差分析,结果见表8。该模型的P值小于0.001,失拟项P值为0.094 4(>0.05),表明该模型失拟不显著,但回归极显著。该模型R2为0.968 4,调整后R2为0.927 7,表明该模型能够解释92.77%关键因素对酿酒酵母菌体中SAM提取量的影响,可以用其确定最佳提取工艺条件。

表8 Box-Behnken试验结果方差分析Table 8 Analysis of variance of quadratic polynomial model
从表8可知,回归方程一次项X3对SAM提取量的影响达到显著水平(P<0.05),X1、X7达到极显著水平(P<0.01),3 个因素对SAM提取量的影响顺序为:料液比(X7)>超声功率(X1)>超声时间(X3)。二次项为极显著。
2.5.2 响应面分析
响应面图是回归方程的形象描述,能够直观反映各个因素与响应值之间的关系以及两因素间交互作用的类型[25-27]。三因素的两两交互作用体现在相应曲面图中时,曲面呈马鞍型且等高线呈椭圆形表示两因素交互影响显著,而曲面呈圆滑型且等高线呈圆形则表示两因素之间交互作用不显著[28-29]。超声辅助低浓度盐酸提取酿酒酵母胞内SAM的工艺条件中,各因素交互作用的响应面及等高线见图5。

从图5可以看出,影响酿酒酵母胞内SAM提取量的3 个因素(超声功率、超声时间、料液比)两两因素交互作用的响应面图都较平缓,等高线图的椭圆形都较不明显,接近圆形,表明超声功率与超声时间、超声时间与料液比、超声功率与料液比之间有一定的交互作用,但交互效应均较弱。结合表8结果,交互项X1X3、X1X7、X3X7对试验结果的显著性分析均为P>0.05,表明超声功率、超声时间和料液比这3 个因素的两两交互作用不显著,与图5中响应面和等高线图所示结果一致。
上述回归模型的最佳值存在响应面最高点,等高线图的圆心,即SAM提取量最大时的稳定点,与之对应的因素水平即为最佳工艺条件[30]。通过Design-Expert 8.06软件计算得出,提取酿酒酵母胞内SAM的最佳条件为超声功率314 W、超声时间4.11 min、料液比1∶27(g/mL),在此优化条件下,SAM提取量的理论值为65.92 mg/g。
2.5.3 验证实验
鉴于实际操作的可行性,将SAM提取条件修正为超声功率314 W、超声时间4.1 min、料液比1∶27(g/mL),平行实验3 次,得到的SAM提取量为66.56 mg/g,与预测值相差0.98%,说明用该模型所获得的优化提取条件可靠。此时,以高氯酸法提取率为100%所计算的SAM提取率为92.1%。
3 结 论
本研究比较了高氯酸、乙酸乙酯-硫酸和不同浓度盐酸对酿酒酵母菌胞内SAM提取量和提取率的影响,选取0.01 mol/L盐酸为提取液。在单因素试验的基础上,通过Plackett-Burman试验和最陡爬坡试验得出了关键影响因素及水平,最后利用Box-Behnken法设计响应面试验获得最优工艺条件为超声功率314 W、超声时间4.1 min、料液比1∶27(g/mL),此时SAM提取量为66.56 mg/g,SAM提取率可达92.1%。此方法以较低浓度盐酸为提取液并辅以超声波破碎细胞壁,与传统的高氯酸法和乙酸乙酯-硫酸法相比,有机溶剂用量少、安全性较高,有利于SAM的进一步研究和产品开发。
