1 株裂解性短尾沙门氏菌噬菌体T139的生物学特性及其对牛奶和牛肉的抑菌作用
2019-10-08聂若男李晚宁杨其乐王小红
聂若男,李晚宁,杨其乐,王小红,王 佳*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
沙门氏菌(Salmonella)是一种常见的革兰氏阴性细菌,属于肠杆菌科,在许多发达国家和发展中国家是引起食源性细菌感染的重要原因之一[1]。沙门氏菌作为最常见的食源性病原体之一,每年约导致9 380万 例食源性疾病和155 000 人死亡[2]。大多数沙门氏菌的感染主要是由于食用了被沙门氏菌污染的食物,主要来源于家禽、蛋和乳制品中,新鲜的水果、蔬菜也逐渐成为传播沙门氏菌的途径之一[3-4]。感染沙门氏菌的可能症状包括腹泻、发烧、腹部绞痛、恶心、偶尔呕吐和头痛,并且通常在食用后12~72 h出现并持续4~7 d[5]。因此,一直以来,沙门氏菌受到全世界各国的广泛关注。特别是随着人类抗生素的滥用,随即产生了多重耐药病原菌甚至产生超级细菌,食源性病原菌耐药性问题越来越严重[6]。因此,对于食源性病原菌的控制除传统的抗生素之外,必须开发新的治疗策略,其中策略之一就是使用噬菌体[7]。
噬菌体是自然界中最丰富的生物之一,在地球上大约蕴藏着1031的噬菌体颗粒,也就是平均每1 g土壤或水中包含了多达108数量的噬菌体,长期以来一直被认为可以用作治疗药物和杀菌剂[8]。噬菌体对某些细菌菌株具有高度特异性,不会影响生物体或内源性组织的正常运转,另外,即使随着细菌耐药性的发展,噬菌体仍会大量保持[9]。过去几年中,使用噬菌体来抑制食物中的腐败细菌和病原体的生长受到越来越多研究者的关注,并且该方法已有许多研究支持。例如在蜜瓜切片[10]、鸡胸肉、白菜、牛奶[11]、鸡皮[12]、豆芽菜[13]等食品中发现使用噬菌体制剂后沙门氏菌菌量显著减少。另外,已从多种食物如碎牛肉[14]、猪肉等肉制品[15]、奶制品[16]、生菜[17]等分离出沙门氏菌噬菌体,因此,噬菌体是食品中的天然微生物。
本研究以鼠伤寒沙门氏菌为宿主菌从下水道污水中分离纯化得到1 株烈性噬菌体,通过实验研究其形态、宿主范围、一步生长曲线、吸附速率、最佳感染复数(multiplicity of infection,MOI)以及温度和酸碱稳定性等基本的生物学特性,并评估易被沙门氏菌污染的食品中利用噬菌体控制鼠伤寒沙门氏菌的潜力和功效,为制备噬菌体抗菌剂抑制沙门氏菌污染提供理论支持。
1 材料与方法
1.1 材料与试剂
鼠伤寒沙门氏菌(Salmonella typhimuriumATCC 13311)以及其他测定宿主谱所用菌株均为实验室保存菌种;污水样品来自于湖北省武汉市某下水道。
胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、大豆蛋白琼脂(trypticase soy agar,TSA)、琼脂 青岛高科园海博生物技术有限公司;0.22 μm微孔滤膜德国Millipore公司;脱脂乳粉 美国BD-Difco公司。
双层琼脂培养基:下层培养基为固体TSA培养基、上层培养基为半固体TSB培养基+0.7%琼脂粉。
1.2 仪器与设备
5417R小型台式冷冻离心机 德国Eppendorf公司;Allegra X-30R台式高速冷冻离心机 美国Beckman Coulter公司;BSO-130011A2超净台 苏净集团苏州安泰空气技术有限公司;HNY-2102C全温振荡培养箱武汉瑞华仪器设备有限责任公司;YX 600W高压灭菌锅上海三申医疗器械有限公司;WH-2微型旋涡混合仪上海沪西分析仪器厂有限公司;M200 PRO酶标仪瑞士Tecan公司;7000FA100 KV透射电子显微镜 日本日立高新技术公司。
1.3 方法
1.3.1 噬菌体的分离和纯化
1.3.1.1 宿主菌株的复苏与培养
挑取鼠伤寒沙门氏菌ATCC 13311单菌落接种于10 mL TSB液体培养基中,160 r/min、37 ℃摇床中培养8 h。再按照1∶100的比例转接到装有10 mL新鲜的TSB液体培养基中,振荡培养3 h。培养液用稀释涂平板法进行计数,备用。细菌数量按式(1)计算:

1.3.1.2 噬菌体的分离纯化及效价测定
参照蔡天舒等[18]的方法进行改进,使用双层平板法进行噬菌体的分离和纯化。取来自湖北省武汉市某下水道的污水,使用滤纸过滤后,离心并用0.22 μm微孔滤膜过滤除菌,取5 mL滤液与2.5 mL培养至对数期的鼠伤寒沙门氏菌ATCC 13311及10 mL TSB培养基过夜培养,混合培养液经8 000 r/min、4 ℃离心10 min,上清液经0.22 μm微孔滤膜过滤后即得到噬菌体原液。采用双层平板的方法进行噬菌体的纯化,操作如下:取100 μL合适梯度噬菌体液、100 μL宿主菌和4 mL半固体培养基混合倒于TSA下层平板上,待凝固后于37 ℃培养箱培养6 h左右,使用白枪头挑取大小一致的典型噬菌斑于1 mL TSB培养基中,加入100 μL生长至对数期的鼠伤寒沙门氏菌,37 ℃条件下培养12~18 h,8 000 r/min、4 ℃离心10 min,得上清液。单一噬菌斑反复纯化3~5 次直至噬菌斑大小基本一致即得到纯化的噬菌体。
将纯化后的噬菌体原液进行10 倍梯度稀释,取合适梯度的稀释液100 μL与100 μL宿主菌混合,加入4 mL温热的培养基倒双层平板,37 ℃培养6 h,按式(2)计算噬菌体效价:

1.3.2 噬菌体的生物学特性
1.3.2.1 噬菌体形态观察
采用磷钨酸负染色法[19],取20 μL高效价噬菌体液和20 μL体积分数2%、pH 7的磷钨酸分别滴加在封口膜上。轻取铜网,先浸没于噬菌体液中10 min之后用滤纸吸去多余液体。再将铜网置于磷钨酸染料中染色10 min后吸去多余液体,自然晾干至完全干燥,制备好的铜网在透射电子显微镜下观察噬菌体形态,并用软件Digital Micrograph Demo 3.9.1测量其大小。
1.3.2.2 噬菌体宿主谱测定
采用点样法进行宿主谱的测定。取100 μL培养至对数期的标准菌株加入到温热的半固体培养基中,混匀后倒入预先制备好的TSA平板上,待凝固后,取5 μL效价109PFU/mL的噬菌体滴加至上层平板表面,干燥后置于37 ℃培养箱培养4~6 h,观察裂解情况。
1.3.2.3 噬菌体最佳MOI测定
MOI指初始感染时噬菌体数量与宿主菌数量的比值。按一定的MOI值(0.001、0.01、0.1、1、10、100、1 000)将噬菌体与宿主菌混合,37 ℃培养3.5 h,11 000 r/min离心10 min,用双层平板法测定不同MOI值样品中上清液的噬菌体效价。实验重复3 次,每次设2 个平行。
1.3.2.4 噬菌体吸附速率
按最适MOI值将新鲜噬菌体液与宿主菌悬液混合于离心管中,置于37 ℃摇床培养。从0 min开始,每隔2 min采用双层平板法测定上清液中噬菌体效价。实验重复3 次,每次设2 个平行。
1.3.2.5 噬菌体一步生长曲线
1.3.2.6 噬菌体热稳定性
将噬菌体原液稀释至106PFU/mL,并分装于1 mL无菌离心管中,将离心管分别放置于30、40、50、60、70、80 ℃的恒温水浴锅中,0、30 min和 60 min时测定各管中噬菌体的效价。实验重复3 次,每次设2 个平行。
1.3.2.7 噬菌体pH值稳定性
取已知效价的噬菌体悬液(107PFU/mL)100 μL加入到900 μL不同pH值(2~13)的磷酸盐缓冲液(phosphate buffered saline,PBS)中,将其置于37 ℃水浴锅2 h后测定各离心管中噬菌体的效价。实验重复3 次,每次设2 个平行。
1.3.2.8 噬菌体对宿主菌的裂解曲线
噬菌体分别按照MOI为100、10、1、0.1、0.01、0.001,各取100 μL加入96 孔板中,并加入100 μL 107CFU/mL的沙门氏菌菌液。另设阴性对照组加入200 μL TSB培养基;阳性对照组加入100 μL 107CFU/mL的沙门氏菌菌液和100 μL TSB培养基。每隔1 h测定600 nm波长处的OD值,共测定10 h。
1.3.3 噬菌体在牛奶和牛肉中的抑菌实验
1.3.3.1 噬菌体在牛奶中的应用
1.3 文献筛选及资料提取 由2位研究者独立进行文献筛选和资料提取,并交叉核对,如意见分歧,则讨论解决或交由第三位研究者裁决,缺乏的资料应尽量与原作者联系予以补充。文献筛选是首先阅读标题,在排除明显不相关的文献后,进一步阅读摘要和全文,以确定最终是否纳入研究。资料提取内容包括:①纳入研究的基本信息,包括作者、发表时间、文献来源等;②研究对象干预措施的具体细节;③偏倚风险评价的关键要素;④结局指标和测量结果数据。
参照Huang Chenxi等[20]的方法并进行改进,使用产自美国的新鲜脱脂牛奶,并根据制造商的说明进行灭菌。在接种10 μL鼠伤寒沙门氏菌ATCC 13311(106CFU/mL)的牛奶中加入MOI=10和MOI=100的相应噬菌体100 μL,在对照组牛奶中加入等体积的PBS,将样品在4 ℃或25 ℃温育。温育0、1、3、6、9 h和12 h后,取出等分试样通过连续平板稀释法进行细菌计数(CFU/mL)。实验重复2 次,每次设2 个平行。运用Graphpad Prism软件进行绘图和分析,实验数据采用ANOVA进行邓肯氏差异分析方法分析(P<0.05,差异显著)。
1.3.3.2 噬菌体在牛肉中的应用
参照Huang Chenxi等[20]的方法将在超市购买的新鲜牛肉使用无菌刀切成特定尺寸(直径1 cm,厚度0.5 cm)并置于无菌培养皿中。紫外照射牛肉样品正反面各0.5 h后确保无菌。在牛肉丁上接种10 μL鼠伤寒沙门氏菌ATCC 13311(106CFU/mL),将样品置于安全柜中干燥15~20 min,然后按照MOI=10和MOI=100加入噬菌体10 μL并在对照组的牛肉丁中加入等体积的PBS,置于4 ℃或25 ℃温育。在温育0、1、3、6、9 h和12 h后取样,将牛肉丁加入到5 mL无菌缓冲溶液中,使用研磨棒充分研磨,并在99 W超声波清洗器中清洗样品5 min,以获得匀浆样品,通过连续平板稀释法进行细菌计数(CFU/mL)。实验重复2 次,每次设2 个平行。运用Graphpad Prism软件进行绘图和分析,实验数据采用ANOVA进行Duncan差异分析(P<0.05,差异显著)。
2 结果与分析
2.1 噬菌体的分离纯化及效价测定

图1 噬菌体T139的噬菌斑形态Fig. 1 Bacteriophage plaques of T139
如图1所示,通过双层平板法经过5 次纯化后,噬菌体T139所形成的噬菌斑形态和大小保持均匀一致,呈圆形透明状态,直径约为6 mm,其原液效价高达109PFU/mL。
2.2 噬菌体的生物学特性
2.2.1 噬菌体形态

图2 噬菌体T139的透射电子显微电镜图Fig. 2 TEM micrograph of T139
噬菌体T139高浓度裂解液经过透射电子显微镜观察,如图2所示,该噬菌体具有直径为(43±1)nm的二十面体头部,长(11±0.6)nm的非收缩性尾部,符合短尾噬菌体科特征,因此鉴定噬菌体T139为短尾噬菌体。
2.2.2 噬菌体宿主谱
采用点样法测定噬菌体的宿主范围,由表1可见,噬菌体T139不能裂解大肠杆菌、金黄色葡萄球菌、单核细胞性李斯特菌和副溶血弧菌,只能裂解沙门氏菌属,说明噬菌体T139仅对沙门氏菌属具有特异性。并且噬菌体T139能够裂解鼠伤寒沙门氏菌、肠炎沙门氏菌、猪霍乱沙门氏菌、鸡白痢沙门氏菌、都柏林沙门氏菌和阿哥拉沙门氏菌等部分耐药菌株,说明噬菌体T139宿主谱较为广泛并且能裂解部分从肉制品中分离的耐药菌株。

表1 噬菌体T139的宿主范围Table 1 Host range of phage T139
2.2.3 噬菌体最佳MOI

表2 噬菌体T139的最佳MOI测定结果Table 2 Determination of optimal multiplicity of infection (MOI)
由表2可知,噬菌体T139在MOI为0.001时,噬菌体效价最高为1.24×1010PFU/mL,因此噬菌体T139的最佳MOI为0.001。
2.2.4 噬菌体吸附速率

图3 噬菌体T139的吸附速率Fig. 3 Adsorption rate of phage T139
由图3可知,噬菌体T139在6 min时吸附速率达到最大,约66%,且噬菌体T139与宿主菌作用12 min后开始释放子代噬菌体。
2.2.5 噬菌体一步生长曲线

图4 噬菌体T139的一步生长曲线Fig. 4 One step growth curve of phage T139
由图4可知,噬菌体T139在前5 min曲线趋势保持平稳,即判断噬菌体T139的潜伏期为5 min,之后噬菌体的效价急剧增加,在70 min之后逐渐保持平稳,即判断噬菌体爆发期为60 min。裂解量为裂解末期噬菌体效价与感染初期宿主菌菌量之比,得出噬菌体T139的裂解量为54.54 PFU/cell。
2.2.6 噬菌体热稳定性
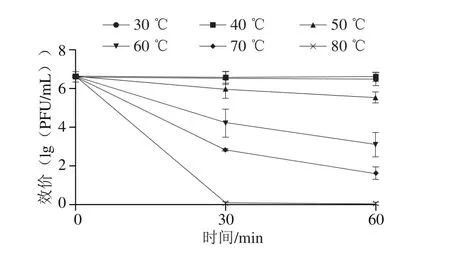
图5 噬菌体的热稳定性Fig. 5 Thermal sensitivity of phage T139
由图5可知,噬菌体在30~50 ℃以内活性保持稳定,在60 ℃和70 ℃时噬菌体T139活性大约减少一半,在高温80 ℃时基本失活。由此可知,噬菌体T139对高温耐受性较差,适合在50 ℃及以下环境中生存。
2.2.7 噬菌体pH值稳定性
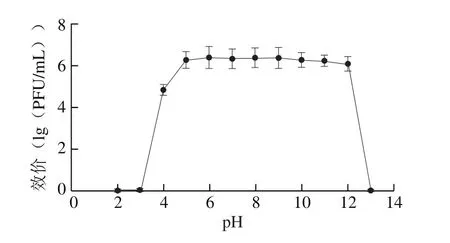
图6 噬菌体的pH值稳定性Fig. 6 pH sensitivity of phage T139
由图6可知,噬菌体T139在pH 4~12范围内活性保持稳定,说明该噬菌体对酸碱的耐受力较强;而pH值低于4或者大于12时噬菌体基本失活。由此可知,噬菌体T139的最适pH值范围为4~12。
2.2.8 噬菌体对宿主菌的裂解曲线

图7 噬菌体T139在不同MOI值下裂解宿主菌的曲线Fig. 7 Time-course curves of host cell lysis by phage T139 with different MOIs
如图7所示,与未加噬菌体T139的阳性对照相比,噬菌体T139在7 h内不同MOI值下都可以抑制鼠伤寒沙门氏菌的生长,在7 h后曲线开始有所上升,说明宿主菌没有被完全杀死且菌量有所上升。并且阳性对照组曲线与沙门菌正常的生长曲线相符。实验结果表明噬菌体T139对宿主菌有较强裂解作用,但不能完全杀死宿主菌。因此该结果为噬菌体T139的抑菌实验提供依据。
2.3 噬菌在牛奶和牛肉中的抑菌实验
2.3.1 噬菌体在牛奶中的抑菌作用

图8 4 ℃(A)和25 ℃(B)噬菌体在牛奶中的抑菌效果(MOI=10和MOI=100)Fig. 8 Inactivation of S. typhimurium in milk by T139 with MOI of 10 and 100 at 4 ℃ (A) and 25 ℃ (B)
由图8A可知,4 ℃时,对照组的鼠伤寒沙门氏菌菌量12 h内一直处于与初始菌量相当的状态,实验组在按照MOI=10和MOI=100加入噬菌体的情况下,沙门氏菌菌量并没有显著降低。由图8B可知,25 ℃时,对照组鼠伤寒沙门氏菌从初始菌量3.57(lg(CFU/mL)),经过12 h增加到8.20(lg(CFU/mL)),而实验组在按照MOI=10和MOI=100加入噬菌体的情况下,沙门氏菌菌量从6 h开始显著降低,至最终12 h,相比于对照组MOI=10和MOI=100时分别下降4.32(lg(CFU/mL))和4.27(lg(CFU/mL)),抑菌效果非常明显。
2.3.2 噬菌体在牛肉中的抑菌作用

图9 4 ℃(A)和25 ℃(B)噬菌体在牛肉中的抑菌效果(MOI=10和MOI=100)Fig. 9 Inactivation of S. typhimurium in beef by T139 with MOI of 10 and 100 at 4 ℃ (A) and 25 ℃ (B)
由图9A可知,4 ℃时,对照组鼠伤寒沙门氏菌菌量在12 h内一直处于与初始菌量相当的状态,实验组在按照MOI=10加入噬菌体的情况下,沙门氏菌菌量并没有显著下降;但是按照MOI=100加入噬菌体时,3 h后沙门氏菌菌量有显著下降,最终相比于对照组下降0.66(lg(CFU/mL))。由图9B可知,25 ℃时,对照组鼠伤寒沙门氏菌菌量在12 h内只是略有增加,实验组在按照MOI=10加入噬菌体的情况下,沙门氏菌菌量从3 h开始有显著下降,相比与对照组下降0.77(lg(CFU/mL));在按照MOI=100加入噬菌体时,1 h后沙门氏菌菌量已开始有显著下降,最终相比于对照组下降1.16(lg(CFU/mL)),抑菌效果明显。
3 讨 论
沙门氏菌一直以来都是导致人类食源性疾病发生的重要病原微生物之一。在引起感染的20余种沙门氏菌不同血清型中,鼠伤寒沙门氏菌和肠炎沙门氏菌占27.9%[21]。抗菌剂例如化学药物或化学杀菌剂可以减少或消除微生物,被认为是减少沙门氏菌污染的最有效方法。然而,持续使用抗菌药物已经产生了某些副作用,例如食品中抗生素残留物和多药耐药性沙门氏菌菌株的出现,如鼠伤寒沙门氏菌DT104[22]。因此,新的生态友好型策略用作抗沙门氏菌的生物防治剂随即出现[11]。近年来,噬菌体由于其优良特性而受到了新的关注,例如具有靶标特异性但不损害共存的微生物群落、固有的低毒性、对恶劣环境的稳健性、广泛分布性和自我复制以及相对便宜和易生产等优势[23-25]。本研究在实验室从污水中分离出1 株裂解性鼠伤寒沙门氏菌噬菌体,并对其生物学特性进行了全面研究。同时,测定了该噬菌体对于牛奶和牛肉中沙门氏菌的抑菌效果,为该噬菌体作为抗菌剂奠定了实验基础并提供理论依据。
本研究分离得到的噬菌体属于有尾噬菌体目,短尾噬菌体科。目前已从不同的环境和食品中分离出几千种针对不同靶标的噬菌体,其中,长尾噬菌体科是最丰富的,占噬菌体总量的61.6%;其次是具有收缩性尾巴的肌尾噬菌体科占24.5%;而短尾噬菌体科只占14.9%[26]。而本研究筛选到的噬菌体T139是短尾噬菌体。该噬菌体在良好的培养条件下与宿主菌接触12 min内就能完成吸附并产生噬菌体后代,潜伏期短只有5 min,噬菌体的温度耐受性在50 ℃以内,酸碱耐受性在pH 4~12,这与Jung等[27]研究中噬菌体P22-B1及P22的温度及酸碱耐受性一致,这种耐受性为噬菌体制剂的生产以及灭活提供了便利。
噬菌体T139应用于牛奶的抑菌实验中,在4 ℃时并没有显著抑制效果,这是因为低温是噬菌体感染力低的原因之一,低温阻碍了微生物的生长,而噬菌体依赖于其宿主的繁殖[20]。然而,当在25 ℃时,在以MOI=10和MOI=100加入噬菌体时,沙门氏菌菌量分别下降4.32(lg(CFU/mL))和 4.27(lg(CFU/mL)),杀菌率达到了50%以上。噬菌体T139在牛奶中25 ℃时杀菌效果好,这可能是因为在牛奶这样的液体食品基质中,流动性较好,噬菌体能够更充分地接触到宿主菌而将其杀灭。Bao Hongduo等[11]在25 ℃时将噬菌体vB_SenMPA13076按照MOI=10 000加入沙门氏菌污染的牛奶中时,作用5 h后菌量降低了约2 个数量级,这与本研究中噬菌体T139作用效果相当,但其使用的MOI值较高。噬菌体T139应用于牛肉中时,在4 ℃时以MOI=100加入噬菌体时沙门氏菌菌量下降了0.66(lg(CFU/mL));25 ℃时,噬菌体以MOI=10或MOI=100加入时,沙门氏菌菌量分别下降了0.77(lg(CFU/mL))和1.16(lg(CFU/mL)),具有一定的抑菌效果,且在MOI=100时抑菌效果比MOI=10时抑菌效果强。Liu Hui等[28]研究4 株大肠杆菌噬菌体分别在各自不同MOI下对大肠杆菌的抑菌效果,其中3 株噬菌体均在高MOI下即MOI=1 000时抑菌效果更强,因此,本研究为达到更好的抑菌效果,可以在未来的研究中提高MOI(1 000或10 000)加强抑菌效果。该噬菌体T139作为一种天然抗菌剂,表现出了较强的温度稳定性和酸碱稳定性以及在低MOI即MOI=10和MOI=100时对鼠伤寒沙门氏菌较好的抑制作用,因此可以用来控制食品中沙门氏菌的污染,为该噬菌体作为抗菌剂的应用提供了实验依据。
